Среди многих причин нарушения фертильности большую роль играет снижение имплантационных
свойств эндометрия. Для осуществления успешной имплантации бластоцисты необходима не только нормальная анатомическая структура эндометрия, но и его функциональная состоятельность – адекватная восприимчивость в период «имплантационного окна».
Различные патологические изменения эндометрия могут приводить к нарушению его рецептивности и, как следствие, к дефектам имплантации (неоднократным неэффективным программам экстракорпорального оплодотворения – ЭКО или повторным абортам на ранних сроках беременности). Установлена прямая зависимость между частотой наступления и вынашивания беременности и благополучным состоянием слизистой оболочки матки [1, 5, 8]. В связи с этим с целью подготовки к программе ЭКО оправданно проводить комплексное обследование состояния эндометрия, оценку его органической и функциональной состоятельности и, при необходимости, коррекцию патологических изменений.
В практической деятельности клиницисты ограничены традиционными методами обследования, которые обладают низкой диагностической ценностью (ультразвуковое исследование, определение уровня стероидных гормонов в плазме крови). При изучении имплантационных свойств эндометрия в циклах обследования можно применить инвазивные методы, которые являются максимально диагностически ценными. Полученные при этом результаты формируют лечебную тактику при подготовке к ЭКО и в самих программах.
Эндометрий может находиться в различных функциональных состояниях, которые включают нейтральную, рецептивную и нерецептивную, или рефрактерную фазы [1, 4, 5, 11]. Именно рецептивность эндометрия (способность адекватно реагировать на циклические колебания уровней стероидных гормонов крови) формирует необходимые ультраструктурные изменения в эндометрии для возникновения «имплантационного окна» и, в конечном результате, обеспечивает имплантацию оплодотворенной яйцеклетки, наступление и развитие беременности. Специфическим морфологическим маркером полноценной рецептивности эндометрия является появление пиноподий в покровном эпителии [4, 5, 8, 9, 19]. Пиноподии визуализируются в виде эктоплазматических протрузий на апикальной поверхности эпителиоцитов. Их активность ограничена коротким временнdм периодом, соответствующим «окну имплантации», который, по данным литературы, продолжается 36–48 часов [1, 9, 16].
В естественном менструальном цикле полное развитие пиноподий (расцвет) происходит на 6–8-й день после овуляции (19–23-й день менструального цикла) [1, 4, 7–9, 11]. При этом в зависимости от площади, занимающей эпителиальный покров, пиноподии характеризуются как изобилующие, умеренные и не выраженные (более 50, 20–50, менее 20% соответственно) [6, 10, 11].
Как известно, основными регуляторами морфологических и функциональных изменений в эндометрии в течение менструального цикла являются синтезируемые в яичниках стероиды (эстрогены и прогестерон) [3, 5, 10].
Поскольку действие стероидных гормонов осуществляются путем связывания со специфическими ядерными рецепторами функционального слоя эндометрия, логично предположить, что дефект экспрессии прогестероновых (ПР) и эстрогеновых (ЭР) рецепторов может привести к нарушению морфофункциональных свойств эндометрия в период «имплантационного окна». Решающим является не столько абсолютное содержание стероидных гормонов в плазме крови, сколько количество и соотношение полноценных рецепторов в эндометрии [3, 5, 12, 21]. Таким образом, определение ПР и ЭР методом иммуногистохимического (ИГХ) окрашивания препаратов с биоптатами (их концентрация и соотношение между собой) в средне секреторную фазу позволяет уточнить и дополнить патоморфологическое исследование и может стать одним из ценных диагностических маркеров восприимчивости эндометрия к эмбриону [3–5].
Под влиянием стероидных гормонов находится не только появление и созревание пиноподий, но и экспрессия большинства идентифицированных молекул, вовлеченных в процесс имплантации эмбриона. Наиболее активно в литературе обсуждается вклад в процесс имплантации фактора, ингибирующего лейкемию (ЛИФ). Этот цитокин присутствует практически во всех клеточных структурах и тканях репродуктивного тракта. Функцию ЛИФ можно проследить на самых различных этапах репродуктивных процессов, начиная с роста и развития гамет и заканчивая наступлением и прогрессированием беременности [2, 13–15].
Наиболее интересными оказались результаты исследования функции ЛИФ в эндометрии человека, где этот цитокин продуцируется в течение всего менструального цикла и достигает максимума в средне секреторную фазу, в период «имплантационного окна», что сопряжено с максимальным числом зрелых пиноподий [12, 14, 18, 20].
В связи с этим интерес исследователей сосредоточен на выявлении диагностической ценности определения числа эпителиальных клеток с наличием зрелых пиноподий, характером экспрессии стероидных рецепторов и уровнем экспрессии цитокина ЛИФ в оценке имплантационных возможностей и рецептивности эндометрия. Не до конца изученными остаются также особенности рецептивности эндометрия у пациенток различных клинических групп.
Целью данного исследования явилась клиникоморфологическая и ИГХ оценка рецептивности эндометрия у женщин с безуспешными программами ЭКО в анамнезе на основании определения числа клеток поверхностного эпителия с наличием зрелых пиноподий, изучения характера экспрессии рецепторов к стероидным гормонам и ЛИФ.
Материал и методы исследования
Исследованы образцы функционального слоя эндометрия 42 женщин, взятые на 19–25-й день овуляторного менструального цикла в период предположительного «имплантационного окна». Из них – 36 женщин основной группы с неудачными попытками ЭКО в анамнезе и 6 фертильных женщин репродуктивного возраста, составивших группу контроля.
У пациенток, включенных в исследование, проводили морфологическую и ИГХ оценку биоптатов функционального слоя эндометрия, полученных в период «имплантационного окна» овуляторного
менструального цикла.
Критериями исключения пациенток из исследования явились: применение оральных или внутриматочных средств контрацепции в течение последних 6 мес и наличие признаков органической патологии эндометрия (хронического эндометрита и гиперпластических процессов).
Биопсию эндометрия проводили в асептических условиях без предварительной анестезии из области дна матки с помощью аспирационной кюретки на 6–8-й день после овуляции. Овуляция отслеживалась совместно с помощью двух методов: ультразвукового мониторинга цикла, а также определения пика ЛГ в моче. Материалы биоптатов фиксировали в 10% нейтральном формалине в течение 24 часов. Образцы были обработаны по общепринятой стандартной методике и заключены в парафин. Срезы толщиной 5 мкм готовили на роторных микротомах и окрашивали гематоксилином и эозином. Исследование гистологических препаратов проводили в световом микроскопе при увеличении от х50 до х400. Гистологическое датирование эндометрия, оценку процента клеток поверхностного эпителия с наличием зрелых пиноподий осуществляли в световом микроскопе при увеличении х400 в 5 полях зрения. ИГХ реакции проводили на депарафинированных срезах толщиной 4–5 мкм по общепринятым протоколам (DAKO protocols).
Определение стероидных рецепторов проводилось с использованием мышиных моноклональных антител к ЭРα (клон 1D5 «DAKO», США; разведение 1:35) и ПР (клон 636 «DAKO», США; разведение 1:50). Для выявления экспрессии ЛИФ использовали первичные антитела к ЛИФ (R@D Systems, USA, clone: 9824, mouse anti-human antibody).
Результаты для ЭР и ПР анализировали с учетом количества окрашенных клеток и интенсивности
окраски в поверхностном эпителии, железах и строме эндометрия, используя метод гистологического счета HISTO Score по формуле: HS=1а+2b+3c, где а – % слабо окрашенных клеток, b – % умеренно окрашенных клеток, с – % сильно окрашенных клеток. 1, 2, 3 – интенсивность окрашивания, выраженная в баллах. Степень выраженности экспрессии ЭР и ПР расценивали как: 0–10 % – отсутствие экспрессии, 11–100 % – слабая экспрессия, 101–200% – умеренная экспрессия, 201–300 % – выраженная экспрессия. Результаты ИГХ реакции для ЛИФ оценивали полуколичественным методом в баллах по общепринятой методике: отсутствие иммуноокрашенных клеток (-) – 0 баллов; менее 5% иммуноокрашенные клетки (±) – 0,5 балла, менее 20% иммуноокрашенных клеток (+) – 2 балла; от 20 до 40% окрашенных клеток (++) – 4 балла; более 40% окрашенных клеток (+++) – 6 баллов.
Результаты исследования
Возраст пациенток группы исследования (n=36) колебался от 26 до 39 лет и в среднем составил
33,1±3,35 года. Первичное бесплодие отмечено у 21 (61 %), а вторичное – у 13 (39%) пациенток. Продолжительность бесплодия колебалась от 3 до 14 лет (в среднем 6,5± 3,2 года).
Пациентки группы исследования готовились к продолжению лечения бесплодия методом ЭКО. Всем им
ранее было проведено от 1 до 3 попыток ЭКО, при этом регистрировались адекватные параметры фолликулогенеза (от 7 до 18 фолликулов преовуляторного размера), оогенеза (получено от 6 до 15 зрелых ооцитов хорошего качества) и эмбриогенеза (число эмбрионов хорошего качества от 5 до 10). Толщина и структура эндометрия, по результатам ультразвукового мониторинга, в программах ЭКО не отличались от нормы: в преовуляторный период 9±1,9 мм с «трехслойной» структурой, а в день переноса эмбрионов наблюдался эндометрий с характерной секреторной трансформацией, толщиной 11±2 мм.
Группу контроля составили женщины репродуктивного возраста, имеющие регулярный менструальный
цикл и подтвержденную фертильность (хотя бы одну самостоятельную беременность и роды в анамнезе). В контрольной группе (n=6) при морфологическом исследовании биоптатов наблюдали эндометрий ранней и средней стадий фазы секреции. При изучении поверхностного эпителия и оценке числа клеток с наличием пиноподий, было обнаружено, что в среднем 50% клеток поверхностного эпителия содержат зрелые пиноподии (от 40 до 60%). При ИГХ исследовании выявлено высокое и умеренное содержание ПР и ЭР как в железистых структурах, так и в ядрах клеток стромы (рис. 1, cм. на вклейке). Соотношение рецепторов ПР/ЭР оказалось в диапазоне от 2 до 5 и в среднем составило 2,9. У пациенток этой группы отмечалась высокая экспрессия ЛИФ (5–6 баллов) как в апикальной части покровного эпителия, так и в железах.
В группе исследования у 18 женщин выявлены признаки хронического эндометрита (наличие в эндометрии воспалительных инфильтратов, очаговое фиброзирование стромы), а у одной пациентки – признаки гиперплазии эндометрия без атипии. Данные пациентки были исключены из исследования, им была предписана специфическая терапия. Остальные биоптаты, полученные от 27 женщин, у которых не выявили органической патологии эндометрия, были подготовлены для последующего ИГХ исследования. У 26 из них морфологическая картина эндометрия соответствовала ранней и средней стадиям фазы секреции, а у одной женщины наблюдался эндометрий поздней стадии фазы пролиферации. У этой пациентки бесплодие было обусловлено эндокринным фактором. Обследование проводилось в цикле с собственной овуляцией. В день забора биоматериала при ультразвуковом исследовании органов малого таза была зарегистрирована толщина эндометрия 8 мм, структура эндометрия – трехслойная. Уровень прогестерона в периферической крови составил 32 пмоль/л. Был сделан вывод, что у данной пациентки имелись клинические признаки недостаточности лютеиновой фазы, что в дальнейшем и было подтверждено результатами морфологического исследования соскоба эндометрия.
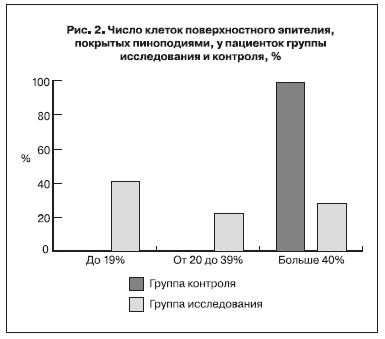
При гистологическом исследовании образцов, полученных от женщин, составивших группу исследования, выявлено, что в среднем 24% клеток поверхностного эпителия содержат пиноподии (от единичных до 50 % клеток) (рис. 2).
При ИГХ исследовании биоптатов в целом наблюдалась умеренная и выраженная экспрессия ПР во
всех клетках эндометрия. В железах и в строме уровень экспрессии ПР колебался от 4 до 250% по сис-
теме оценки HISTO Score, что в среднем составило 151±22 и 130±13,5% соответственно. При оценке иммуноокрашивания ЭР-образцов пациенток группы исследования была отмечена умеренная и низкая экспрессия ЭРα. В железах и строме уровень ЭРα колебался от 1 до 250 и составил в среднем 95±12,6 и 51,3±11,2 соответственно.
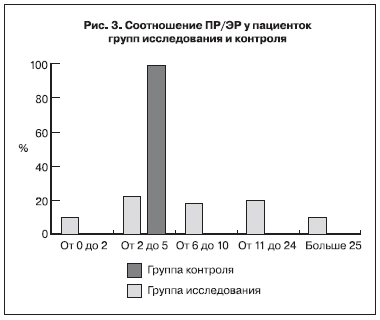
Что касается соотношения рецепторов стероидных гормонов в эндометрии, то этот показатель рассчитывается по соотношению ПР/ЭР в строме. По данным литературы, в норме он составляет от 2 до 4 [5]. У пациенток группы исследования ПР/ЭР колебался от 1 до 180 и в среднем составил 7,7 (что отражает снижение количества ЭР), в группе сравнения этот показатель составил 2,9 (рис. 3).
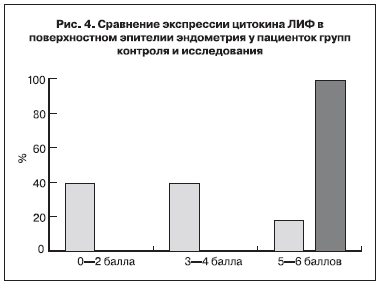
В результате ИГХ исследования биоптатов эндометрия женщин группы контроля отмечена высокая
степень экспрессии цитокина ЛИФ (5–6 баллов), тогда как в образцах, полученных у пациенток с безуспешными программами ЭКО в анамнезе, экспрессия этого биомаркера варьировалась от высокого до полного отсутствия (рис. 4).
При анализе особенностей распределения ЛИФ в клетках функционального слоя эндометрия у пациенток с безуспешными попытками ЭКО в анамнезе было отмечено отсутствие тенденции к усилению экспрессии ЛИФ от более глубокого гистологического слоя к поверхностному. В группе фертильных женщин такая тенденция отчетливо прослеживалась. В целом отмечено снижение уровня ЛИФ во всех рассматриваемых гистологических структурах эндометрия в группе исследования.
Обсуждение
Поиску эффективных методов оценки имплантационного потенциала эндометрия посвящено много исследований. Однако клиническая интерпретация результатов этих исследований пока крайне ограничена. В настоящей работе проведена оценка рецептивности эндометрия у 36 женщин, имеющих от 1 до 3 неудачных попыток ЭКО в анамнезе. При этом параметры фолликуло-, оо- и эмбриогенеза были адекватными. Динамика роста и структурной трансформации эндометрия в ходе программ соответствовала адекватной эхографической картине. Более того, у большинства больных (кроме одной), при морфологическом датировании в период предполагаемой максимальной рецептивности эндометрия обнаружен эндометрий ранней и средней стадий фазы секреции, что не отличалось от такового в группе сравнения. Все это явилось предпосылкой для более углубленного исследования имплантационных свойств эндометрия у данной группы больных.
И действительно, число клеток поверхностного эпителия с наличием зрелых пиноподий в период
предполагаемого «имплантационного окна» различалось в группе исследования и сравнения (в среднем 24 и 50% соответственно). Снижение количества эндометриальных пиноподий было отмечено исследователем G. Nikas у пациенток с нарушением имплантации в анамнезе и у женщин с бесплодием неясного генеза [19].
Также у пациенток, составивших группу исследования, отмечен дисбаланс в экспрессии рецепторов к стероидным гормонам, в основном за счет снижения количества ЭР. Аналогичные результаты были представлены в работах Е.А. Дюжевой и S. Talbi. Связи между экспрессией рецепторов к стероидным гормонам и выраженностью эндометриальных пиноподий или экспрессией ЛИФ не отмечено [3, 5, 17].
По результатам проведенного нами исследования, экспрессия цитокина ЛИФ в преимплантационном эндометрии у женщин с неудачными попытками ЭКО в анамнезе достоверно снижена по сравнению с группой сравнения, что подтвердило высокую диагностическую роль определения экспрессии ЛИФ в эндометрии средне секреторной фазы. Также была отмечена связь между экспрессией ЛИФ и эндометриальными пиноподиями, в период расцвета которых и
определяется максимальная концентрация цитокина, что согласуется с данным, полученным L. Aghajanova и соавт. [1, 2].
В настоящее время возможности клиницистов ограничены лишь традиционными методами улучшения рецептивных свойств эндометрия (применение циклической гормональной терапии). Многообещающими являются исследования о применении рекомбинантного ЛИФ для улучшения имплантационных свойств эндометрия у женщин с бесплодием. Однако возможность патогенетической терапии (применение рекомбинантного ЛИФ), направленной на улучшение имплантационных возможностей эндометрия, остается пока далекой перспективой.
Выводы
Эндометрий пациенток, имеющих безуспешные попытки ЭКО в анамнезе, при морфологическом
исследовании характеризуется снижением числа клеток покровного эпителия с наличием зрелых пиноподий. При ИГХ исследовании биоптатов в 60% случаев отмечен дисбаланс между рецепторами к стероидным гормонам в эндометрии, чаще в сторону снижения количества ЭР, а также снижение экспрессии ЛИФ с отсутствием тенденции к усилению экспрессии цитокина от глубокого гистологического слоя эндометрия к более поверхностному.
Такие биомаркеры, как экспрессия ЛИФ и число клеток поверхностного эпителия, содержащих пиноподии, наиболее точно отражают имплантационный потенциал эндометрия и, несомненно, являются наиболее ценными диагностическими признаками его полноценности.



