В последние годы ведутся активные научные разработки по снижению риска осложнений, которые вносят существенный вклад в развитие плацентарной недостаточности (ПН) у беременных после экстракорпорального оплодотворения (ЭКО) [1, 7, 12–14]. Бесплодие часто обусловлено длительно текущими хроническими воспалительными заболеваниями, способствующими снижению иммунорезистентности, циркуляции патологических аутоантител, эндоинтоксикации, повышению коагуляционного каскада и нарушению реологических параметров крови [2, 4, 7, 14]. Существенный вклад в развитие данных нарушений вносит и гормональная стимуляция суперовуляции, что является дополнительным мощным активирующим фактором запуска процессов тромбообразования на фоне уже имеющихся гиперкоагуляционных сдвигов [5, 7, 11]. Все сказанное диктует необходимость поиска методов, позволяющих нивелировать возможные причины, снизить риск осложнений и обеспечить дальнейшее прогрессирование беременности после ЭКО. Одним из возможных решений данной проблемы является использование в этих целях лечебного плазмафереза (ПА) обладающего многими ценными качествами [3, 6, 7, 9, 15]. С помощью ПА можно оказать существенное влияние на патогенетические факторы, осложняющие течение и исход гестации, предотвратить возможные осложнения, связанные с реокоагуляционными расстройствами [6, 7, 9, 10, 13, 15].
Цель исследования: оценить влияние ПА на показатели гемореологии у беременных с ПН после ЭКО.
Материал и методы исследования
Проведен сравнительный анализ показателей системы гемостаза и параметров реологии крови
у 120 беременных. Основную группу составили 105 пациенток после ЭКО с хронической формой ПН, в контрольную группу были включены 15 женщин с физиологическим течением беременности. Средний возраст исследуемых составил 34,6±4,2 года, срок гестации от 27 до 36 нед. Клинико-лабораторные исследования, включающие показатели системы гемостаза (105 пациенток) и реологии крови (28 пациенток) проводили до, в динамике и после завершения курса лечения, результаты сопоставлялись с показателями беременных контрольной группы (15 пациенток). Основными критериями для проводимых исследований явились данные кардиотокограммы, указывающие на наличие признаков хронической гипоксии плода, а также данные допплерометрии. Всем 105 пациенткам основной группы на I этапе лечения проводилась комплексная традиционная терапия, направленная на улучшение микроциркуляции в системе мать-плацента-плод с применением спазмолитиков, токолитиков и седативных препаратов в течение 12–14 дней. В последующем в целях сравнительной интерпретации проводимого лечения пациентки основной группы были разделены на 2 подгруппы. В 1-ю группу вошли 47 беременных, которым фоновая терапия не оказала желаемого эффекта и в программу
дальнейшего лечения ПН и реологических расстройств были включены сеансы лечебного ПА
с 6% раствором гидроксиэтилированного крахмала (ГЭК). Во 2-ю группу вошли 58 беременных, лечение которых продолжалось по общепринятой методике. В целях коррекции нарушений гемостаза назначали противотромботические средства (курантил, фраксипарин в течение 5–10 дней).
ПА проводился в дискретном режиме, на аппарате РCS-2 фирмы Hemonetics, США. За 15–20 мин
до эксфузии крови в локтевую вену начинали плазмовозмещение 6% раствором ГЭК 130/0,4 (волювен). После введения 200 мл раствора начинали процедуру аппаратного ПА. Объем плазмозамещения и плазмоэксфузии составил 1,2:1. Курс лечения ПА состоял из 3–4 сеансов с интервалом 2–4 дня. Средняя продолжительность лечения составила 14,2±1,8 дня. Гепаринизацию проводили из расчета 50–100 ед. на 1 кг массы тела. Параметры системы гемостаза: концентрацию фибриногена, активированное частичное тромбопластиновое время (АЧТВ), протромбиновый индекс (ПИ) исследовали до применения ПА, в динамике и через неделю после последнего сеанса на анализаторе Behring coagulation timer. Тромбоэластографию цельной крови проводили на тромбоэластографе фирмы Hellige(Германия).Определяливеличину r+k (мм) – время реакции от момента начала коагуляции до образования фибринового сгустка; ma – максимальную амплитуду, характеризующую эластичность сгустка; индекс тромбодинамического потенциала (ИТП, у.е.).
Реологические параметры крови оценивали у 28 пациенток после ЭКО с хронической формой ПН, в динамике проводимой терапии и 15 беременным контрольной группы. При оценке реологических параметров крови учитывали показатели макрореологии: асимптотическую вязкость крови (ВК) (ηb) мПА*c, вязкость плазмы (ВП) (ηp), гематокрит, концентрацию общего фибриногена плазмы и микрореологии: спонтанную агрегацию и дезагрегацию (деформируемость) эритроцитов. Измерение величины вязкости цельной крови производили с помощью реометра «АКР-2» (Россия) в диапазоне скоростей сдвига 130–250 с-1. В качестве антикоагулянта использовали 3,8% раствор цитрата натрия в соотношении с кровью 1:9. Забор крови производили утром натощак, самотеком из локтевой вены в тефлоновые пробирки. Оценку степени деформируемости эритроцитов (индекс ригидности – IR) производили на приборе ИДА-4, после пропускания 1% взвеси эритроцитов через фильтры (3 мкм) с автоматической регистрацией времени выхода определенного числа эритроцитов. Параметры агрегации и дезагрегации эритроцитов определяли на лазерном аппарате ЛАДЭ-5, по следующим показателям: T1 – время образования линейных агрегатов, «монетных столбиков» (с); T2 – время образования трехмерных агрегатов (с); AMPL – конечный размер агрегатов (у.е); IR (у.е).
Статистическую обработку полученных данных проводили на аппарате Pentium II с использованием пакета прикладных программ «Microsoft Excel» версия 7.0 с помощью непараметрического U-критерия Манна-Уитни. При проверке статистической достоверности полученных данных применяли стандартную процедуру расчетов с использованием t-критерия Стьюдента.
Результаты исследования и обсуждение
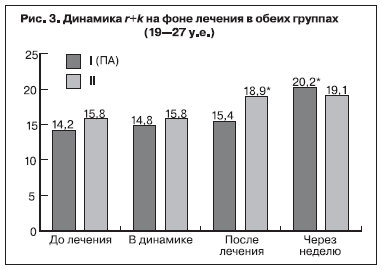
Результаты гемостазиологических методов исследования до проводимого лечения показали, что уровень концентрации фибриногена у исследуемых беременных достигал верхней границы нормативных значений – 4,5±1,5 и 4,2±1,8 г/л в 1-й и 2-й группах соответственно и между показателями обеих групп достоверной разницы не выявлено (р>0,05). Следует отметить, что увеличение уровня фибриногена во всех исследуемых группах является характерным и необходимым
физиологическим атрибутом долговременной адаптации системы гемостаза во время беременности. В показателях АЧТВ до проводимого лечения не отмечено отклонений от нормативных значений и достоверной разницы в исследуемых группах также не выявлено – 38,2±2,1 и 36,7±3,1 с (р>0,05) в 1-й и 2-й группах соответственно. Показатели ИТП, r+k и ma отражают картину последовательного формирования структурной и хронометрической гиперкоагуляции. Как правило, при физиологическом течении беременности по мере увеличения срока гестации достоверно уменьшается время коагуляции (r+k), но в пределах допустимых значений (19–27 мм). У исследуемых беременных с ПН до лечения отмечались сравнительно высокие показатели гиперкоагуляции: увеличение ИТП до 21,6±0,8 и 21,3±0,7 у.е. (рис. 1), увеличение ma до 52,4±0,6 и 52,9±0,7 мм (рис. 2), укорочение показателей r+k до 14,2±0,6 и 15,8±0,4 мм (рис. 3) в 1-й и 2-й группах соответственно.
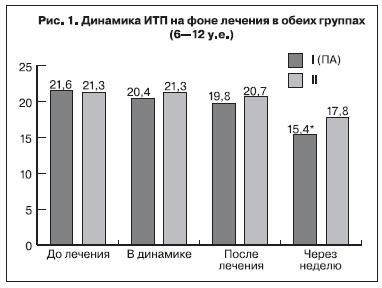
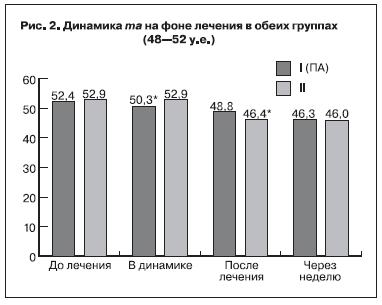
Указанные данные свидетельствуют о высокой степени структурной и хронометрической гиперкоагуляции. На основании исходных данных о состоянии системы гемостаза можно сделать вывод, что у беременных с ПН после ЭКО гиперкоагуляция имеет выраженный характер и протекает на фоне активации внутрисосудистого свертывания по типу хронической формы синдрома диссеминированного внутрисосудистого свертывания.
Исследования показали, что в процессе проводимой терапии наблюдалось достоверное улучшение показателей гемостаза в обеих группах. Отмечено снижение уровня фибриногена в динамике уже на 4–5-й день лечения с 4,5±1,5 до 3,9±1,6 г/л в 1-ой группе и с 4,2±1,7 до 3,6±1,8 г/л во 2-ой группе (p<0,05). После завершения курса лечения уровень фибриногена достоверно снизился у беременных на фоне традиционной терапии до 2,7±1,2 г/л по сравнению с показателями 1-ой группы – 3,1±0,8 г/л (p<0,05). Однако на фоне применения ПА достоверное снижение показателя наблюдалось через нед после завершения курса лечения до 2,37±0,8 г/л по сравнению с традиционной терапией – 2,64±1,2 г/л (p<0,05). Равномерное снижение показателя ИТП после завершения лечения отмечено в обеих группах: после ПА до 19,8±1,3 у.е., после традиционной терапии до 20,7±1,4 у.е. (p>0,05). Однако через неделю после завершения лечения, показатели ИТП достоверно снизились у пациенток 1-й группы до 15,4±0,8 у.е. по сравнению с показателями исследуемых 2-й группы – 17,8±1,2 у.е. (p<0,05) (рис. 1).
Также увеличились показатели r+k через неделю после ПА с 14,2±0,6 до 20,2±0,7 мм, а после традиционной терапии – с 15,8±0,4 до 19,1±0,4 мм (p<0,05) (рис. 3). Показатели ma и АЧТВ существенно не изменились.
При исследовании реологических параметров крови отмечалось снижение уровня вязкости во
время беременности, обусловленное состоянием физиологической аутогемодилюции, что является
благоприятнымкомпенсирующимфакторомулучшения текучести крови в магистральных сосудах.
Таблица 1. Характеристика показателей макрореологии крови в динамике лечения (M±SD).
В табл. 1 представлены результаты исследования макрореологических параметров крови до и после проведенного лечения. Анализ показал, что до проводимого лечения у пациенток 1-й группы наблюдались существенные изменения в параметрах макрореологии крови по сравнению с показателями пациенток 2-й группы и здоровых беременных. Асимптотическая ВК была достоверно выше в 1-й группе и составила 3,82±0,61 мПа.с по сравнению со 2-й – 3,76±0,68 мПа.с (р<0,05) и контрольной группами – 3,69±0,57 мПа.с (р <0,05). Тогда как между показателями 2-й и контрольной групп достоверной разницы после проведенной фоновой терапии не выявлено (р >0,05). Следует подчеркнуть, что до терапии у всех исследуемых нами беременных отмечалось относительное снижение асимптотической ВК, которое было обусловлено состоянием физиологической аутогемодилюции преимущественно олигоцитемического характера, связанного с показателями гематокрита. Во всех исследуемых группах существовала прямая зависимость между величиной ВК и гематокритом. В показателях гематокритной величины до проводимого лечения между пациентками обеих групп достоверной разницы не отмечено – 0,39±0,04 и 0,37±0,05 соответственно (р>0,05), но по сравнению с группой контроля выявлена достоверная разница – 0,44±0,03 (р <0,05; р <0,05).
В результате лечения с использованием ПА произошло достоверное снижение ВК на 6–7 день
терапии: с 3,82±0,61 до 3,54±0,48 мПа.с ( р <0,01), а после завершения курса до 3,49±0,47 мПа.с
(р <0,001). Тогда как продолжение традиционной терапии в отличие от ПА не оказало должного влияния на показатель ВК: до лечения – 3,76±0,68 мПа.с, в динамике – 3,62±0,36 мПа.с (р >0,05); однако после завершения лечения наблюдалась незначительная тенденция к улучшению – 3,56±0,69 мПа.с (р <0,05).
При оценке уровня ВП до лечения у беременных основной группы по сравнению с контрольной группой отмечено достоверное увеличение, в среднем на 0,7–0,9 мПа.с. В 1-й группе ВП составила 1,48±0,07 мПа.с, во 2-й – 1,46±0,09, в контрольной – 1,41±0,06 мПа.с (р1<0,05; р2<0,05).
Между показателями 1-й и 2-й групп до применения ПА достоверной разницы не наблюдалось – 1,48±0,07 и 1,46±0,09 мПа.с соответственно (р>0,05). В процессе проводимой терапии на 6–7-й день
между показателями основной группы достоверной разницы также не отмечено – 1,42±0,04 и 1,43±0,08 мПа.с соответственно (р>0,05). Однако после завершения курса лечения показатели
улучшились на фоне ПА – 1,36±0,06 мПа.с в отличие от традиционной терапии – 1,40±0,07 мПа.с
(р<0,05). В результате использования ПА произошло достоверное снижение уровня концентрации фибриногена в 1-й группе с 4,7±1,5 до 3,6±0,8 г/л (р <0,001) в отличие от традиционной терапии с 4,2±1,8 до 3,9±0,6 г/л ( р >0,05).
Необходимо подчеркнуть, что снижение асимптотической ВК во время беременности является благоприятным фактором, способствующим относительной компенсации текучести крови
и нормализации кровотока в сосудистой сети плаценты. Однако при патологическом течении беременности важно проведение детальных исследований на уровне микрореологических
параметров крови; оценка состояния гемореологии только лишь по параметрам ВК и ВП недостаточна.
Известно, что в регуляции ВК и проявлении ее неньютоновских свойств особое значение придается агрегации эритроцитов и ее IR, которые относятся к одним из ключевых показателей микрореологии на клеточном уровне.
В табл. 2 представлены результаты исследования микрореологических параметров крови в
вышеперечисленных группах. Установлено, что во всех группах наблюдения существенно нарушены
микрореологические показатели, причем время образованиялинейныхагрегатовэритроцитов(Т1)
было снижено в бóльшей степени у беременных основной группы по сравнению с контрольной.
Т1 до применения ПА в 1-й группе составило 4,89±0,46 с и достоверно отличалось от аналогичного показателя 2-й группы – 5,28±0,94 с (р<0,05) и контрольной – 7,60±0,62 с (р <0,001). Т1 у беременных 2-й группы также отличалось от контрольной – 5,28±0,94 с (р <0,01). Ускорение образования
линейных агрегатов у беременных с ПН указывает на нарушение кровотока в зоне микроциркуляции
и прогрессирование скрытых гипоксических процессов, что требует активных вмешательств.
Таблица 2. Характеристика показателей микрореологии крови в динамике лечения (M±SD).
В динамике лечения методом ПА произошло достоверное увеличение показателя Т1 с
4,89±0,46 до 5,86±0,75 с (р <0,05), чего не наблюдалось при традиционной терапии: до лечения –
5,28±0,94 с, в динамике – 5,45±0,84 с ( р >0,05). После завершения курса лечения Т1 достоверно
стало более продолжительным в 1-й и 2-й группах, но изменения были более выражены на фоне
ПА – 6,71±0,70 с (р <0,001), чем после традиционной терапии – 5,63±0,72 с ( р <0,05).
Интенсивность второй волны агрегации эритроцитов, т.е. время образования крупных агрегатов (Т2) до применения ПА было примерно одинаково в 1-й и 2-й группах – 43,5±1,45 и 42,9±1,66 с
соответственно (р>0,05), однако превышало значение в контрольной группе – 40,7±2,43 с (р <0,05;
р <0,05). Относительное увеличение Т2 может быть обусловлено компенсаторно уменьшенной активностью образования крупных трехмерных агрегатов эритроцитов, интенсивность которых связана с гравитационными изменениями крови, величиной гемоглобина и СОЭ у беременных с ПН после ЭКО. В процессе проводимой терапии и после завершения курса лечения Т2 было одинаковым
в 1-й и 2-й группах – 41,2±1,36 и 41,9±1,83 с соответственно (р>0,05).
При оценке параметров AMPL выявлено, что у беременных с ПН после ЭКО они были выше
нормативных значений и достоверно отличались от показателя контрольной группы: в 1-й
группе – 1167±382,4 у.е., во 2-й – 1062±430,0 у.е. (р<0,05), а в контрольной – 920±187,3 у.е. ( р <0,05;
р <0,05).
В процессе проводимой терапии на 6-7-й день уровень AMPL оставался стабильным в обеих
группах и не поддавался лечению – 1114±280,0 у.е. в 1-й и во 2-й – 1057±284,2 у.е. ( р>0,05). Влияние
терапии отмечено после завершения курса лечения, AMPL на фоне ПА достоверно снизилась с
1167±382,4 до 1046±195,0 у.е. (р <0,05), тогда как после традиционной терапии оставалась стабильной (р >0,05).
Имело место значительное увеличение IR эритроцитов в обеих группах исследования в отличие от контрольной группы: в 1-й группе – 1248±315,9 у.е., во 2-й – 817±120,2 у.е. ( р<0,05), в контрольной – 122±15,5 у.е. ( р <0,001; р <0,05). Уже в динамике проводимой терапии отмечалось достоверное снижение данного показателя у беременных обеих групп: в 1-й до 946±210,9 у.е., во 2-й до 60±140,7 у.е. ( р<0,05; р <0,05). Максимальное снижение IR эритроцитов отмечено после завершения лечения и наилучший результат достигнут при применении ПА с волювеном – 346±117,3 у.е. в отличие от традиционной терапии – 421±181,2 (р<0,05; р >0,001; р >0,01). Положительное влияние ПА и волювена на IR, по всей вероятности, обусловлено снижением уровня эндогенной интоксикации, улучшением кинетики кислородного метаболизма, что в свою очередь способствует повышению способности эритроцитов к деформированию и улучшению кровообращения в зоне микроциркуляции.
Данные допплерометрии до проводимого лечения у беременных основной группы указывали на признаки хронической ПН. Проводилась регистрация спектров кривых скоростей кровотока левой и правой маточных артерий (маточно-плацентарный кровоток – МПК) и артерии пуповины (фетоплацентарный кровоток – ФПК). В 1-й группе наблюдалось изолированное снижение ФПК у 41 беременной (87,2%). Сочетанное нарушение ФПК и МПК отмечено у 6 (12,7%) беременных. Во 2-й группе изолированное снижение ФПК отмечено у 52 (89,6%) беременных, сочетанное снижение ФПК
и МПК у 5 (8,6%) беременных. После курса ПА с 6% раствором волювена нормализация ФПК отмечена
у 14 (29,8%) беременных, положительная динамика показателей ФПК выявлена у 29 (61,7%) беременных, у 4 (8,5%) беременных показатели ФПК остались без изменений. Следует отметить, что отрицательной динамики ФПК на фоне ПА у пациенток 1-й группы не наблюдалось. В сравниваемой группе после проведения комплексной традиционной терапии нормализация ФПК произошла у 9 (15,5%) беременных, положительная динамика показателей ФПК отмечена у 33 (57,0%) беременных.
У 14 (24,1%) беременных показатели ФПК остались без изменений, и у 2 (3,4%) наблюдалась отрицательная динамика ФПК. Из представленных данных вытекает, что нормализация ФПК и МПК
у беременных с ПН наилучшим образом проявилась на фоне комплексной терапии с применением дискретного ПА и волювена.
В результате применения ПА удалось пролонгировать беременность до оптимальных сроков родоразрешения, в среднем до 37,8±0,4 нед у 96,7% исследуемых, тогда как на фоне традиционной терапии данный показатель оказался сравнительно ниже и составил 88,3%. При оценке перинатальных исходов между новорожденными детьми, рожденными от матерей обеих
групп, принципиальных различий не выявлено.
Таким образом, у беременных с ПН после ЭКО имеются значительные отклонения в микрореологических параметрах крови, связанные преимущественно с гиперагрегационным синдромом эритроцитарного звена. Следует полагать, что данные изменения в макро- и микрореологических показателях крови
у беременных с ПН после ЭКО обусловлены особенностями предгравидарной подготовки, преморбидным фоном, гормонотерапией, применяемой до и в процессе гестационного периода, что в конечном итоге способствует нарушению защитно-приспособительных механизмов на клеточном уровне. Перечисленные факторы приобретают особую значимость еще и потому, что гормональная стимуляция суперовуляции при проведении программы ЭКО является дополнительным мощным активирующим фактором запуска процессов нарушения гемореологии и тромбообразования еще до инвазии трофобласта. В связи с этим включение в состав комплексной терапии у беременных с ПН после ЭКО ПА является необходимым и целесообразным компонентом лечения, оказывающим благоприятное воздей ствие на реологические параметры крови.
Выводы
1. При ПН после ЭКО нарушение показателей плазменного звена системы гемостаза и реологии крови в значительной мере обусловлено отклонениями микрореологических параметров, что связано с процессами нарушения агрегации, дезагрегации, деформируемости эритроцитов и повышенной степенью образования линейных агрегатов эритроцитов.
2. Применение ПА с использованием 6% ГЭК в комплексной терапии ПН позволило добиться
существенной нормализации показателей плазменного звена системы гемостаза, реологических
параметров крови, в особенности агрегационных свойств эритроцитов, их IR и деформируемости,
что способствовало улучшению маточно-плацентарного и фетоплацентарного кровотока.



