Стремительное развитие вспомогательных репродуктивных технологий (ВРТ) обусловлено все еще высоким уровнем бесплодия в современном обществе [1]. Несмотря на многие успешные попытки улучшить демографическую ситуацию, доля бесплодных браков на территории России колеблется от 8 до 17,5% и в настоящее время не имеет тенденции к снижению [2]. На сегодняшний день ВРТ занимают ведущее место среди современных методов лечения бесплодия.
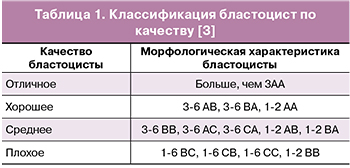 Для наступления беременности в программах ВРТ одна из важнейших задач — выбор наиболее качественного и жизнеспособного эмбриона для переноса в полость матки. Селекция таких эмбрионов, как правило, осуществляется на основании оценки их морфологических свойств. Общепринятый стандарт оценки качества бластоцист, предложенный Gardner et al [3], приведен в табл. 1.
Для наступления беременности в программах ВРТ одна из важнейших задач — выбор наиболее качественного и жизнеспособного эмбриона для переноса в полость матки. Селекция таких эмбрионов, как правило, осуществляется на основании оценки их морфологических свойств. Общепринятый стандарт оценки качества бластоцист, предложенный Gardner et al [3], приведен в табл. 1.
Однако критерии качества, предложенные Gardner et al, являются субъективными, а точность такого метода отбора эмбрионов остается недостаточно высокой. Более того, не все эмбрионы «хорошего» и «отличного» качества, с точки зрения морфологических критериев, при переносе в нормальный эндометрий полости матки приводят к беременности [4]. Таким образом, возникает необходимость внедрения дополнительных неинвазивных технологий селективного выбора эмбриона с максимальным имплантационным потенциалом.
За последние годы было изучено значительное число потенциальных биомаркеров качества эмбрионов и их имплантационной способности. Многообещающим методом выступает преимплантационное генетическое тестирование, так как хромосомная патология у переносимых эмбрионов может быть основной причиной неудачных результатов лечения бесплодия. Однако, наряду с бесспорной ценностью, данный метод имеет ограничения для применения в повседневной практике за счет его высокой стоимости, а также необходимости инвазивных вмешательств на эмбрионе [5].
Представление об энергетической, метаболической активности и состоянии сигнальных систем конкретного эмбриона без использования инвазивных методик позволяет получить среда культивирования эмбрионов на различных стадиях развития [6]. Значительным диагностическим и прогностическим потенциалом в отношении качества эмбриона и его имплантационной способности обладают малые некодирующие РНК (мнРНК) при определении уровня их экспрессии в культуральной среде эмбриона [7]. мнРНК действуют на эпигенетическом, транскрипционном и посттранскрипционном уровнях регуляции экспрессии генов. Именно эти взаимодействия определяют различный фенотип и функции клеток организма [8]. Влиянием на фенотип и функцию клеток в большей степени обладают такие мнРНК, как microRNA и piwiRNA [9]. Было доказано, что определение экспрессии данных молекул в культуральной среде эмбриона позволяет прогнозировать его имплантационный потенциал и более точно оценить качество эмбриона [10]. В 2014 г. McCallie et al. [11] впервые выявили, что бластоцисты у пациентов, страдающих бесплодием на фоне СПКЯ, имеют атипичный профиль microRNA (miR-19a, miR-19b, miR-24, miR-92, miR-93 и т.д.), а в 2016 г. Capalbo et al. [12] показали, что внутриклеточная экспрессия microRNA различается у эуплоидных и анеуплоидных эмбрионов. В исследовании Liang et al. [13] было продемонстрировано, что повышенная экспрессия miR-24 в культуральную среду ассоциирована с остановкой бластоцисты в развитии и коррелирует с качеством эмбриона. Таким образом, наличие взаимосвязи между качеством эмбриона и конкретными мнРНК в культуральной среде данных эмбрионов — перспективный и современный метод оптимизации выбора эмбриона при проведении программ ВРТ.
Материалы и методы
49 образцов культуральной среды были собраны на 4-е сутки после оплодотворения от эмбрионов класса А, В и С, согласно морфофункциональной классификации бластоцист, предложенной Gardner et al, а также от эмбрионов на стадии морулы и кавернозной морулы. От эмбрионов класса А было получено 27 образцов культуральной среды, 8 образцов — от эмбрионов класса В, 4 образца — от эмбрионов класса С; оставшиеся 10 образцов соответствовали среде культивирования, полученной от 7 морул и от 3 кавернозных морул. Из собранных образцов были выделены РНК колоночным способом с использованием набора «miRNeasy Serum/Plasma Kit» (Qiagen). Идентификация всех имеющихся мнРНК в среде культивирования эмбриона была осуществлена методом глубокого секвенирования с использованием набора по синтезу кДНК-библиотек NEBNext® Multiplex Small RNA Library Prep Set for Illumina® (Set11, New England Biolab®, Germany) на платформе NextSeq 500 platform (Illumina, USA). Относительный уровень экспрессии кДНК оценивали по кратности изменения (КИ) методом ΔΔCt.
M0s1 / M0s2 = 2-∆∆Ct,
где M0s1 и M0s2 – исходные количества кДНК в образцах s1 и s2, ∆∆Сt=(Cts1-Ctnorm1)-(Cts2-Ctnorm2), Ct — значение цикла амплификации в точке пересечения кинетической кривой накопления продукта амплификации с линией порогового уровня флуоресценции, который определяется автоматически программным обеспечением амплификатора StepOnePlus; Cts1 и Cts2 — значение порогового цикла амплификации кДНК анализируемой мнРНК в двух сравниваемых образцах s1 и s2; Ctnorm1 и Ctnorm2 — значение порогового цикла амплификации кДНК нормировочной эндогенной мнРНК в двух сравниваемых образцах s1 и s2. Образцом сравнения служила среда культивирования без эмбриона; для нормировки данных полимеразной цепной реакции анализируемых мнРНК была выбрана hsa- piR023338|gb|DQ601914 ввиду стабильной экспрессии во всех образцах (n=49).
Все образцы культуральной среды, включенные в исследование, были получены от 39 пациенток с трубно-перитонеальным фактором бесплодия, проходящих программу ИКСИ (35 пациенток) и программу ЭКО (4 пациентки) по стандартному протоколу овариальной стимуляции со 2—3 дня менструального цикла с препаратами антагониста гонадотропин-рилизинг гормона и гонадотропинами. У пациенток, включенных в исследование, были проанализированы данные анамнеза, параметры клинического и гормонального статуса, а также исходы программ ВРТ (отсутствие/наступление беременности). Всем женщинам проведено обследование в соответствии с приказом Министерства здравоохранения Российской Федерации №107н.
Критерии включения пациенток в исследование:
- возраст пациенток от 20 до 37 лет с нормальным овариальным резервом;
- женское бесплодие трубно-перитонеального происхождения;
- фертильная и субфертильная сперма партнера;
- регулярный менструальный цикл;
- информированное согласие на участие в исследовании.
В исследование не были включены пациентки с противопоказаниями для проведения ЭКО или ИКСИ в соответствии с приказом Министерства здравоохранения Российской Федерации №107н.
В зависимости от исхода программы ЭКО или ИКСИ все пациентки были разделены на три группы:
- 1-я группа: 25 пациенток, проходивших лечение со стимуляцией суперовуляции и переносом эмбрионов в стимулированном цикле, c отрицательным результатом имплантации.
- 2-я группа: 14 пациенток, проходивших лечение со стимуляцией суперовуляции и переносом эмбрионов в стимулированном цикле, с положительным результатом имплантации.
- 3-я группа: 4 пациентки, у которых беременность не наступила в стимулированном цикле (из 1-й группы) и лечение продолжилось методом переноса криоконсервированных/размороженных эмбрионов в последующем цикле, с положительным результатом имплантации. В этих случаях эмбрионы витрифицировали на стадии бластоцисты. Подготовка эндометрия осуществлялась препаратом эстрадиола валерата с 5—6-го дня менструального цикла. Дозу препарата подбирали индивидуально (4—6 мг/сут). Перенос эмбриона произведен на 19—20 день менструального цикла. Толщина эндометрия в день переноса размороженного эмбриона составляла 9—12 мм.
Оценка возрастных и антропометрических характеристик пациенток в исследуемых группах не выявила статистически значимых различий (табл. 2). Группы были сопоставимы по данным параметрам. Все пациенты были подобраны таким образом, чтобы минимизировать влияние вмешивающихся факторов на результаты программ ВРТ. При анализе особенностей менструального цикла, овариального резерва, репродуктивного анамнеза и структуры перенесенных гинекологических заболеваний в группах статистически значимых различий также не выявлено.

В стимулированных циклах у пациенток из 1-й и 2-й групп в качестве триггера овуляции был использован гонадотропин хорионический. Триггер вводился при наличии в яичниках фолликулов диаметром ≥17 мм. Пункция яичников проводилась через 36 ч после введения триггера овуляции. Оплодотворение ооцитов было методом ЭКО (у 4 пациенток) или ИКСИ (у 35 пациенток). Поддержка лютеиновой фазы цикла у пациенток в стимулированном цикле и в цикле переноса криоконсервированных/размороженных эмбрионов выполнена препаратами дидрогестерона или прогестерона микронизированного, начиная со дня пункции фолликулов.
Культивирование эмбрионов, включенных в исследование, происходило в индивидуальных каплях с последующим переносом в полость матки эмбрионов под ультразвуковым контролем на 5-е сутки после трансвагинальный пункции.
Статистический анализ. Для статистической обработки результатов использовали скрипты, написанные на языке R [14], и программу RStudio [15]. Соответствие анализируемых параметров закону нормального распределения оценивали по значениям теста Шапиро—Уилка. Статистический анализ проводили с помощью χ2-теста для сравнения категориальных данных, метода ANOVA при анализе трех групп и нормальном распределении исследуемой величины или теста Манна—Уитни при парном сравнении в случае, когда распределение не соответствовало закону нормального распределения. Для описания категориальных бинарных данных использовали абсолютные числа N и процентные доли от общего числа пациенток в группе P в формате N (P%). Для описания количественных данных, имеющих нормальное распределение, использовали среднее арифметическое (М) и стандартное отклонение (SD) в формате М (SD). При распределении признаков с распределением, отличающихся от нормального, их описывали в виде медианы (Me) и квартилей Q1 и Q3 в формате Me (Q1; Q3). Поскольку анализировали как количественные, так и качественные признаки, то корреляционный анализ проводили с использованием непараметрического корреляционного критерия Спирмена. 95% доверительный интервал для коэффициента корреляции определяли с помощью преобразования Фишера. Величину порогового уровня значимости p принимали равной 0,05. Если значение p было меньше 0,001, то p указывали в формате p<0,001. Кроме того, морфологическую характеристику эмбрионов и полученные экспериментальные данные анализировали с помощью дискриминантного анализа методом частных наименьших квадратов [16]
Результаты и обсуждение
На первом этапе работы методом глубокого секвенирования были идентифицированы microRNA и piwiRNA в полости бластоцисты и в среде ее культивирования на 4-е сутки после оплодотворения. Было обнаружено, что среди молекул, идентифицированных в полости бластоцисты и в культуральной среде, наиболее представленными оказались piwiRNA (132 и 128 видов piwiRNA, присутствующих в полости бластоцисты и в культуральной среде, соответственно) по сравнению с microRNA (49 и 36 видов microRNA в полости бластоцисты и в культуральной среде соответственно). Среди молекул каждого класса мнРНК 73,5% microRNA и 34,7% piwiRNA присутствовали, как в полости бластоцисты, так и в культуральной среде. Все microRNA, секретируемые эмбрионом в культуральную среду, были обнаружены в полости бластоцисты. РiwiRNA имели отличный от microRNA паттерн секреции, заключающийся в том, что 33,7% piwiRNA присутствовали исключительно в полости бластоцисты, 31,6% — только в культуральной среде, 34,7% — в культуральной среде и в полости бластоцисты. Для анализа microRNA и piwiRNA методом количественной полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) были отобраны молекулы c числом прочтения не менее 25. В пилотном эксперименте на 24 образцах были оптимизированы условия реакции ОТ-ПЦР с использованием праймеров, специфичных для выбранных microRNA и piwiRNA. Значимые сигналы (Сt < 35 циклов) и специфичные продукты реакции были получены для 5 microRNA и 2 piwiRNA (hsa-let-7b-5p, hsa-let-7i-5p, hsa-let-7c-5p, hsa-miR-92a-3p, hsa-miR-143-3p, hsa_piR_020401|gb|DQ598029|Homo, hsa_piR_023338|gb|DQ601914|Homo). Именно эти мнРНК были проанализированы методом количественной ПЦР в реальном времени на всей выборке образцов РНК (n=49), выделенных из культуральной среды эмбрионов. Для выявления возможности классификации 49 образцов среды культивирования эмбрионов по их качеству в зависимости от схожести профилей экспрессии microRNA и piwiRNA был использован метод PLS-DA. Образцы были ранжированы в порядке возрастания качества эмбриона: ряд «морула-кавернозная морула-бластоциста плохого качества, бластоциста среднего качества, бластоциста хорошего качества, бластоциста отличного качества» был преобразован в ряд «0, 1, 2, 3, 4, 5». Модель PLS-DA строили на основании данных ОТ-ПЦР в виде 2^-∆∆Ct для каждой из исследуемых мнРНК в образце. На рис. 1 представлены графики счетов, построенные по результатам PLS-DA анализа. Точки, соответствующие эмбрионам отличного, хорошего и среднего качества сгруппировались вместе, преимущественно в первом и четвертом квадранте графика, а большая часть точек, соответствующих моруле и кавернозной моруле, образовали кластер в третьем квадранте (рис. 1а). Таким образом, исходя из профиля экспрессии мнРНК, можно оценивать стадию развития эмбриона.

Вклад шести мнРНК в возможность классификации эмбрионов по качеству характеризуют значения параметра важности переменной в проекции (variable importance in projection - VIP). Наибольшее значение этого параметра имеют четыре мнРНК: piR020401 (VIP=1,46027), let-7c-5p (VIP=1,17416), let-7b-5p (VIP=0,994657), let-7i-5p (VIP=0,942665), а наименьшее – miR-143-5р (VIP=0,623108) и miR-92a-3p (VIP=0,471951).
Вклад piR020401, let-7c-5p и let-7b-5p в определение качества эмбриона подтверждают результаты анализа непараметрическим методом ранговой корреляции по Спирмену. Ранжирование 49 образцов было выполнено также, как при построении модели PLS-DA (см. выше). Обнаружена статистически достоверная корреляция между уровнем экспрессии данных мнРНК в среде культивирования и качеством эмбриона, переносимого в полость матки (табл. 3).
О взаимосвязи морфофункциональных характеристик эмбриона и профиля экспрессии мнРНК свидетельствует бокс-диаграмма (рис. 2), где отчетливо прослеживаются различия между группами сравнения в зависимости от вида мнРНК. Анализ уровня экспрессии мнРНК в сравниваемых группах методом Манна—Уитни выявил ряд статистически значимых отличий (табл. 4).
При наложении информации о результатах имплантации на модель, построенную для классификации эмбрионов по их качеству, отсутствует заметная кластеризация точек, соответствующих отрицательному и положительному результату имплантации (рис. 1б). Это подтверждает тот факт, что имплантационный потенциал эмбриона зависит, как от качества гамет, так и от ряда «материнских» факторов. Согласно данным некоторых исследований, пациентки с трубно-перитонеальным фактором бесплодия могут иметь сниженное количество и меньшую чувствительность рецепторов эстрогенов и прогестерона в эндометрии [17]. В результате этого нарушается рецептивность эндометрия, что может выступать причиной неудач циклов ВРТ. Стоит отметить, что неадекватная рецептивность и восприимчивость эндометрия ответственна приблизительно за две трети неудач имплантации [18].
Кроме этого, согласно данным Американского общества по репродуктивной медицине (ASRM) у пациенток в криопротоколе отмечена более высокая частота имплантации, наступления беременности и рождения живого ребенка [19]. Поэтому обращает на себя внимание тот факт, что в данном исследовании у 8% пациенток беременность наступила не в стимулированном цикле (№ эмбрионов 51, 97, 44) а в криопротоколе (№ эмбрионов 56, 94, 68) (рис. 1). Успехи, достигнутые в технологии криоконсервации эмбрионов, позволяют сохранять качество витрифицированных эмбрионов, а их потенциал для имплантации остается аналогичным нативным эмбрионам [20]. С каждым годом появляется все больше данных в пользу криоконсервации эмбрионов и их переноса в следующем цикле без гормональной стимуляции и воздействия на эндометрий. Эта стратегия может быть оправдана, так как сегментация цикла позволяет проводить профилактику синдрома гиперстимуляции яичников и переносить эмбрионы в более физиологичную внутриматочную среду, без возможного отрицательного влияния гормональной стимуляции на рецептивность эндометрия [21]. Показано, что преждевременный подъем уровня прогестерона на фоне мультифолликулярного роста при гонадотропной стимуляции сопровождается не только преждевременной секреторной трансформацией эндометрия, но и нарушением экспрессии генов, ответственных за имплантацию (НОХА 10, рецептора лейкемия- ингибирующего фактора и др.) [22].
Вероятно, именно в связи с этими факторами эмбрионы класса А и В не всегда успешно имплантируются. Кроме этого, на имплантацию влияет и мужской фактор бесплодия, наличие/отсутствие хэтчинга и др. С другой стороны, эмбрионы более низкого класса в ряде случаев могут успешно приводить к наступлению беременности. Таким образом, ориентироваться лишь на морфологические параметры эмбриона при выборе кандидата на перенос в полость матки нецелесообразно и необходимо учитывать множество различных факторов [23].
Заключение
В последние годы пристальное внимание ученых обращено к изучению роли мнРНК, выделенных из культуральной среды в процессе эмбриогенеза. В ходе настоящей исследовательской работы было показано, что данные молекулы позволяют дифференцировать стадии развития эмбриона. Для понимания вклада данных мнРНК в потенциал развития и имплантации эмбриона необходимо дальнейшие исследования по анализу профиля экспрессии мнРНК на стадии морулы, а именно: 1) ее дифференцировки в бластоцисту; 2) дегенерации; 3) остановки в развитии на 5-е сутки после оплодотворения. Таким образом, может быть оптимизирован алгоритм наблюдения за эмбрионами разных стадий развития. Изучение профиля экспрессии идентифицированных piR020401, let-7c-5p, let-7b-5p и miR-92a-3p в культуральной среде эмбриона — неинвазивный и информативный метод выбора оптимального эмбриона и сочетает в себе все основные критерии, предъявляемые к наиболее перспективным способам современной диагностики, а также оптимизации программ ВРТ с учетом сопутствующих факторов.
Благодарность: работа выполнена за счет финансирования по госзаданию «Совершенствование программ вспомогательных репродуктивных технологий при применении инновационных высокотехнологических методик (эмбриологических, клеточных, иммунологических, молекулярно-генетических), регистрационный номер: АААА-А18-118053190022-8



