Необходимость изучения и совершенствования методов скрининговых технологий рака шейки матки (РШМ) обусловлена высоким риском возникновения цервикальных неоплазий и инвазивных опухолей шейки матки (ШМ) при индуцированных вирусом папилломы человека (ВПЧ) изменениях структуры цервикального эпителия [1, 2]. В настоящее время РШМ занимает 2-е место по частоте встречаемости среди раков репродуктивных органов у женщин детородного возраста, имея значительный рост изучаемой патологии, особенно среди женщин молодого репродуктивного возраста [3–5]. Этому способствует отсутствие клинических симптомов заболевания до поздних стадий в результате развития локальных иммунных дисфункций и проблемы скрининговых мероприятий [6, 7]. Ранняя диагностика, адекватное лечение с контролем излеченности предраковых заболеваний позволяют провести вторичную профилактику цервикальной онкотрансформации и снизить заболеваемость РШМ [8].
В современной медицинской практике увеличивается возможность уточнения характера заболеваний и интерпретации данных, полученных с помощью цитологических методов исследования. Именно данный метод исследования является полноценным скрининговым методом в профилактике РШМ, а также широко применяется в онкологии [9]. Однако существующий на данный момент оппортунистический цитологический скрининг по традиционной методике не дает ожидаемых результатов раннего выявления цервикальных интраэпителиальных неоплазий из-за низкой чувствительности и специфичности [10–12].
В экономически развитых странах и в ряде областей Российской Федерации внедряются новые скрининговые программы, базирующиеся на исследовании методом «жидкостной цитологии» [13, 14]. Данная методика предполагает взятие клинического материала в виалу с транспортной стабилизирующей средой. Предложенная технология позволяет законсервировать материал, предотвратить бактериальное засорение препарата и повреждение клеток вследствие их высыхания, сохраняет образец в оптимальных условиях для дальнейшей его транспортировки в лабораторию для исследования. Это позволяет сохранить все свойства клеток: морфологические, иммуноцитохимические и генетические. К тому же полученный материал можно использовать для проведения молекулярно-биологических исследований, в том числе и на обнаружение ВПЧ – основного этиологического фактора развития РШМ [15, 16]. При этом традиционная технология имеет значительный процент ложноотрицательных результатов вследствие потерь материала при переносе на стекло и неудовлетворительного приготовления мазков.
Однако дискутабельным остается вопрос целесообразности усовершенствования цитологического исследования путем внедрения инновационных высокотехнологичных методов, в частности, жидкостной цитологии [17–19].
Учитывая все вышеизложенное, имеет значение оценка дискордантных результатов при параллельном проведении цитологического исследования традиционным методом и методом жидкостной цитологии.
Цель исследования – сравнительная характеристика дискордантных результатов цитологического исследования соскоба шейки матки, выполненного по традиционной технологии с окраской гематоксилин-эозином и по технологии жидкостной цитологии (методика BDSurePath) с окраской по Папаниколау.
Материалы и методы
Для решения поставленной цели были обследованы 2426 женщин в возрасте от 19 до 68 лет (средний возраст 34,3±11 лет), обратившихся на прием к акушерам-гинекологам г. Екатеринбурга и Свердловской области в течение 2018–2019 гг. Проведен анализ совпадения результатов цитологических заключений, выполненных методами традиционной и жидкостной цитологии. Материал для цитологического исследования брали из цервикального канала с помощью щеток Cervex-Brush, Cervex-Brush Combi и последовательно наносили на предметное стекло (для оценки традиционным методом с окраской гематоксилин-эозином) и в контейнер с транспортной средой для проведения жидкостной цитологии. Исследования осуществляли двойным слепым методом. Цитологические образцы были оценены в соответствии с классификацией Папаниколау с адаптацией для адекватного анализа данных классификации по системе Бетесда: нормальная цитология, атипичные плоские клетки неясного значения (ASCUS), характеризующие пограничное состояние или эквивалент, LSIL – low-grade squamosus intraepithelial lesion – низкая степень плоскоклеточного интраэпителиального поражения; ВПЧ-эффект, соответствует легкой дисплазии (CIN I); HSIL – high-grade squamosus intraepithelial lesion – высокая степень плоскоклеточного интраэпителиального поражения; соответствует умеренной дисплазии, а также тяжелой дисплазии (CIS) или CIN II и CIN III; РШМ. При получении аномальных результатов цитологического исследования всем женщинам были проведены исследование на ВПЧ, кольпоскопическое исследование. Интерпретацию данных проводили согласно Международной кольпоскопической классификации (обновленной Международной ассоциацией по патологии шейки матки в Рио-де-Жанейро, 2011). Пациенткам с измененным эпителием была предложена и проведена биопсия ШМ с оценкой согласно гистологической классификации: нормальная, CIN I (LSIL), CIN II, CIN III (HSIL), РШМ.
Статистическую обработку данных проводили с помощью программного пакета SPSS Statistics версии 20.0. Статистическую значимость различий проверяли с помощью двустороннего критерия Фишера (при сравнении данных по частоте выявления) при уровне значимости р<0,05, 95% ДИ. Для оценки диагностических методов вычисляли и анализировали следующие характеристики: чувствительность, специфичность. Чувствительность метода – доля истинно положительных результатов среди больных. Специфичность метода – доля истинно отрицательных результатов среди здоровых.
Результаты и обсуждение
Анализ результатов показал, что 169 (6,96±0,9%) образцов, полученных методом традиционного цитологического исследования, оказались неудовлетворительными по качеству (имели примесь крови, слизи либо содержали единичные клетки эпителия), поэтому при интерпретации результатов у каждой 12-й женщины скрининг оказался неэффективным, с риском ошибки в диагностике предраковых и раковых заболеваний цервикального эпителия. Наибольшими проблемами традиционной цитологии являлись потеря материала при переносе на стекло и контаминация препарата слизью, кровью, воспалительным инфильтратом, которые неизбежно присутствовали в отделяемом цервикального канала.
При интерпретации результатов материалов, полученных методом жидкостной цитологии, неадекватные образцы не были выявлены (р<0,001). При использовании жидкостной цитологии весь материал поступал в виалах для дальнейшего исследования в лаборатории, таким образом исключались потери клеток эпителия ШМ. Обработка на автоматической станции позволила отделить примеси различных биологических субстратов от клеточного материала, а также приготовить ровный монослой клеток на предметном стекле и окрасить его по методу Папаниколау, что согласуется с данными, полученными на других евроазиатских территориях [20]. Таким образом, недочеты преаналитического и аналитического этапа, характерные для традиционной цитологии, с применением метода жидкостной цитологии были ликвидированы.
При выявлении варианта нормы цитологические заключения согласовались в 95,4±9,2% случаев. Вариант нормы был выявлен в 68,5±4,2% случаев, полученных методом традиционной цитологии, и в 63,9% случаев, полученных методом жидкостной цитологии, различия оказались статистически недостоверны (р=0,65). Дисбиотический процесс цервикального содержимого при оценке дискордантных результатов мазков, полученных традиционным методом и методом жидкостной цитологии, был выявлен в 5,7±0,2% и в 9,3±0,3% случаях соответственно, различия статистически значимы (р=0,015). Цитограмма воспалительного процесса обнаружена в 17,9±1,2% при использовании традиционного цитологического метода, что значительно отличалось от аналогичного показателя при использовании жидкостной цитологии (28,7±1,3%, р=0,042). Это обусловлено тем, что микроскопические признаки воспаления более четко видны в препаратах, обработанных методом жидкостной цитологии, благодаря равномерному распределению клеток на стекле или формированию монослоя. «Ключевые клетки» – микроскопический маркер бактериального вагиноза, хорошо выявлялись при использовании как традиционного метода исследования, так и метода жидкостной цитологии. Тем не менее соответствие результатов обоих методов исследования при выявлении данного вида патологии было отмечено лишь в 72,3±7,1% случаев (р<0,001). Следует отметить важность определения наличия воспалительного процесса, дисбиоза различной степени для проведения адекватной диагностики и персонифицированного периоперативного лечения пациенток для профилактики рецидивирования цервикальных неоплазий.
Кроме того, в препаратах, обработанных методом жидкостной цитологии, в 5 случаях выявлялся псевдомицелий дрожжеподобных грибов и актиномицеты, которые не визуализировались методом традиционной цитологии. Незначительные различия отмечались и при подозрении на дисплазию (ASC-US/ASC-H/AGC), в 28 (1,2±0,3%) и 30 (1,2±0,2%) случаев при использовании методов традиционной и жидкостной цитологии соответственно (р<0,001).
Однако следует обратить внимание на значительные различия при использовании традиционной и жидкостной цитологии в диагностике цервикальной предраковой патологии. Всего было выявлено 378 пациенток с цервикальными интраэпителиальными неоплазиями, что составило 15,58±0,4 % из всех обследованных, подтвержденных в последующем кольпоскопическим и гистологическим методами с назначением лечения согласно Протоколу [21]. Средний возраст пациенток с LSIL составил 27,4±2,2 года, где 95% ДИ [19,1–35,7], что значительно отличалось от среднего возраста женщин с HSIL – 34,08±4,8 года с 95% ДИ [28,9–43,7] при р=0,032, что незначительно отличалось от результатов отечественных и зарубежных исследований [21, 22]. Полученные результаты свидетельствовали о преимущественном поражении цервикальными неоплазиями I степени пациенток молодого репродуктивного возраста. Цервикальные интраэпителиальные неоплазии высокой степени наблюдались чаще всего у пациенток позднего репродуктивного возраста, что характерно для некоторых регионов России [23], однако во многих развитых странах CIN II и CIN III выявляли преимущественно в более молодом возрасте, 20–24 года [24].
Следует отметить, что результаты жидкостной цитологии и традиционный метод исследования совпали лишь в 79,0±7,5% (р=0,002). Методом традиционной цитологии обнаружены предраковые и раковые поражения лишь в 291 случае, что свидетельствует о расхождении результатов в 21,0±1,9% случаев (р=0,002). У 87 пациенток использование методом традиционной цитологии не позволило выявить цитологических маркеров, свидетельствующих о более серьезном цервикальном предраковом поражении, из них у 1-й пациентки данным методом не выявлен РШМ. Аналогичная ситуация, относительно получения ложнонегативного результата исследования методом жидкостной онкоцитологии, зарегистрирована у 11 пациенток, при этом злокачественные процессы ШМ к данным случаям не относились.
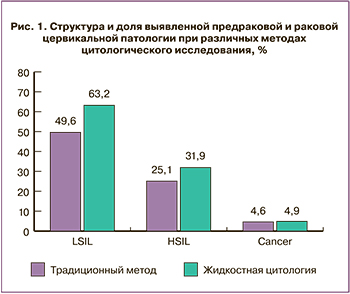 При постадийном, более детальном исследовании выявлено, что интраэпителиальные поражения низкой степени (LSIL, CIN I) при исследовании методом традиционного цитологического исследования были обнаружены у 182 (7,5±0,4%) пациенток. При этом аналогичная патология при обследовании методом жидкостной цитологии выявлена в статистически более значимом количестве случаев – 232 (9,5±0,9%, p=0,049). При LSIL была установлена значительная доля дискордантных результатов. Возможно, это связано с тем, что на фоне резко выраженного воспалительного процесса в препаратах, выполненных методом традиционной цитологии, достаточно трудно дифференцировать клетки с реактивными изменениями и дисплазией, а также с артефактными изменениями клеток. А использование метода жидкостной цитологии позволяло визуализировать койлоциты и клетки с легким дискариозом – клетки, типичные для LSIL. Следует отметить, что койлоцитарная атипия была выявлена почти в 2 раза чаще при использовании жидкостной цитологии по сравнению с традиционной (р=0,001) (рис.1).
При постадийном, более детальном исследовании выявлено, что интраэпителиальные поражения низкой степени (LSIL, CIN I) при исследовании методом традиционного цитологического исследования были обнаружены у 182 (7,5±0,4%) пациенток. При этом аналогичная патология при обследовании методом жидкостной цитологии выявлена в статистически более значимом количестве случаев – 232 (9,5±0,9%, p=0,049). При LSIL была установлена значительная доля дискордантных результатов. Возможно, это связано с тем, что на фоне резко выраженного воспалительного процесса в препаратах, выполненных методом традиционной цитологии, достаточно трудно дифференцировать клетки с реактивными изменениями и дисплазией, а также с артефактными изменениями клеток. А использование метода жидкостной цитологии позволяло визуализировать койлоциты и клетки с легким дискариозом – клетки, типичные для LSIL. Следует отметить, что койлоцитарная атипия была выявлена почти в 2 раза чаще при использовании жидкостной цитологии по сравнению с традиционной (р=0,001) (рис.1).
Еще более значительной разница оказалась при анализе дискордантных результатов цитологического исследования различными методами высокой степени поражения цервикального эпителия – умеренной и тяжелой дисплазии (HSIL, CIN II-III). В частности, выявлено 92 (3,79±0,3%) случая при использовании традиционной цитологии и 117 (4,8±0,4%) случаев при использовании жидкостной цитологии соответственно (р=0,028). При выявлении HSIL методом жидкостной цитологии данные заключения подтверждались традиционной цитологией только в 67,5±6,8% случаев (р<0,001), что не противоречит исследованиям, проведенным на европейских территориях [22]. Вероятно, выраженные морфологические изменения, характерные для HSIL, позволяли достаточно четко выявить данную патологию при жидкостной цитологии, благодаря технологии, исключающей потерю материала, более четкому формированию мазка, очищению от слизи, крови и других примесей.
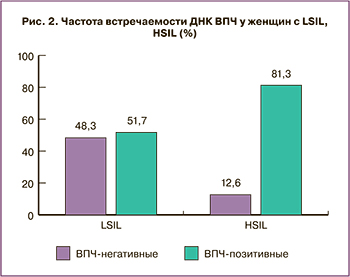 При анализе встречаемости ДНК ВПЧ у пациенток с LSIL и HSIL выявлены определенные закономерности (рис. 2).
При анализе встречаемости ДНК ВПЧ у пациенток с LSIL и HSIL выявлены определенные закономерности (рис. 2).
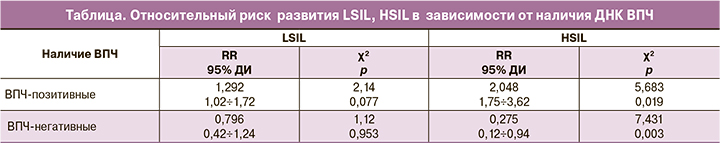
Так, у пациенток с CIN I частота встречаемости ВПЧ-позитивных и ВПЧ-негативных пациенток незначительно отличались друг от друга, что подтверждалось низким относительным риском (таблица).
Выявлена значимо более высокая частота ВПЧ-позитивных пациенток с HSIL по сравнению с ВПЧ-негативными женщинами с данной патологией (χ²=10,81 при р=0,001 и χ²=11,62 при р=0,000 соответственно), что не противоречило результатам зарубежных исследователей о роли ВПЧ в прогрессировании CIN [25, 26]. Значительно более высокое количество наличия ВПЧ у пациенток с HSIL свидетельствовало о высокой приверженности прогрессирования CIN ВПЧ [27].
Следует особое внимание обратить на выявление цервикальной онкопатологии. Традиционным цитологическим методом было выявлено 17 случаев инвазивного РШМ, в то время как методом жидкостной цитологии – 18 случаев. У одной пациентки методом традиционного цитологического исследования не было обнаружено изменений, характерных для РШМ.
Суммируя полученные данные по выявлению цервикальной предраковой и раковой патологии различными методами цитологического исследования, следует отметить статистически более высокие показатели при использовании жидкостной цитологии по сравнению с традиционной (15,13±0,4% и 11,99±0,2% соответственно, р=0,016).
Расчет специфичности и чувствительности изучаемых методов продемонстрировал значительно более высокую чувствительность метода жидкостной цитологии при высокой степени цервикальной неоплазии и РШМ (Se=81,3% и Se=97,4% соответственно, p=0,000, Sp=75,4% и Sp=94,8% соответственно, p=0,001 при HSIL и РШМ), что совпадает с исследованиями, проведенными на других Евроазиатских территориях [28, 29].
Заключение
Использование жидкостной цитологии позволило избавиться от материалов, неудачных по качеству, что подтверждалось наличием неадекватных препаратов в 6,96±0,9% случаев лишь при традиционном цитологическом методе исследования.
Жидкостная цитология позволила достоверно чаще выявлять предраковые состояния шейки матки – LSIL+HSIL (15,3±0,4% и 11,99±0,2% соответственно).
Особенности обработки клеточного материала при использовании жидкостной цитологии по технологии BDSurePath позволяли достоверно чаще и более четко характеризовать воспалительный процесс (28,7±1,3% и 17,9±1,2% соответственно, p=0,042) и дисбиоз (5,7±0,2% и в 9,3±0,3% соответственно, p=0,015) в отделяемом цервикального канала, что необходимо для проведения адекватной диагностики и периоперативного лечения пациенток для профилактики рецидивирования цервикальных неоплазий.
Расчет специфичности и чувствительности изучаемых методов продемонстрировал значительно более высокую чувствительность метода жидкостной цитологии при высокой степени цервикальной неоплазии и РШМ (p=0,003 при CIN II и p=0,002 при CIN III, p=0,000 при РШМ).
Результаты дискордантных сравнений цитологического исследования методами традиционной и жидкостной цитологии диктуют необходимость рекомендовать жидкостную цитологию в качестве предпочтительной в скрининге предраковой и раковой цервикальной патологии.



