Несмотря на современные методы диагностики и лечения предраковых заболеваний шейки матки, ежегодно в мире регистрируются 470 тыс. новых случаев рака шейки матки (РШМ), из которых 233 тыс. заканчиваются смертельным исходом [1].
В последнее десятилетие в ряд приоритетных медико-социальных проблем вошла папилломавирусная инфекция (ПВИ) в связи с резким ростом, значительной контагиозностью, полиорганностью вызываемых заболеваний и высоким онкогенным потенциалом возбудителя [2].
Оценить распространенность вируса папилломы человека (ВПЧ) очень трудно, так как фиксируется лишь частота клинических проявлений, а не истинные масштабы инфицированности. Всемирная организация здравоохранения сообщает, что ежегодно в мире ВПЧ вызывают до 500 000 новых случаев РШМ и около 240 000 женщин умирают от цервикального рака. Распространенность ПВИ в различных странах мира колеблется от 14,0 до 39,2% из 100 обследованных. Весьма тревожен тот факт, что наибольшая частота ПВИ отмечается в возрастной группе до 25 лет, то есть среди молодых женщин репродуктивного возраста, которые при невыраженной клинической картине вагинального кондиломатоза являются резервуаром инфекции и представляют опасность для половых партнеров и будущего ребенка.
В мировом масштабе число инфицированных за последнее десятилетие увеличилось более чем в 10 раз и составило около 630 млн человек. До 82% женщин считаются инфицированными уже через два года после сексуального дебюта; при этом, даже имея одного полового партнера, около 20% женщин заражены. Согласно данным Центров по контролю и профилактике заболеваний (CDC), к 50 годам жизни ВПЧ заражены, как минимум 80% женщин.
ВПЧ-ассоциированные заболевания, согласно данным литературы, у 16,9% женщин представлены плоскими и остроконечными кондиломами, у 28,2% – различными изменениями метапластического или плоского эпителия шейки матки при наличии единичных клеток с койлоцитозом, у 16,9% – цервикальными интраэпителиальными неоплазиями в сочетании с плоской кондиломой, у 27,4% – цервикальными интраэпителиальными неоплазиями разной степени тяжести без койлоцитов, у 10,4% – РШМ [3, 4].
В настоящее время не существует единой этиотропной терапии и практически отсутствует системное лечение пациентов с ВПЧ-ассоциированной инфекцией. Тем не менее, сформулировано несколько принципов лечения данной группы заболеваний, следование которым позволяет достигать медицинских результатов [5].
Первым принципом лечения ВПЧ-ассоциированных заболеваний является комплексный подход, включающий использование различных методов деструкции гиперпластических/неопластических образований. Мы считаем принципиальным моментом использование радиоволновой хирургии, учитывая следующие преимущества: возможность адекватной эксцизии зоны трансформации с максимальным иссечением неоплазированного эпителия экто- и эндоцервикса, а также онкологическая безопасность (гистологическому исследованию подвергается весь иссеченный массив и не нужна предварительная биопсия) [6].
Вместе с тем, терапия при рецидивирующих ВПЧ-ассоциированных заболеваниях представляет определенные трудности как из-за отсутствия четкого понимания определенных механизмов заболевания, так и в связи с ограниченным терапевтическим эффектом известных противовирусных препаратов. Доказанное участие иммунных механизмов в развитии ПВИ, проявляющееся вторичным иммунодефицитом, является обоснованием для использования иммуномодулирующих лекарственных средств. В этой связи вторым принципом терапии ВПЧ-ассоциированных заболеваний является включение в их терапию иммунотропных средств разных групп и механизмов действия, позволяющее существенно повысить эффективность терапии, снизить частоту рецидивов и способствующее элиминации/эрадикации ВПЧ [7].
По химическому составу и механизму действия противовирусные средства разделены на три группы: химиопрепараты, интерфероны и индукторы интерферонов. Индукторы интерферонов являются новой и весьма перспективной группой противовирусных препаратов.
Аллокин-альфа относится к иммунотропным лекарственным препаратам. Его действие направлено на усиление распознавания вирусных антигенов и инфицированных клеток натуральными (естественными) киллерами (НК), нейтрофилами и другими эффекторными системами естественного иммунитета, ответственными за элиминацию вируса. Применение аллокина-альфа улучшает распознавание пораженных клеток и позволяет подавить очаги репликации вируса. В отличие от известных индукторов интерферона, аллокин-альфа выступает в качестве кофактора, позволяя продуцирующим интерферон-α лейкоцитам эффективно реагировать на вирусный антиген. Это дает возможность сфокусировать действие препарата в месте размножения вируса и избежать избыточной реакции лейкоцитов за пределами очага инфекции [8].
Таким образом, в настоящее время придается большое значение изучению причин персистенции ВПЧ и его роли в канцерогенезе шейки матки, поиску и разработке эффективных, малотравматичных и безопасных методов лечения ВПЧ-ассоциированных заболеваний.
Цель исследования: улучшить исходы лечения заболеваний шейки матки при персистирующей ПВИ.
Материал и методы исследования
Для решения поставленных задач были обследованы 50 пациенток с заболеваниями шейки матки и персистенцией ВПЧ (ретроспективный анамнез, Рар-тест, ВПЧ-тестирование, расширенная кольпоскопия, цервикоскопия, радиохирургическая конизация шейки матки с последующим морфологическим исследованием). У всех обследованных были выявлены пролиферативные заболевания цервикального канала (гиперплазия эндоцервикса, микрополипоз эндоцервикса). Пациентки с ВПЧ получали противовирусную терапию препаратом аллокин-альфа. Проводился детальный анализ после лечения.
Критерии включения пациенток в исследование: женщины репродуктивного возраста (19–47 лет) с заболеваниями шейки матки.
 Критерии исключения: беременность, РШМ.
Критерии исключения: беременность, РШМ.
Результаты и их обсуждение
При исследовании возрастного ценза обследованного контингента установлено, что средний возраст пациенток с заболеваниями шейки матки с персистенцией ВПЧ составил 27,6±3,9 года, преобладали пациентки в возрасте 25–30 лет – 26 (52%).
Высокий риск развития заболеваний шейки матки обуславливают следующие факторы и их сочетание: раннее начало половой жизни, высокая частота искусственных прерываний беременности, экстрагенитальные заболевания (нарушение жирового обмена, гипотериоз), сопутствующие гинекологические заболевания (миома матки, гиперпластические процессы эндометрия, воспалительные заболевания), высокий инфекционный индекс.
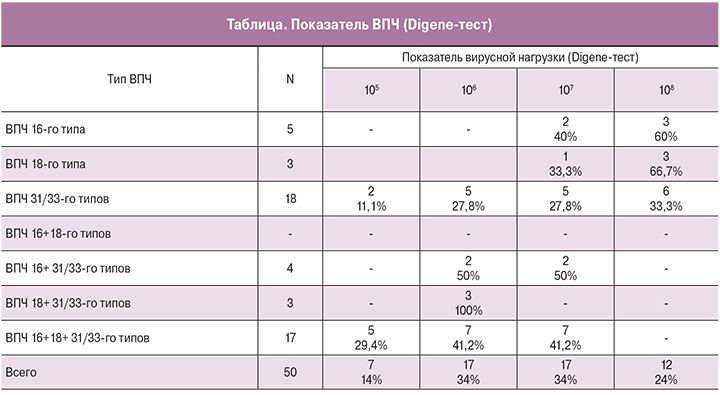
Анализ показателей, полученных в ходе обследования пациенток с заболеваниями шейки матки при персистирующей ПВИ, представлен на рис. 1. Из представленных данных следует, что у 35 (70%) женщин выявлен ВПЧ 16+18+31/33 типов, из них ВПЧ 31/33 – у 18 (51,4%).
Все пациентки обследованы с помощью метода диагностики ВПЧ HIBRID CAPTUR II (Digene-тест), который имеет несомненные преимущества для практики. Полученные нами данные были представлены в ЕД. Одна единица соответствовала 100000 геномов в 1 мл (105).
Установлено, что 92% пациенток имели концентрацию ВПЧ выше клинически значимого уровня, то есть более 105. Из них у каждой третьей уровень ВПЧ составил 106–107, а каждой четвертой – 108 (таблица).
Анализ результатов Digenе-теста и цитологического исследования, показал: у 24 (48%) пациенток с минимальной вирусной нагрузкой 105-6 и у 29 (58%) с вирусной нагрузкой 107-8 при цитологическом исследовании обнаружены признаки цервицита, лейкоплакии (33–66% и 17–34% соответственно), плоскоклеточные интраэпителиальные поражения низкой степени (LSIL) (42–84% и 13–26% соответственно), высокой степени (HSIL) (38–76% и 13–26% соответственно). Пролиферативные процессы в эндоцервиксе у пациенток с минимальной вирусной нагрузкой 105-6 выявлены у 33 (66%) женщин, а с вирусной нагрузкой 107-8 – у 26 (52%).
 Цитологическое исследование достоверно чаще выявляло цитограмму III класса у пациенток с персистирующей ПВИ. Койлоциты и дискератоциты – клетки, являющиеся маркерами ПВИ, выявлены у 27,7% пациенток с LSIL и 53,4% с HSIL. Преобладание у пациенток с SIL цитограммы PAP- test III класса, койлоцитарной атипии подтверждает данные литературы о способности ВПЧ инициировать развитие неопластических процессов [7].
Цитологическое исследование достоверно чаще выявляло цитограмму III класса у пациенток с персистирующей ПВИ. Койлоциты и дискератоциты – клетки, являющиеся маркерами ПВИ, выявлены у 27,7% пациенток с LSIL и 53,4% с HSIL. Преобладание у пациенток с SIL цитограммы PAP- test III класса, койлоцитарной атипии подтверждает данные литературы о способности ВПЧ инициировать развитие неопластических процессов [7].
Кольпоскопия при персистенции ПВИ выявляла ацетобелый эпителий у 26 (52%), пунктацию – у 16 (32%), мозаику – у 9 (18%), лейкоплакию – у 14 (28%), а также атипические сосуды – у 6 (12%), низко и высоко атипическую зону трансформации (60–100%). При LSIL преобладала низко атипическая зона трансформации – у 39 (78%), в то время как при HSIL – высоко атипическая зона трансформации – у 38 (76%). Пунктация, мозаика и атипические сосуды выявлены при кольпоскопии у 66%; 56 и 28% соответственно в группе с LSIL и увеличивались до 100% – с HSIL (75%; 100 и 100% соответственно).
Таким образом, цитологический метод исследования, основанный на диагностике доброкачественных заболеваний шейки матки при персистирующей ПВИ по наличию койлоцитов и дискератоцитов характеризуется высокой специфичностью – 46 (92%), но низкой прогностической ценностью – 29 (58%). Другие методы диагностики (кольпоскопия, морфология) также не позволяют безошибочно диагностировать изменения на шейке матки. И только комплексное применение всех перечисленных методов обследования снижает вероятность ошибочных ложнопозитивных или ложнонегативных заключений при обследовании женщин с доброкачественными заболеваниями шейки матки при персистирующей ПВИ и делает необходимым использование в скрининге всех вышеперечисленных методов диагностики.
Выбор метода комбинированного лечения основывался на разработанном нами алгоритме обследования.
Комбинированная терапия включала: противовирусное лечение ПВИ за 20 дней до радиоволновой хирургии. Стандартный курс лечения высокого онкогенного типа ВПЧ включал инъекции препарата аллокин-альфа в дозе 1 мг через день, всего на курс 6 инъекций подкожно. Целесообразность комбинированного лечения с применением аллоферона была обусловлена уменьшением количества реплицирующего вируса.
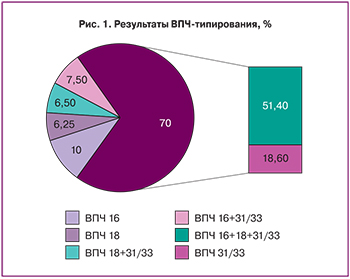
Результаты лечения в послеоперационном периоде оценивались в первые 20–30 дней и через 3 месяца после операции по следующим критериям: жалобы, характер выделений, сроки отторжения струпа и полной эпителизации (рис. 2).
При сравнении выявлены некоторые особенности течения послеоперационного периода у пациенток с ВПЧ: менее активное очищение раны к 7-м суткам, чем у пациенток без ВПЧ; менее активные грануляции к 14-м суткам; кровотечение отходящего струпа отмечено в 3 раза чаще, чем у пациенток без ВПЧ, а также несколько замедленная полная эпителизация зоны эксцизии от 10 до 14 дней. Через 30 дней полная эпителизация отмечена у каждой шестой пациентки группы с ВПЧ (в 3 раза меньше, чем у пациенток без ВПЧ); через 45 дней – почти у каждой второй (в 1,5 раза меньше, чем у пациенток без ВПЧ); к 60-м суткам – у всех пациенток отмечалась полная завершенная эпителизация.
При расширенной кольпоскопии у всех пациенток выявлена нормальная кольпоскопическая картина с явлениями завершенной эпителизации, а при цитологическом исследовании – Рар-test I–II класса.
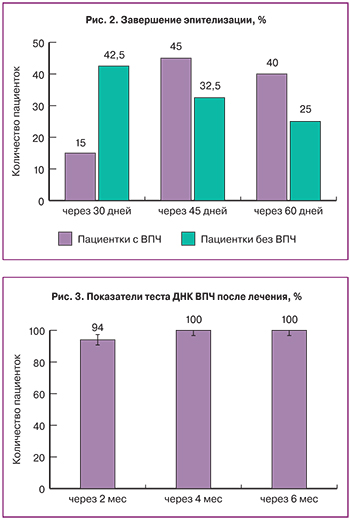
Из 50 пациенток с ВПЧ у 47 (94%) после лечения выявлен негативный результат (ВПЧ не обнаружен) (рис. 3); у 3 пациенток (6%) – до лечения титр ДНК ВПЧ был 107, после лечения – 105. Этим женщинам был назначен второй курс противовирусной терапии, и через 2 месяца после лечения результат тестирования ВПЧ был отрицательным.
Заключение
Наш клинический опыт, обобщенный в данной статье, свидетельствует о принципиальном совпадении результатов кольпоскопического и цитологического исследований почти у всех пациенток. Это было достигнуто благодаря постоянному обсуждению спорных клинических ситуаций и большому опыту исследователей.
Исходы и эффективность лечения оценивались нами по следующим критериям: полный эффект после комплексного лечения составил 94%, неполный эффект имел место у 6% женщин.
Показателем эффективности иммуномодулирующей терапии было снижение вирусной нагрузки в зоне трансформации до эксцизионных манипуляций на шейке матки. Положительный Digenе-тест определялся только у 3 пациенток после лечения. У 94% женщин после комбинированного лечения выявлены отрицательные значения ВПЧ. Через 6 месяцев после лечения у всех пациенток с заболеваниями шейки матки и разной вирусной нагрузкой ВПЧ, выявляемой ранее, рецидивов заболевания шейки матки не выявлено, что указывало на адекватный объем лечения.
Основанием целесообразности иммунокорригирующего лечения является прежде всего тот факт, что глубина эксцизии определяется эмпирически и полноту иссечения неоплазированного эпителия невозможно контролировать, а очаги персистирующей ПВИ могут находиться также вне иссекаемой зоны трансформации, являясь источником новых вирионов.
Таким образом, предложенный комплекс мероприятий, основанный на противовирусной терапии препаратом аллокин-альфа и дифференцированном подходе к выбору метода хирургического воздействия, позволил получить максимально положительный результат лечения.



