Одно из главных направлений в решении проблемы охраны материнства и детства связано со снижением потерь беременности на протяжении всего срока гестации, учитывая причины, приводящие к репродуктивным потерям и привычному невынашиванию беременности (ПНБ). Несмотря на достигнутый в последние десятилетия прогресс в диагностике и лечении ПНБ, распространенность данной патологии остается высокой. По данным ВОЗ, частота ПНБ составляет 15–20% исходов всех беременностей [1]. Этиологию самопроизвольного прерывания беременности составляет ряд причин, среди которых доминируют инфекционная патология и иммунные нарушения [2]. В последние годы среди инфекционных факторов на первый план выходят представители оппортунистических инфекций (Cytomegalovirus, Herpes simplex virus, Candida albicans, Staphylococcus aureus, Streptococcus pyogenes, Mycobacterium tuberculosis и др.), которые реализуются на фоне дефектов иммунной системы [3]. Доказана этиологическая роль герпесвирусной инфекции (ГВИ), в частности, обусловленной вирусом простого герпеса (ВПГ-2) и цитомегаловирусом (ЦМВ) в ПНБ [4]. По мнению ряда авторов, основным патогенетическим звеном самопроизвольных выкидышей является ослабление иммунитета и активизация репликационной активности ВПГ и генерализация инфекции с поражением плаценты и плода [5].
Известно, что клеточные реакции противовирусного иммунитета осуществляют макрофаги, моноциты и Т-лимфоциты, продуцирующие большое число цитокинов в ответ на антигенную стимуляцию [3]. Так как ГВИ часто протекают в субклинических формах, их диагностика затруднительна, при этом необходимо проведение противовирусного лечения.
В настоящее время существует целый ряд химиотерапевтических препаратов, обладающих противогерпетической активностью [6, 7]. Клинический опыт их применения показал, что они способны быстро и эффективно купировать острые проявления простого герпеса, но при этом не предотвращают рецидив хронической ГВИ [7].
В связи с этим в последние годы внимание специалистов привлекают другие подходы в терапии хронической рецидивирующей ГВИ. Одной из таких методик является метод фотодинамической терапии (ФДТ), который нашел широкое применение в лечении как онкологических, так и других заболеваний [8]. Методика предусматривает фотомодификацию крови (ФМК) за счет взаимодействия оптического излучения и препарата фотосенсибилизатора (ФС) [9]. При фотодинамическом воздействии в тканях происходит фотохимическая реакция с образованием активных форм кислорода: синглетного кислорода – сильного цитотоксического агента, который повреждает мембраны и органеллы патологических клеток, вызывая их гибель.
Недавно показано, что ФДТ воздействует на вирусные частицы [10]. Таким образом, ФДТ потенциально может быть использована в терапии ГВИ. Учитывая, что одной из причин ПНБ является ГВИ, целесообразно проведение ФДТ в качестве предгравидарной подготовки к беременности. В литературе нет данных, как ФДТ воздействует на иммунную систему. В настоящее время повысился интерес к изучению цитокинов при осложненной беременности [2, 11, 12]. Поэтому актуально изучение влияния метода фотосенсибилизированной ФМК на цитокиновый профиль при ПНБ на фоне ГВИ.
При ПНБ на фоне ГВИ большое значение имеет ряд цитокинов, выработка которых стимулируется инфекционными, в том числе вирусными антигенами. Одним из таких цитокинов является фактор некроза опухолей (ФНО-α) – мультипотентный модулятор иммунного ответа. Известно, что ФНО-α коррелирует с тяжестью течения инфекционного процесса [2, 4], что позволяет использовать его в качестве диагностического критерия, в том числе при ГВИ. По данным ряда авторов, повышенная продукция ФНО-α – один из фактов, способствующих ПНБ [3, 4]. К примеру, при повышении уровня ФНО-α при апоптозе клеток плаценты необходима оценка уровня ФНО-α у пациенток с ПНБ в ранние сроки беременности, особенно при ГВИ [13].
Также известно, что при вирусной инфекции вырабатываются интерфероны I типа (ИФН-α и ИФН-β), которые являются противовирусными цитокинами [7, 14]. G. Aboagye-Mathiesen и соавт. показали, что при беременности ИФН-α продуцируется тканями трофобласта, что может приводить к гиперактивации иммунных механизмов как следствию нарушения функционирования трофобласта и патологии беременности [15].
Среди других цитокинов, влияющих на функционирование трофобласта, выделяют трансформирующий фактор роста β1 (TФР-β1), который регулирует дифференцировку и функциональную активность клеток трофобласта [3]. По данным Jana Skrzypczak и соавт. продукция TФР-β1 играет важную роль в подготовке эндометрия к имплантации плодного яйца и способствует адгезии клеток трофобласта [16]. Снижение экспрессии TФР-β1 приводит к нарушению процесса имплантации [17, 18].
Представленные цитокины имеют особый интерес в связи с тем, что они актуальны для изучения, и служат маркерами осложнений беременности [18]. Цитокиновый профиль при ПНБ на фоне ГВИ и лечении фотосенсинсибилизиованной ФМК не изучен.
Целью настоящего исследования был анализ экспрессии гена ФНО-α мононуклеарными клетками крови и продукции цитокинов (ФНО-α, ИФН-α, TФР-β1) в сыворотке крови при фотосенсибилизированной ФМК у пациенток с ГВИ без ПНБ и с ПНБ в анамнезе.
Материал и методы исследования
Было проведено комплексное обследование и лечение 74 пациенток с ПНБ и ГВИ в возрасте от 18 до 35 лет, находившихся на стационарном лечении в 1-м гинекологическом отделении ГБУЗ ГКБ № 55 Департамента здравоохранения г. Москвы с 2010 по 2012 гг. Проведено клинико-лабораторное обследование и лечение методом химиосенсибилизированной ФМК 36 женщин с ГВИ без ПНБ в анамнезе (1-я группа) и 38 женщин с ПНБ в анамнезе вирусного генеза вне беременности (2-я группа). Группу сравнения составили условно здоровые женщины – доноры без носительства вирусной инфекции (ВПГ-2, ЦМВ) по данным ретроспективного анализа.
 Критериями отбора в основную группу были: исключение генетических, эндокринных, тромбофилических, анатомических причин ПНБ; неразвивающаяся беременность и ПНБ в анамнезе; пациентки, ранее не проходившие по программе вспомогательных репродуктивных технологий. В исследование были включены женщины преимущественно с непереносимостью и неэффективностью применения противовирусных препаратов в анамнезе.
Критериями отбора в основную группу были: исключение генетических, эндокринных, тромбофилических, анатомических причин ПНБ; неразвивающаяся беременность и ПНБ в анамнезе; пациентки, ранее не проходившие по программе вспомогательных репродуктивных технологий. В исследование были включены женщины преимущественно с непереносимостью и неэффективностью применения противовирусных препаратов в анамнезе.
Клинические методы исследования пациенток включали: сбор анамнестических данных, общий осмотр, специальное гинекологическое исследование. Всем пациенткам проводилось исследование клинических и биохимических показателей крови (коагулограмма, анализ мочи, определение группы крови, резус-принадлежности), определение антител к Treponema Pallidum, ВИЧ, HВsAg, HCV; ПЦР-диагностика инфекций, передающихся половым путем; ультразвуковое исследование внутренних половых органов и других стандартных методов исследования.
Методика проведения фотосенсибилизированной ФМК с препаратом фотодитазин: внутривенное струйное введение 1 мл (концентрация 0,5 мг/мл) фотодитазин («Вета-Гранд», РФ) в разведении на физиологическом растворе (ОАО «Биохимик», РФ) в затемненном помещении. Через 5–10 мин после инъекции проводили транскутанное 8-минутное облучение крови лазерным излучением. Облучение осуществляли с помощью диодного лазерного аппарата «Аткус-2» («Полупроводниковые приборы», РФ). Доза лазерного облучения эмпирическая (длина волны 662 нм, плотность мощности на выходе 1,85–2 Вт). На фоне проводимой терапии осуществлялся клинико-лабораторный мониторинг всех пациенток в динамике для оценки влияния данного метода лечения на состояние всего организма. Курс проведения фотосенсибилизированной ФМК составил 8 процедур. Процедура проводилась согласно графику 1 раз в 3 дня.
У всех пациенток проводили забор периферической крови (до процедуры; через 1 час после процедуры; через 1 сутки после процедуры; после 3-й процедуры (9–10-е сутки) и после завершения курса лечения (18–20-е сутки)) для исследования иммунологических показателей.
Исследование уровня экспрессии гена ФНО-α проводили в несколько этапов: вначале выделяли мононуклеарные клетки в модификации метода Boyum (1968) [19], основанному на седиментации в одноступенчатом градиенте плотности фиколл-урографина (Sigma Chemical Co., США); далее из моноцитов периферической крови выделяли РНК с помощью набора для выделения мРНК «Rneasy Protect Cell Mini Kit» (Qiagen, Германия), строго следуя протоколу фирмы-производителя. Уровень экспрессии гена ФНО-α в мононуклеарных клетках периферической крови определяли методом обратной транскрипции и полимеразной цепной реакции в режиме реального времени (ПЦР-РВ). Реакцию обратной транскрипции (на матрице РНК синтез кДНК) проводили с использованием реагентов «Набора реагентов для проведения реакции обратной транскрипции (ОТ)» (Синтол, РФ). Полученную кДНК хранили при –70˚С.
Для постановки ПЦР-РВ использовали реактивы из «Набора для проведения ПЦР-РВ в присутствии интеркалирующего красителя SYBR Green I (Синтол, РФ) согласно рекомендациям фирмы-производителя. Реакционная смесь содержала 10 мкл, праймеры по 1 мкл каждого (1 OE/мкл), MgCl2 25 мМ 1,5 мкл, образец ДНК 5 мкл. Общий объем реакции составлял 25 мкл. Пробирки помещали в амплификатор для ПЦР-РВ ДТ-96 («ДНК-технология», РФ), позволяющий анализировать образцы ДНК/РНК в динамическом диапазоне от 1 до 109 копий и одновременно детектировать четыре флуоресцентных красителя (FAM/SYBR Green, ROX, R6G, CY5) с заданной программой (95˚С – 20 сек, 62˚С – 40 сек) с числом циклов 40. Изучение экспрессии гена проводили относительно экспрессии гена β-актина [20].
Иммунологические исследования цитокинового профиля (ФНО-α, ИНФ-α, TФР-β1) в сыворотке крови проводили с использованием иммуноферментных наборов для количественного определения человеческого TNF-α, IFN-α, TGF-β1 в человеческой сыворотке, плазме, моче и супернатанте культур клеток «Bender MedSystems», GmbH, Австрия согласно протоколам для постановки иммуноферментного анализа от фирмы-производителя. Регистрацию результатов ИФА проводили на аппарате ридер «Reader ELx800» (Universal Microplate Reader, ЗАО ФинБио, Санкт-Петербург).
Математико-статистическую обработку полученных результатов проводили с использованием программы Excel и Statistica 7.0. Результаты в работе представлены в виде Х±σ. Для сравнения групп данных использовали непараметрические методы статистической обработки (критерий Манна–Уитни) [21].
С целью изучения влияния фотосенсибилизированной ФМК на динамику титра специфических антител нами первоначально был проведен анализ титров специфических иммуноглобулинов класса G против ВПГ-2 и ЦМВ. Было выявлено, что титры иммуноглобулинов IgG к ВПГ-2 и к ЦМВ достоверно не менялись на фоне проводимой терапии у пациенток обеих групп.
Для изучения воздействия проводимой терапии на иммунную систему мы провели комплексное определение экспрессии гена ФНО-α в мононуклеарных клетках периферической крови, а также определение уровня провоспалительного цитокина ФНО-α в сыворотке крови.
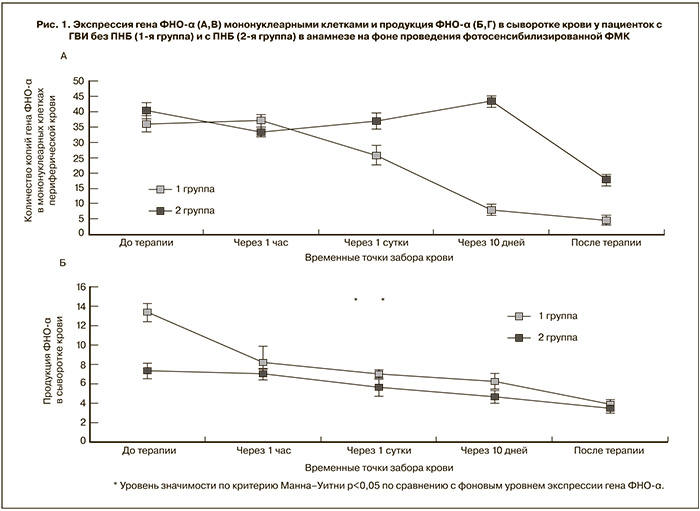
Фоновый уровень экспрессии гена ФНО-α до проведения терапии у пациенток 1-й группы без ПНБ составил 36,18±9,81×105 копий гена. Исследование экспрессии гена ФНО-α у пациенток в данной группе на фоне лечения выявило, что через 10 суток после начала терапии экспрессия гена ФНО-α достоверно снижалась у 60% пациенток и составляла 8,23±2,65×105 копий гена (p<0,05) (рис. 1А). У остальных 40% пациенток была другая динамика: через сутки от начала лечения отмечалось недостоверное повышение экспрессии гена ФНО-α, что соответствовало 36,99±13×105 копий гена, но на фоне проводимой терапии было выявлено достоверное снижение экспрессии гена ФНО-α.
У 100% пациенток 1-й группы без ПНБ отмечалась достоверная динамика снижения экспрессии гена ФНО-α на фоне терапии и после проведения всех процедур составила 4,79±2,63×105 копий гена (p<0,05). После завершения курса лечения тенденция снижения экспрессии гена ФНО-α в динамике у всех пациенток сохранялась.
Исследование экспрессии гена ФНО-α сопоставляли с уровнем продукции провоспалительного ФНО-α. Было получено, что у пациенток 1-й группы без ПНБ средний уровень ФНО-α до проведения терапии составил 6,16±4,1 пк/мл.
Анализ индивидуальных данных показал, что недостоверный рост продукции ФНО-α на фоне терапии был у 40% пациенток и составлял 10,03±2,8 пк/мл после курса лечения. Следует отметить, что повышение продукции ФНО-α в сыворотке крови пациенток с хронической ГВИ является следствием того, что ФНО-α участвует в защите организма от ГВИ.
У остальных 60% пациенток наблюдалось снижение продукции ФНО-α на фоне терапии, что составило 3,9±1,6 пк/мл после проведения курса процедур (рис. 1Б).
У большинства пациенток с ГВИ и без ПНБ в анамнезе на фоне проводимой терапии динамика продукции ФНО-α повторяла динамику экспрессии гена ФНО-α. Таким образом, фотосенсибилизированная ФМК приводила к нормализации показателей.
Полученные результаты продукции ФНО-α были сопоставлены с данными ретроспективного анализа в группе сравнения, где фоновый уровень ФНО-α в среднем составлял 2,4±0,8 пк/мл [2], 3,3±0,25 пк/мл [22] и был достоверно ниже в 2 раза фонового уровня продукции ФНО-α у пациенток 1-й группы.
Сопоставляя полученные данные со 2-й группой пациенток с ПНБ в анамнезе, выявили, что фоновый уровень экспрессии гена ФНО-α до проведения терапии составил 40,18±10,0×105 копий гена (p<0,05). У всех пациенток в этой группе уровень экспрессии ФНО-α до начала лечения был сопоставим со средними значениями данного показателя у пациенток в 1-й группе. На фоне терапии в данной группе пациенток экспрессия гена ФНО-α уже через 1 ч после первой процедуры снизилась и составляла 33,64±7,72×105 копий гена (p<0,05). Такая динамика наблюдалась у 75% пациенток (рис. 1В). Значения экспрессии гена ФНО-α через 10 дней после процедуры в среднем составляли 43,35±14×105 копий гена (p<0,05) – показатели экспрессии гена ФНО-α вновь вернулись на исходный уровень, как до проведения терапии у 33,4% пациенток с динамикой снижения экспрессии гена ФНО-α через сутки после 1-й процедуры. Но несмотря на такую неоднозначную динамику экспрессии гена ФНО-α на фоне терапии, после проведения курса процедур фотосенсибилизированной ФМК достоверная динамика снижения экспрессии гена ФНО-α была выявлена у 62,5% пациенток 2-й группы с ПНБ и составляла 17,93±10,5×105 копий гена (p<0,05).
У 25% пациенток 2-й группы на 10-е сутки от начала лечения отмечалось повышение экспрессии гена ФНО-α как стимулирующий эффект в ответ на фотосенсибилизированную ФМК. К завершению курса процедур наблюдалось снижение экспрессии гена ФНО-α. Данную динамику можно объяснить изначально сниженным противогерпетическим иммунитетом. Проводимая терапия, возможно, способствовала стимуляции иммунного ответа на длительную персистенцию ВПГ, истощающего иммунную систему у данной категории пациенток.
 При анализе результатов уровня продукции прововоспалительного ФНО-α во 2-й группе пациенток с ПНБ в анамнезе было выявлено, что концентрация сывороточного ФНО-α до начала терапии составляла 7,35±3,95 пк/мл (p<0,05), что было достоверно выше нормальных показателей в группе сравнения [2, 22], но сопоставимо со средними значениями у пациенток в 1-й группе. Известно, что предрасположенность к гиперсекреции ФНО-α может служить одним из факторов, способствующих привычному выкидышу и бесплодию «неясного генеза» [3]. По мнению ряда авторов, у женщин с прервавшейся беременностью в анамнезе концентрация ФНО-α более чем в 2 раза превышает показатели у пациенток с физиологически протекавшей и сохраненной беременностью [23]. Снижение продукции ФНО-α наблюдалось у 62,5% пациенток, данный показатель не менялся достоверно (рис. 1Г), при этом у 80% этих пациенток наблюдалось повышение продукции ФНО-α в начале и середине курса процедур. В ответ на проводимую терапию повышение продукции ФНО-α наблюдалось у 37,5% пациенток через 1 ч после 1-й процедуры. Но в исходе после проведенного курса лечения продукция ФНО-α достоверно снизилась у этих женщин. Концентрация сывороточного ФНО-α после завершения курса лечения у пациенток 2-й группы составляла 3,45±2,2 пк/мл (p<0,05) и достоверно отличалась от значений, полученных до начала лечения и не достоверно – от нормальных показателей в группе сравнения [2, 22].
При анализе результатов уровня продукции прововоспалительного ФНО-α во 2-й группе пациенток с ПНБ в анамнезе было выявлено, что концентрация сывороточного ФНО-α до начала терапии составляла 7,35±3,95 пк/мл (p<0,05), что было достоверно выше нормальных показателей в группе сравнения [2, 22], но сопоставимо со средними значениями у пациенток в 1-й группе. Известно, что предрасположенность к гиперсекреции ФНО-α может служить одним из факторов, способствующих привычному выкидышу и бесплодию «неясного генеза» [3]. По мнению ряда авторов, у женщин с прервавшейся беременностью в анамнезе концентрация ФНО-α более чем в 2 раза превышает показатели у пациенток с физиологически протекавшей и сохраненной беременностью [23]. Снижение продукции ФНО-α наблюдалось у 62,5% пациенток, данный показатель не менялся достоверно (рис. 1Г), при этом у 80% этих пациенток наблюдалось повышение продукции ФНО-α в начале и середине курса процедур. В ответ на проводимую терапию повышение продукции ФНО-α наблюдалось у 37,5% пациенток через 1 ч после 1-й процедуры. Но в исходе после проведенного курса лечения продукция ФНО-α достоверно снизилась у этих женщин. Концентрация сывороточного ФНО-α после завершения курса лечения у пациенток 2-й группы составляла 3,45±2,2 пк/мл (p<0,05) и достоверно отличалась от значений, полученных до начала лечения и не достоверно – от нормальных показателей в группе сравнения [2, 22].
Также определяли уровень ИФН-α в динамике у пациенток на фоне проводимой терапии фотосенсибилизированной ФМК.
Фоновый уровень сывороточного ИФН-α до проведения терапии у всех пациенток 1-й группы без ПНБ в анамнезе был равен 11,06±3,54 пк/мл и был примерно одинаковым у всех женщин. Данный показатель достоверно не отличался от значений, полученных у пациенток во 2-й группе с ПНБ, который составил 12,85±1,96 пк/мл. При сопоставлении с нормальными популяционными показателями 20–120 пг/мл в группе сравнения [24] был выявлен достоверно сниженный фоновый уровень ИФН-α у всех пациенток с ГВИ. На фоне проведения терапии у пациенток 1-й и 2-й групп отмечалась недостоверная динамика подъема уровня ИФН-α. Таким образом, после проведения терапии уровень ИФН-α у всех пациенток вернулся к исходному значению. Показатели продукции ИНФ-α в сыворотке крови у пациенток с ГВИ представлены в табл. 1.
Также мы проводили оценку уровней противовоспалительного цитокина TФР-β1 в сыворотке крови в динамике на фоне фотосенсибилизированной ФМК. Установлено, что выявление в динамике цитокина TФР-β1 у пациенток исследуемых групп может иметь определенное значение в оценке эффективности проводимой терапии.
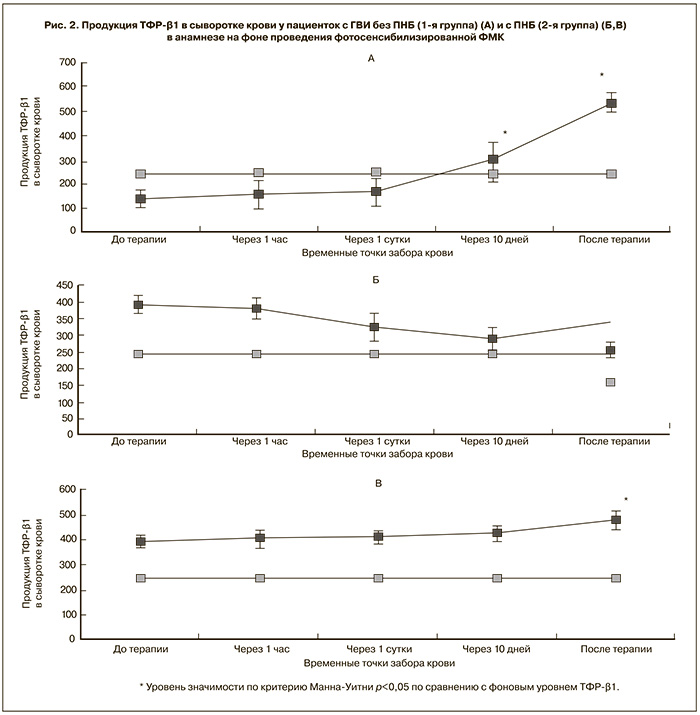
При определении уровней TФР-β1 на фоне проведения фотосенсибилизированной ФМК у пациенток исследуемых групп было получено, что до проведения терапии у пациенток 1-й группы без ПНБ уровень исходного TФР-β1 составлял 140,94±39,9 пк/мл (p<0,05) и был достоверно ниже в сравнении с ретроспективно полученным значением концентрации TФР-β1 в сыворотке крови здоровых доноров 243,0±6,5 пк/мл [25].
В динамике на фоне терапии у пациенток в данной группе отмечался достоверный рост уровня TФР-β1 и в конце курса лечения составлял 534,4±197,5 пк/мл (рис. 2А).
Анализируя результаты уровня TФР-β1 в сыворотке крови на фоне проведения терапии у пациенток 2-й группы с ПНБ, мы получили, что исходный уровень TФР-β1 в этой группе составлял 391,86±48,1 пк/мл и был в 1,6 раз выше, чем в группе сравнения. На фоне фотосенсибилизированной ФМК отмечалось 2 тенденции по динамике продукции TФР-β1. У 62,5% пациенток этой группы вначале курса процедур наблюдалось недостоверное снижение продукции TФР-β1, но к середине (10-е сутки) и к завершению курса процедур (18–20-е сутки) продукция TФР-β1 имела тенденцию к нарастанию (рис. 2Б). У остальных 37,5% пациенток в данной группе на фоне проводимой терапии в динамике отмечался достоверный рост TФР-β1 в сравнении с аналогичными показателями в 1-й группе (рис. 2В), что способствует подготовке эндометрия к имплантации плодного яйца и адгезии клеток трофобласта. Данные динамики продукции TФР-β1 в сыворотке крови у пациенток с ГВИ на фоне фотосенсибилизированной ФМК представлены в табл. 2.
Обсуждение
Изучение влияния метода фотосенсибилизированной ФМК на цитокиновый профиль при ПНБ на фоне ГВИ является актуальным исследованием, учитывая повышение частоты самопроизвольных выкидышей. Проведенные исследования по оценке экспрессии гена ФНО–α и цитокинового профиля (ФНО–α, ИФН-α, TФР-β1) на фоне фотосенсибилизированной ФМК установили, что наиболее достоверными показателями оценки эффективности проводимой терапии явились ФНО–α и TФР-β1.
На основании вышеприведенных данных мы выявили, что у большинства пациенток с ГВИ 1-й группы без ПНБ в анамнезе динамика продукции ФНО-α повторяла динамику снижения экспрессии гена ФНО-α. Во 2-й группе пациенток с ГВИ и ПНБ наблюдалась динамика снижения экспрессии гена ФНО-α и отсроченное до 10-х суток снижение продукции ФНО-α. В данном случае, учитывая состояние иммунной дисфункции на фоне хронической ГВИ, отсроченная продукция ФНО-α была индуцирована, возможно, проводимой терапией.
При исследовании уровней TФР-β1 на фоне проведения фотосенсибилизированной ФМК у пациенток исследуемых групп отмечалась преимущественная динамика роста данного показателя. Поддержание высокого уровня TФР-β1, возможно, способствует торможению репликации ВПГ, что благоприятно для планирования и вынашивания беременности. E. Ball и соавт. доказали, что TФР-β1 и другие его изоформы не являются патологическими факторами роста в процессе формирования трофобласта, тем самым не могут способствовать привычному выкидышу [26, 27]. Поэтому, принимая во внимание данный факт, можно сказать, что полученная нами положительная динамика роста данного показателя у пациенток с ГВИ и ПНБ в дальнейшем, возможно, благоприятно скажется на исходе последующей беременности.
Анализ титров специфических иммуноглобулинов класса G против ВПГ-2 и ЦМВ и реакции системы интерферонов (ИФН-α) на проведение фотосенсибилизированной ФМК не был показательным в нашем исследовании. Мы получили отсутствие динамики титров антител и уровня ИНФ-α на фоне проведения терапии. По данным Ф.И. Ершова и соавт., при хронической герпесвирусной инфекции ИФН-статус характеризуется практически полным отсутствием ИФН-продуцирующей способности лейкоцитов [24].
Таким образом, у пациенток всех исследуемых групп уровень сывороточного ИФН-α, несмотря на проведение фотосенсибилизированной ФМК, оставался в пределах фоновых значений, что характеризует глубокое подавление интерферонгенеза – интерферондефицитное состояние. Фотосенсибилизированная ФМК не повлияла на показатели сывороточного ИФН-α, нам не удалось показать эффект фотосенсибилизированной ФМК на примере исследования уровня сывороточного ИФН-α. Отсутствие ответа на проводимую терапию со стороны системы интерферона требует проведения комбинированной терапии рецидивирующей ГВИ.
Изучение клинической эффективности метода фотосенсибилизированной ФМК показало, что при дальнейшем динамическом наблюдении в течение 1 года за пролеченными пациентками эпизодов рецидива ГВИ не было зарегистрировано ни у одной пациентки. Беременность наступила у 7 (19,4%) женщин 1-й группы и у 24 (63,2%) женщин 2-й группы. На момент проведения анализа 15 женщин с ПНБ в анамнезе находились на втором триместре беременности. Рецидивов ГВИ во время беременности также не было зарегистрировано.
Таким образом, результаты проведенных исследований позволяют сделать вывод, что фотосенсибилизированная ФМК может стать эффективным самостоятельным методом предгравидарной подготовки или войти в состав комплексной противовирусной терапии у пациенток с ГВИ и ПНБ в анамнезе. Определение экспрессии гена ФНО-α и цитокинового профиля (ФНО-α, TФР-β1) позволяет отслеживать эффективность фотосенсибилизированной ФМК и доказывает целесообразность ее применения. Проведение оценки изучаемых показателей возможно для определения эффективности других методов терапии ГВИ при ПНБ.



