Привычное невынашивание беременности (ПНБ) является одной из важнейших медицинских и социальных проблем. Частота невынашивания в развитых странах составляет 10–25% от общего числа клинически диагностированных случаев беременности и увеличивается до 50% в возрасте от 40 лет и старше [1, 2]. В России частота самопроизвольного прерывания беременности составляет 15–23%, при этом около 80% репродуктивных потерь приходятся на I триместр [3].
Одним из патогенетических факторов ПНБ являются врожденные и приобретенные нарушения системы гемостаза. Физиологическая активация системы свертывания крови во время беременности начинается с самых ранних сроков, способствует внедрению бластоцисты и предотвращает периимплантационное кровоизлияние во время эндоваскулярного вторжения трофобласта [4]. С другой стороны, избыточное отложение фибрина в месте имплантации и микротромбоз спиральных артерий и артериол нарушают инвазию оплодотворенной яйцеклетки и могут привести как к прерыванию беременности, так и к первичной фетоплацентарной недостаточности с последующим развитием акушерских осложнений [5]. Врожденные тромбофилии, в том числе Лейденская мутация фактора V, мутация гена протромбина, дефицит протеина C, протеина S и антитромбина III, могут стать причиной ПНБ как на ранних, так и на поздних сроках беременности [6–8]. Таким образом, ПНБ может быть связано с приобретенными и наследственными нарушениями гемостаза, в основе которых лежит предрасположенность к внутрисосудистому фибринообразованию. Важно еще на этапе прегравидарной подготовки выявлять пациенток с предтромботическими состояниями, чтобы как можно раньше начать профилактику невынашивания с помощью антикоагулянтов.
Несмотря на исключительную важность диагностики предтромботических состояний, традиционные клинико-лабораторные методы изучения системы гемостаза не всегда позволяют адекватно оценить тромботический потенциал и, как правило, малочувствительны к внутрисосудистой активации системы гемостаза, в том числе при акушерской патологии [9]. В связи с этим представляет интерес новый интегральный метод оценки гемостаза – тест тромбодинамики, который чувствителен как к гипо-, так и к гиперкоагуляции и способен обнаружить ранние изменения в системе гемостаза, лежащие в основе предтромботических состояний [10, 11]. Принцип теста состоит в локальной активации свертывания плазмы крови искусственной поверхностью, покрытой тканевым фактором, имитирующим поврежденную стенку сосуда, и в последующем наблюдении за ростом фибринового сгустка.
Известно, что после свертывания крови in vitro наблюдается спонтанное сжатие сгустка крови. Этот процесс называется контракцией, или ретракцией, сгустка. Поскольку движущей силой контракции сгустка крови являются тромбоциты, этот процесс можно использовать как тест для характеристики их количества и функционального состояния. Кроме тромбоцитов, процесс контракции обусловлен патологическими изменениями клеточного и молекулярного состава крови [12], следовательно, изучение контракции может дать дополнительную информацию об интегральных изменениях гемокоагуляционного потенциала. Клинические исследования показали, что в крови больных с предтромботическими состояниями, такими как ишемический инсульт, венозный тромбоз, системная красная волчанка, контракция сгустков существенно угнетена вследствие дисфункции тромбоцитов, обусловленной их хронической гиперактивацией и энергетическим истощением [13–16]. Есть основания считать, что сходные процессы могут развиваться в организме женщин с хронической гиперкоагуляцией, сопутствующей ПНБ, а изучение контракции сгустков крови даст дополнительную информацию о патогенезе ПНБ и может иметь клиническое значение.
В свете сказанного, целью настоящей работы было изучение состояния системы гемостаза у женщин с ПНБ в анамнезе с помощью двух новых лабораторных тестов – тромбодинамики и кинетики контракции сгустков крови. Наряду с изучением патогенетической роли нарушений гемостаза, целью работы была оценка диагностической и прогностической ценности тестов тромбодинамики и контракции сгустков крови у женщин с ПНБ в анамнезе в сопоставлении с другими клиническими и лабораторными показателями на этапе планирования беременности.
Материалы и методы
Основную группу составили 35 женщин с повторной потерей беременности в анамнезе. Акушерский анамнез включал 2 или более выкидыша до 10 недель беременности, 1 выкидыш или более на 10–22 неделе беременности, 1 или более преждевременных родов на 22–34 неделе беременности. Клиническая характеристика пациенток представлена в таблице. Контрольную группу составили 25 рожавших женщин без отягощенного акушерского анамнеза и предшествующих осложнений беременности, не имеющие личной и семейной истории тромбозов. Пациентки с ПНБ в анамнезе и контрольная группа были сопоставимы по возрасту (средний возраст 32 (5) года и 30 (4) лет соответственно). Исследование проводили на этапе планирования беременности. Критериями исключения из данного исследования были: прием по какой-либо причине антикоагулянтов, тромболитических или антитромбоцитарных препаратов в течение двух недель до момента обследования, а также доказанный антифосфолипидный синдром (АФС). Все женщины давали информированное согласие на обследование.
Кровь для исследований получали согласно требованиям Этического комитета Казанского (Приволжского) федерального университета (выписка из протокола № 3 от 23.03.17). Венозную кровь собирали в вакуумные пробирки с 3,8% цитратом натрия (9:1 об./об.) и анализировали в течение 4 ч после взятия. Один образец цельной крови использовали для анализа контракции сгустка. Второй образец цитратной крови центрифугировали при 2000 g в течение 10 минут при комнатной температуре и отбирали сверху примерно ¾ бедной тромбоцитами плазмы для коагулограммы. Для проведения теста тромбодинамики использовали бестромбоцитную плазму, которую получали путем дополнительного центрифугирования бедной тромбоцитами плазмы в течение 5 минут при 10 000 g при комнатной температуре. Для анализа отбирали верхнюю часть (9/10 объема) свободной от тромбоцитов плазмы. Третья проба крови была стабилизирована ЭДТА (конечная концентрация 1,6 мг/мл) для гематологического анализа.
Кинетика направленного формирования сгустка в плазме крови (тромбодинамика). Метод тромбодинамики заключается в оптической регистрации роста фибринового сгустка в плазме крови после контакта со вставкой-активатором, на поверхности которой иммобилизован тканевой фактор, после чего активируется свертывание крови в примыкающем слое плазмы. Процесс формирования и распространения фибринового сгустка фиксируется видеокамерой в рассеянном свете с помощью «Регистратора тромбодинамики» фирмы «ГемаКор» (Москва).
Для исследования параметров тромбодинамики брали бестромбоцитную плазму, переносили в пробирку с реагентом I (ингибитор ферментов контактной фазы), затем в пробирку с реагентом II (ацетат кальция). Полученный образец перемещали в измерительную кювету (120 мкл), погружали в него вставку-активатор с тканевым фактором и запускали программу для регистрации образования фибрина. Кювета фиксировалась оптически каждые 6 с в течение 30 мин. Полученные снимки были автоматически обработаны программой, с помощью которой вычислялись следующие параметры: 1) лаг-тайм –время, необходимое для начала образования фибрина с момента контакта плазмы с активирующей поверхностью; 2) начальная скорость роста сгустка – средняя скорость роста сгустка, рассчитанная в интервале 2–6 мин после начала роста сгустка; 3) стационарная скорость роста сгустка – средняя скорость роста сгустка, рассчитанная в интервале 15–25 мин после начала роста сгустка; 4) размер фибринового сгустка через 30 мин после контакта плазмы со вставкой-активатором; 5) плотность сгустка – оптический показатель, равный интенсивности рассеяния света фибриновым сгустком, пропорционален плотности фибриновой сети.
Кинетика контракции сгустков крови. Кинетику и степень контракции сгустков крови регистрировали in vitro с помощью того же «Регистратора тромбодинамики». Метод основан на оптической регистрации уменьшающегося размера сгустка крови во времени. Для определения контракции сгустка крови кювету размером 12×7×1 мм ополаскивали 4% раствором Тритона Х-100 в 0,15 М NaCl, чтобы предотвратить прилипание сгустка к внутренним стенкам кюветы. Затем к цитратной крови добавляли 2 мМ хлорида кальция и 1 ЕД/мл тромбина, чтобы запустить процесс свертывания крови и активировать тромбоциты. Затем в каждый из каналов прозрачной кюветы переносили по 80 мкл образца, а саму кювету помещали в термостатируемую камеру «Регистратора тромбодинамики» при 37° C. Изображения сгустков фоторегистрировались автоматически каждые 15 с в течение 20 минут и были проанализированы с помощью специальной компьютерной программы для получения следующих параметров кинетики контракции сгустка: 1) конечная степень контракции – величина, отражающая степень сжатия сгустка в процентах относительно его первоначального размера после 20 минут регистрации; 2) лаг-период – время, когда сгусток достигает 95% его первоначального размера; 3) средняя скорость контракции – сжатие сгустка в процентах на единицу времени; 4) площадь под кинетической кривой, отражающая механическую работу тромбоцитов по сжатию сгустка.
Лабораторные исследования гемостаза и клеточного состава крови. Состояние системы гемостаза оценивали с помощью автоматизированного коагулометра Sysmex СА-1500 (Sysmex, Канада). Определяли параметры коагулограммы: активированное частичное тромбопластиновое время (АЧТВ), протромбиновое время (ПВ), тромбиновое время (ТВ), концентрацию фибриногена по Клауссу, активность антитромбина III (ATIII), уровень плазминогена, уровень протеинов С и S. Уровень D-димера измеряли на иммунохемилюминесцентном анализаторе Immulite 2000 (Siemens Healthcare Diagnostics Inc., США). Содержание растворимых фибрин-мономерных комплексов (РФМК) определяли в ортофенантролиновом тесте (реагенты фирмы «Технология-Стандарт», Россия).
Анализ клеток проводили в цельной крови, стабилизированной ЭДТА, с помощью гематологического анализатора (Siemens Inc., Япония). Определяли количество эритроцитов, средний объем эритроцитов, гематокрит, уровень гемоглобина, среднее содержание гемоглобина в эритроците, цветовой показатель, общее количество лейкоцитов, содержание моноцитов, нейтрофилов, лимфоцитов, эозинофилов, базофилов, тромбоцитов, средний объем тромбоцитов.
В соответствии с руководством по статистическому анализу и методам в публикуемой литературе [17] для статистического анализа использовали исходные данные без преобразований и выбросов. Целью анализа был поиск значимых отличий параметров, характеризующих гемостаз, между основной и контрольной группами, а также между клиническими подгруппами внутри основной группы. Для обоснованного выбора статистических методов исходные массивы данных проверялись на нормальность распределения по критериям Д’Агостино и Шапиро–Уилка. При условии нормального распределения различия между выборками оценивали с помощью непарного двустороннего метода Стьюдента. Описательную статистику нормально распределенных данных приводили как среднее арифметическое (М) и стандартное отклонение (SD) в формате М (SD).
Целью корреляционного анализа был поиск возможных функциональных взаимосвязей между различными клинико-лабораторными показателями, которые могли бы выявить изменения молекулярного и/или клеточного состава крови, обусловливающие отклонения изучаемых показателей гемостаза от нормы. С учетом симметричного распределения данных, корреляционный анализ проводили по методу Пирсона. Результаты представлены как r (a/b), где r – коэффициент линейной корреляции Пирсона; a и b – соответственно нижняя и верхняя границы 95% доверительного интервала (ДИ) для коэффициента корреляции, рассчитанного с использованием он-лайн-сервиса [18]. Уровень статистической значимости (уровень значимости р) при всех типах анализа был равен 0,05. Для расчетов применяли статистический программный пакет GraphPad Prism 7.
Результаты
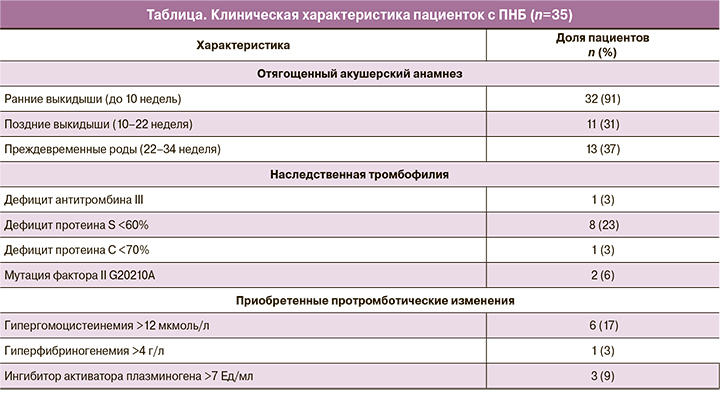
По сравнению с контрольной группой, у пациенток основной группы, по данным тромбодинамики, выявлены статистически значимые различия, а именно: более высокие средние значения начальной и стационарной скорости роста сгустка, а также размера сгустка, хотя и в пределах референсных значений, что в совокупности свидетельствует об относительной гиперкоагуляции уже на этапе планирования беременности (рис. 1). Следует оговориться, что метод тромбодинамики является интегральным тестом, который позволяет получить информацию об общем свертывающем потенциале без расшифровки механизмов нарушений этого потенциала.
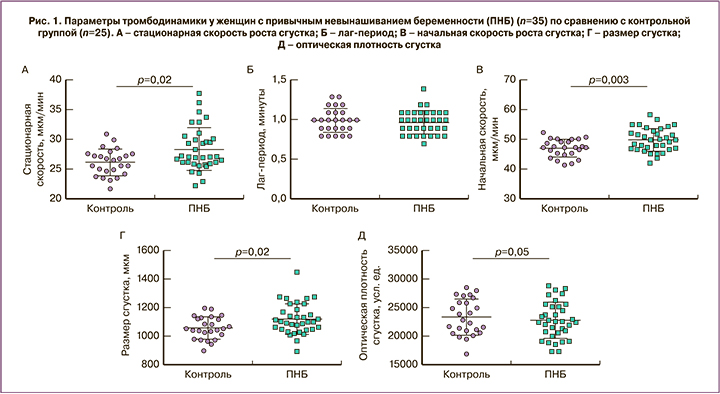
При сравнении контракции сгустка крови обнаружено статистически значимое снижение параметров контракции у пациенток основной группы по сравнению с контрольной (рис. 2). Об этом свидетельствует торможение всех стадий процесса контракции: снижение средней степени и скорости контракции, площади под кинетической кривой, а также удлинение лаг-периода. Чтобы выявить возможные механизмы снижения контракции сгустка крови у женщин с ПНБ, параметры контракции были сопоставлены с результатами тромбодинамики и других лабораторных исследований.
Корреляционный анализ параметров тромбодинамики и рутинных лабораторных тестов в обеих исследуемых группах обнаружил следующие статистически значимые ассоциации. Выявлена положительная корреляция плотности сгустка с уровнем фибриногена [r=0,72 (0,61/0,84); p=0,001], с уровнями D-димера [r=0,32 (0,07/0,53); p=0,04], плазминогена [r=0,56 (0,36/0,71); p<0,001] и отрицательная корреляция с тромбиновым временем [r=-0,39 (-0,59/-0,15); p=0,01]. Начальная скорость роста сгустка отрицательно коррелировала с АЧТВ [r=-0,38 (-0,58/-0,14); p=0,01], уровнем протеина С [r=-0,28 (-0,5/-0,03); p=0,02], протромбиновым временем [r=-0,33 (-0,54/-0,08); p=0,01] и уровнем гематокрита [r=-0,50 (-0,67/-0,28); p=0,01]. Стационарная скорость роста сгустка отрицательно коррелировала с АЧТВ [r=-0,32 (-0,53/-0,07); p=0,02], уровнем протеина С [r=-0,35 (-0,55/-0,11); p=0,01] и уровнем гематокрита [r=-0,44 (-0,62/-0,21); p=0,01]. Размер сгустка находился в обратной связи с уровнем протеина С [r=-0,30 (-0,51/-0,05); p=0,05], АЧТВ [r=-0,36 (-0,56/-0,12); p=0,02], протромбиновым временем [r=-0,32 (-0,53/-0,07); p=0,02] и гематокритом [r= -0,40 (-0,59/-0,16); p=0,04]. Лаг-период отрицательно коррелировал с протромбиновым индексом [r= -0,27 (-0,49/-0,02); p=0,05] и гематокритом [r=-0,44 (-0,62/-0,21); p=0,01]. Эти результаты подтверждают валидность теста тромбодинамики как интегрального метода изучения состояния гемостаза, который чувствителен к гиперкоагулемическим состояниям, в том числе у пациенток с ПНБ.
Корреляционный анализ показателей контракции кровяного сгустка и гемокоагуляции выявил статистически значимую положительную корреляцию АЧТВ со степенью [r=0,26 (0,01/0,48); p=0,02] и средней скоростью [r=0,26 (-0,01/0,48); p=0,02] контракции, а также положительную корреляцию между уровнем ингибитора активатора плазминогена со степенью [r=0,43 (0,2/0,62); p=0,05] и скоростью [r=0,43 (0,2/0,62); p=0,05] контракции. При сопоставлении показателей контракции сгустков крови и гематологических показателей обнаружена ожидаемая прямая корреляция между уровнем тромбоцитов со степенью [r=0,31 (0,04/0,54); p=0,03] и скоростью [r=0,31 (0,05/0,52); p=0,02] контракции, а также с площадью под кинетической кривой [r=0,30 (0,05/0,51); p=0,04]. Кроме того, была выявлена положительная корреляция между средней концентрацией гемоглобина со степенью [r=0,36 (0,12/0,56); p<0,001] и скоростью [r=0,35 (0,11/0,55); p<0,001] контракции, а также площадью под кинетической кривой контракции [r=0,38 (0,14/0,58); p<0,001]. Лаг-период отрицательно коррелировал с индексом распределения тромбоцитов [r=-0,43 (-0,62/-0,2); p<0,001], средним объемом эритроцитов [r=-0,35 (-0,55/-0,11); p=0,01], средним содержанием гемоглобина [r=-0,43 (-0,62/-0,2); p=0,01] и положительно коррелировал с индексом распределения эритроцитов [r=0,39 (0,15/0,59); p<0,001]. Эти результаты указывают на информативность теста кинетики контракции сгустков крови как показателя системы гемостаза, значение которого выходит за рамки показателя функционального состояния тромбоцитов.
Установлено, что у женщин с тремя и более потерями беременности наблюдается более выраженная гиперкоагуляция по сравнению с пациентками, которые потеряли одну или две беременности (средняя стационарная скорость роста сгустка 30,3 (3,6) и 27,6 (3,4) мкм/мин, p=0,05; размеры сгустка 1174 (99) и 1100 (107) мкм, p=0,05 соответственно). При этом у пациенток первой подгруппы скорость роста сгустка выходит за пределы референсных значений и смещается в зону патологической гиперкоагуляции. Показатели контракции сгустков также претерпели статистически значимые изменения в подгруппе пациенток с 3 и более потерями беременности. Так, средние значения степени контракции – 32 (9)% против 39 (11)%; p=0,05, скорости контракции – 0,026 (0,007)%/с против 0,032 (0,008)%/с; p=0,04, площади под кинетической кривой – 215 (65) усл. ед. против 273 (92) усл. ед.; p=0,04 – были статистически значимо снижены по сравнению с пациентками, которые потеряли одну или две беременности. Напротив, средний лаг-период контракции был статистически значимо удлинен у женщин с тремя и более выкидышами в анамнезе – 283 (110) с против 252 (120) с; p=0,05. Таким образом, увеличение числа выкидышей прямо связано с выраженностью фоновой гиперкоагуляции по показателям тромбодинамики, а также с нарушениями контракции сгустка крови. Эти результаты подтверждают важную патогенетическую роль нарушений в плазменном и тромбоцитарном звеньях гемостаза в генезе репродуктивных нарушений у женщин с многократными потерями беременности.
При анализе показателей тромбодинамики и контракции сгустка у пациенток основной группы в зависимости от срока потери беременности выявлено статистически значимое снижение средней степени контракции сгустка – 34 (9)% против 40 (10)%; p=0,05 и удлинение лаг-периода контракции – 305 (131) с против 213 (98) с; p=0,03 у пациенток, потерявших беременность на сроках после 10 недель, по сравнению с пациентками, которые имели выкидыши на более ранних сроках. По показателям тромбодинамики, статистически значимых различий в зависимости от срока потери беременности не выявлено.
Обсуждение
В основе ПНБ могут лежать самые разные этиологические и патогенетические факторы и механизмы, такие как хромосомные аномалии, анатомические, эндокринные и иммунные дефекты или инфекции, хотя во многих конкретных случаях причины ПНБ остаются неясными [19–22]. Нормальная беременность характеризуется гемостатическим балансом, который предупреждает образование фибрина в сосудах плаценты и в межворсинчатом пространстве [23] Однако при нарушении гемостатического баланса в сторону гиперкоагулемии и тромбофилии возникает высокий риск невынашивания беременности [24]. Среди причин протромботических состояний при беременности – повышение активности фактора VIII, снижение уровня PAI-1, генетические полиморфизмы, антифосфолипидный синдром, снижение уровня физиологических антикоагулянтов, изменение фибринолитической активности и другие [7, 8, 20, 25, 26].
Данное исследование посвящено изучению протромботического потенциала у женщин с ПНБ с использованием методов определения тромбодинамики и контракции сгустка крови. Есть основания считать, что, наряду с другими причинами, повторный выкидыш является следствием патологической гиперкоагуляции во время беременности, которая приводит к микротромбозу сосудов хориона или плаценты и, в конечном итоге, к выкидышу или преждевременным родам [27], причем превалируют ранние выкидыши [22]. Это может быть обусловлено меньшим количеством плацентарных и маточных сосудов, которые частично или полностью окклюзируются в результате микротромбоза без компенсации кровотока за счет коллатерального кровообращения [28, 29].
Клинические исследования тромбодинамики и контракции сгустков крови при ПНБ ранее не проводились. Основные результаты данного исследования состоят в том, что в крови пациентов с ПНБ в анамнезе наблюдаются склонность к длительной, персистирующей гиперкоагуляции по данным тромбодинамики, а также существенное снижение способности сгустка к контракции по сравнению с показателями здоровых женщин. Гиперкоагуляция и снижение контракции при ПНБ согласуются с повышением уровня фибриногена и D-димера, а также с повышенным образованием в крови РФМК [30, 31]. Помимо этого, по литературным данным, у пациентов с ПНБ наблюдаются повреждение сосудистого эндотелия и повышенная экспрессия тканевого фактора, что может усугубить патологическую гиперкоагуляцию [32].
Снижение контракции сгустков крови свидетельствует о дисфункции тромбоцитов у пациенток с ПНБ вследствие длительной гиперактивации клеток на фоне гиперкоагуляции и тромбинемии [13, 33]. Это предположение согласуется с данными литературы о высоком уровне фоновой, или «спонтанной», активации тромбоцитов у пациенток с двумя и более выкидышами в анамнезе [34]. Важно подчеркнуть, что снижение суммарной сократительной функции тромбоцитов у пациентов с ПНБ происходит, несмотря на статистически значимое повышение числа тромбоцитов в крови, по сравнению с контрольной группой – 264 (81) × 109/л против 225 (32) × 109/л; p=0,02.
У пациенток с ПНБ, которые имели в анамнезе более двух выкидышей, нарушения контракции и тромбодинамики более выражены, чем у пациенток с одним–двумя выкидышами в анамнезе. Это согласуется с данными литературы [28, 29]. Наряду с числом выкидышей имеют значение сроки потери беременности. По нашим данным, при наличии поздних выкидышей степень контракции снижается больше, чем при наличии только ранних выкидышей. Возможно, что потеря беременности на поздних сроках (после 10 недель) в значительной степени обусловлена нарушениями в системе гемостаза, в то время как ранние потери плода (до 10 недель), как правило, сопряжены с другими патогенетическими факторами (генетическими, эндокринными и гинекологическими), не связанными с протромботическим статусом [35, 36].
Полученные результаты в сочетании с данными литературы указывают на то, что в патогенезе ПНБ важная роль принадлежит врожденным и приобретенным нарушениям гемостаза, которые выявляются тестами тромбодинамики и кинетики контракции сгустков крови. Указанные сдвиги являются следствием изменений состава крови, обусловливающих длительную гиперкоагуляцию, а также дисфункцией тромбоцитов, включая сократительную функцию, что ведет к нарушению контракции, т.е. механического ремоделирования сгустков крови и микротромбов. Совокупность указанных нарушений может приводить к микроциркуляторным нарушениям плацентарного кровообращения и, как следствие, к прерыванию беременности. Полученные результаты указывают на то, что исследования тромбодинамики и контракции сгустков крови могут служить лабораторным критерием состояния системы гемостаза до и во время беременности для оценки степени риска и ранней диагностики акушерских осложнений.
Заключение
Обнаружено статистически значимое увеличение скорости роста и размера сгустка по данным тромбодинамики, а также статистически значимое снижение параметров контракции сгустка крови у пациентов с ПНБ в анамнезе, по сравнению со здоровыми донорами, что в совокупности указывает на гиперкоагуляцию и предрасположенность к тромбозам. У пациенток с тремя и более потерями беременности наблюдается статистически значимая более выраженная гиперкоагуляция и более отчетливые изменения контракции, по сравнению с пациентками, которые потеряли одну или две беременности. Полученные данные указывают на возможность использования тромбодинамики и контракции сгустков крови у женщин с невынашиванием беременности в анамнезе в качестве диагностических и прогностических тестов с целью определения риска потери беременности.



