В настоящее время преэклампсия (ПЭ) остается глобальной нерешенной проблемой акушерства, сохраняя свои лидирующие позиции среди причин материнской и перинатальной заболеваемости и смертности во всем мире [1, 2]. Изменения существующих диагностических критериев ПЭ, поиск новых прогностических показателей указывают на отсутствие четких этиопатогенетических представлений о механизмах развития данного осложнения гестации, в связи с чем ПЭ является до конца неясной клинической категорией. Рассматривая общеклинический подход к артериальной гипертензии (АГ), необходимо отметить, что в современных рекомендациях ПЭ относится к осложненному гипертоническому кризу [3]. При этом повышенное АД имеет выраженную взаимосвязь с дисметаболическими нарушениями, рассматриваемыми многими авторами в качестве ведущего механизма развития эссенциальной АГ [4, 5]. Данный факт подтверждается тем, что АГ является одним из ведущих признаков метаболического синдрома (МС), активное изучение которого обусловлено его высокой распространенностью [4, 6]. Так, к существующим критериям МС (IDF, 2005) относятся: окружность талии >94 см у мужчин и >80 см у женщин, уровень АД >130/85 мм рт.ст. или антигипертензивная терапия, содержание триглицеридов (ТГ) крови ≥1,7 ммоль/л или специфическое лечение дислипидемии, уровень липопротеидов высокой плотности (ЛПВП) <1,03 ммоль/л у мужчин и <1,29 ммоль/л у женщин, содержание глюкозы в капиллярной крови натощак ≥5,6 ммоль/л или выявленный сахарный диабет 2 типа [7]. Углубление знаний и поиск «платинового» стандарта диагностики МС привели к тому, что в качестве его дополнительных признаков стали рассматривать: высокий уровень свободных жирных кислот, гиперлептинемию, лептинорезистентность, микроальбуминурию/протеинурию, синдром обструктивного апноэ сна, гиперурикемию, провоспалительный и протромботический статусы, оксидативный стресс, эндотелиальную дисфункцию, синдром поликистозных яичников и гиперандрогению у женщин [7, 8]. Диабетогенные (патологическая инсулинорезистентность (ИР), хроническая гиперинсулинемия (ГИ)) и атерогенные нарушения признаются большинством авторов в качестве ведущих механизмов развития МС [8, 9]. Важно, что при беременности отмечаются схожие метаболические изменения в ответ на действие контринсулярных факторов плаценты, направленные на энергопластическое обеспечение развивающегося плода [10, 11]. При этом срыв механизмов гестационной адаптации, возникающий на фоне факторов риска (соматическая, инфекционная, аутоиммунная патология, гормональные, метаболические, эпигенетические нарушения, генные девиации, стресс, вредные привычки, экологические факторы и др.), приводит к усугублению заложенных в беременности изменений и развитию ее осложнений.
Цель исследования: провести клинико-лабораторные параллели у беременных с ПЭ без соматической патологии и с МС для выделения общих клинико-патогенетических закономерностей.
Материалы и методы
На базе Самарского областного перинатального центра в 2016–2019 гг. проведено комплексное клинико-лабораторное обследование 201 беременной женщины. В I группу сравнения вошли 89 женщин с ПЭ, имеющих факторы высокого риска (отягощенный ПЭ акушерский анамнез – 51,7% (46/89) женщин; отягощенный ПЭ семейный анамнез – 40,4% (36/89) беременных; первобеременные позднего репродуктивного возраста (после 35 лет) – 7,9% (7/89) наблюдений); во II группу – 50 женщин с ПЭ на фоне МС; в III группу – 32 беременные с МС без реализации ПЭ; в IV (контрольную) группу вошли 30 здоровых беременных с физиологическим течением гестации. Критериями включения в I группу выступали: наличие ПЭ, отмечаемые до беременности индекс массы тела 18,5–24,9 кг/м2, уровень АД <130/85 мм рт.ст., отсутствие метаболических нарушений по данным обследования на догестационном этапе, зарегистрированным в медицинской документации. Критерии включения во II и III группы: диагностированные до беременности критерии МС (обязательный признак – окружность талии >80 см и 2 дополнительных – содержание ТГ в крови >1,7 ммоль/л, уровень ЛПВП в крови <1,29 ммоль/л, АД ≥130/85 мм рт.ст.); ранний репродуктивный возраст; сохраненные менструальный и овуляторный яичниковый циклы, спонтанная беременность. Важно отметить, что догестационный уровень глюкозы венозной крови у женщин с МС был <6,1 ммоль/л, что позволило ограничить влияние существующей гипергликемии на процессы гестационной перестройки. Критериями исключения для всех групп являлись: нарушения углеводного обмена до беременности, гестационный сахарный диабет, тяжелая соматическая (кроме МС во II и III группах), инфекционная и аутоиммунная патология, аномалии половых органов, синдром поликистозных яичников, беременность после вспомогательных репродуктивных технологий, врожденная патология плода. Женщины II и III групп не имели статистически значимых различий по критериям МС.
Клинико-лабораторная оценка беременных групп сравнения проводилась в сроке гестации 30–36 недель, женщины I и II групп обследованы в указанные сроки при реализации ПЭ. Учитывая схожесть критериальной диады ПЭ с критериями МС (АГ, протеинурия/микроальбуминурия), в группах исследования нами изучены дополнительные клинические признаки (суточный профиль АД, эпизоды сонного апноэ, субъективная оценка характеристик сна, характер распределения жировой ткани), особенности которых описаны при МС вне беременности [4, 7, 12]. Суточная вариабельность АД является важным хронобиологическим параметром и подразделяется на следующие типы: dipper (норма) – снижение АД в ночное время на 10–20%, over-dipper – снижение >20%, non-dipper – снижение АД на 0–10%, nigh-picker – повышение АД в ночное время, причем для МС характерны два последних варианта [13]. Эпизоды сонного апноэ выступают признаком синдрома обструктивного апноэ сна – отдельного клинико-патогенетического варианта МС – и играют важную роль в развитии АГ (гипоксия, выброс стрессовых гормонов и окислительный стресс в ночное время) [14]. Наличие инсомнии (дневная сонливость, плохое качество сна, частые пробуждения и негативные сновидения) оценивалось при помощи анкеты Я.И. Левина (1995). Нормой является количество баллов >22, пограничный уровень – 19–21 баллов, инсомния – 18 баллов и менее [15]. Учитывая важность висцерального жира при развитии МС, ультразвуковым методом оценивали локусы распределения жировой ткани (K. Tayama et al., 1999): толщину подкожного (тПКЖ) и преперитонеального (тППЖ) жира с расчетом индекса жира брюшной стенки (ИЖБС=тППЖ/тПКЖ), значение которого >1,0 свидетельствует о висцеральном типе жироотложения [16].
Лабораторное обследование охватывало основные направления патогенетических изменений при МС и ПЭ. У всех женщин определялись метаболические (глюкоза венозной плазмы, индекс ИР (HOMA-IR) [17], мочевая кислота, общий холестерин (ОХ), ТГ, ЛПВП в сыворотке, отношение ТГ/ЛПВП) и гормональные (инсулин, лептин, плацентарный лактоген (ПЛ), кортизол) показатели, маркеры провоспалительного (фактор некроза опухоли (ФНО)-α, С-реактивный белок, количество лейкоцитов, индекс активации лейкоцитов (ИАЛ) [18]) и протромботического (количество тромбоцитов, средний объем тромбоцита, агрегация тромбоцитов с коллагеном) статусов, эндотелиальной дисфункции (метаболиты оксида азота, циркулирующие эндотелиальные клетки (ЦЭК), фибронектин (ФН)), плацентарный альфа-1-микроглобулин (ПАМГ-1) и фактор роста плаценты (ФРП). Лабораторно-инструментальная диагностика проведена с применением биохимического анализатора Architect c4000 (Abbott, США), гематологического анализатора Sysmex XN-1000 (Sysmex Corporation, Япония), лазерного анализатора агрегации тромбоцитов АЛАТ-2 ООО НПФ «Биола», ультразвуковой системы Voluson E6 GE Healthcare (Австрия). Степень тяжести плацентарной недостаточности оценивалась согласно классификации А.Н. Стрижакова и соавт. (2014) [19]. Диагноз ПЭ устанавливался в соответствии с критериями ВОЗ, утвержденными Минздравом Российской Федерации (2011).
Статистический анализ
Статистический анализ данных выполнен на базе специализированного программного обеспечения IBM SPSS Statistics 25 HC IMAGO 5.0, лицензия № 5725-А54. Нормальность распределения значений показателей оценена по критериям Колмогорова–Смирнова с поправкой Лиллиефорса и Шапиро–Уилка. При нормальном распределении признака определяли среднюю арифметическую (М) и стандартное отклонение (SD), статистическая значимость оценивалась однофакторным дисперсионным анализом (ANOVA). Расчет медианы (Me) с межквартильным интервалом [Q1 (25%); Q3 (75%)], критерия U Манна–Уитни с поправкой Бонферрони выполнялся при непараметрическом распределении показателей. Для сравнения качественных признаков применяли критерий χ² Пирсона, при размерности таблицы сопряженности 2 на 2 – χ² Пирсона с поправкой Йетса. Корреляционный анализ Спирмена использовался для выявления взаимосвязей. За критическое значение уровня статистической значимости принимали <0,05. При использовании поправки Бонферрони для попарного сравнения 4 групп число пар сравнений равно 6, и новый критический уровень соответствовал р<0,008.
Результаты и обсуждение
Проведенный анализ медико-социального портрета беременных (возраст, паритет, семейное положение, условия и район проживания, профессиональная принадлежность) не выявил статистически значимых различий в исследуемых группах (р>0,05). Характер осложнений гестации у женщин сравниваемых групп представлен в таблице 1. У женщин с МС отмечено более частое формирование ранних осложнений гестации по сравнению с I группой, достигающее статистических различий при сочетании МС и ПЭ (ранний токсикоз среднетяжелый – χ²=5,53; р=0,01; угроза прерывания беременности – χ²=6,80; р=0,009), что указывает на важную роль периконцепционных изменений при МС в развитии данных осложнений. Хроническая плацентарная недостаточность II–III степени встречалась в I, II и III группах соответственно в 34,8, 36,0 и 28,1% наблюдений (χ²I-II=0,02, рI-II=0,89; χ²I-III=0,48, рI-III=0,49; χ²II-III=0,55; рII-III=0,46), причем в I и II группах частота плацентарной недостаточности IIБ, IIВ и III степени тяжести выше в 4,7 и 5,2 раза соответственно по сравнению с III группой (χ²I-III=5,75, рI-III=0,02; χ²II-III=6,1, рII-III=0,01), что свидетельствует о формировании при ПЭ более тяжелых форм хронической плацентарной недостаточности.

Ранняя ПЭ была диагностирована в сроке 30–34 недель беременности и составила 34,8% (31/89) и 44,0% (22/50), поздняя ПЭ (после 34 недель) – 65,2% (58/89) и 56,0% (28/50) наблюдений соответственно I и II группам (χ²=1,14; р=0,29). Частота реализации ПЭ в зависимости от степени тяжести в I и II группах составила: умеренная ПЭ – 62,9% (56/89) и 60,0% (30/50), тяжелая ПЭ – 37,1% (33/89) и 40,0 (20/50) наблюдений соответственно (χ²=0,12; р=0,73). Следовательно, по срокам манифестации и степени тяжести ПЭ беременные I группы с ПЭ без соматической патологии и II группы с ПЭ на фоне МС были схожи. При этом уровни АД и протеинурии как при умеренной, так и при тяжелой ПЭ были статистически значимо выше у женщин с ПЭ на фоне МС, чем в I группе. Так, соответственно I и II группам: при умеренной ПЭ систолическое АД соответствовало 148 [143;152] и 156 [151;158] мм рт. ст., диастолическое АД – 97 [94;101] и 105 [100;108] мм рт.ст., среднее АД – 109 [105;114] и 120 [115;124] мм рт.ст.; протеинурия в разовой порции мочи – 1,58 [0,94;2,05] и 2,48 [2,07;2,89] г/л, протеинурия в суточном количестве мочи – 0,99 [0,58;1,42] и 2,05 [1,74;2,41] г/сут; при тяжелой ПЭ систолическое АД составило 172 [165;180] и 189 [181;200] мм рт. ст., диастолическое АД – 120 [115;125] и 128 [124;133] мм рт.ст., среднее АД – 125 [122;130] и 138 [132;144] мм рт.ст., протеинурия в разовой порции мочи – 3,74 [3,25;4,20] и 4,77 [4,35;5,53] г/л, протеинурия в суточном количестве мочи – 3,86 [2,56;4,50] и 4,83 [3,86;5,57] г/сут (для всех показателей р=0,01). У всех беременных с ПЭ уровни систолического и диастолического АД соответствовали критериям тяжести развившейся патологии и выступали определяющими.
Прослеживающаяся клиническая схожесть МС и ПЭ по основным критериальным признакам дополнена выявленными у беременных с ПЭ особенностями суточной вариабельности АД, характеристик сна, распределения жировой ткани, свойственных МС (табл. 2). Патологические типы суточной вариабельности АД с недостаточным снижением (non-dipper) или повышением (night-picker) АД в ночное время выявлены у 53,9, 60,0 и 40,6% женщин в I, II и III группах (χ²=2,98; р=0,23). Формирование АГ и патологического суточного профиля АД имеет связь с эпизодами синдрома обструктивного апноэ сна [5, 14, 20]. Условным аналогом данного синдрома при беременности выступает «гестационное» сонное апноэ: 53,9, 66,0, 37,5% наблюдений соответственно в I, II и III группах (χ²I-II=1,92, рI-II=0,17; χ²I-III=2,54, рI-III=0,11; χ²II-III=6,40, рII-III=0,01). Связь между патологическим суточным профилем АГ и «гестационным» сонным апноэ подтверждена наличием средней силы и сильной положительной ассоциативной связи (для non-dipper r=0,75 при р<0,05; для night-picker r=0,84 при р<0,001), что отражает схожесть механизмов формирования данных клинических проявлений при ПЭ и МС. Анализ субъективной оценки характеристик сна показал, что количество баллов <22 набрали 60,7% женщин в I группе, 66% – во II группе и 40,6% беременных в III группе (χ²I-II=0,39, рI-II=0,53; χ²I-III=3,83, pI-III=0,05; χ²II-III=5,10, pII-III=0,02), что отражает сходство нарушений сна при ПЭ и МС.

Висцеральное ожирение выступает ведущим критерием диагностики МС и главным пусковым механизмом патофизиологических изменений [6, 21, 22]. Оценка распределения жировой ткани в группах сравнения показала, что у беременных с ПЭ без соматической патологии, не имевших на догестационном этапе избыточной массы тела, тППЖ (висцерального) более чем в 2 раза превышает значение контроля (р<0,001) и приближается к уровню в III группе (р=0,78). В дополнение ИЖБС в I, II и III группах составил 1,6 [1,5;1,7], 1,4 [1,3;1,6], 1,0 [0,9;1,1] соответственно (рI-II=0,04; pI-III<0,001; pII-III<0,001), чем подтверждаются общие закономерности в распределении жировой ткани как при МС, так и при ПЭ без соматической патологии – с преобладанием висцерального жира.
Значения лабораторных показателей, отражающих патогенетические особенности МС и ПЭ, представлены в таблице 3. Показано, что характерные для МС патологические ИР и ГИ имеют место и при ПЭ без соматической патологии, причем уровни инсулина и HOMA-IR в I группе статистически значимо выше по сравнению с беременными с МС без ПЭ и контролем (р<0,001). Это указывает на то, что существующие в рамках «нормы беременности» физиологическая ИР и компенсаторная ГИ приобретают патологический характер при формировании ПЭ [10]. Уровень глюкозы у беременных не выходил за границы нормы, что определяется критериями включения в исследование и исключения из него.

Формирование ИР при беременности направлено на выполнение важнейшей эволюционной функции – обеспечение роста и развития плода путем перенаправления к нему энергетических и пластических субстратов, в частности глюкозы [10, 11]. В то же время при физиологической гестации у беременных IV группы отмечено нарастание атерогенных фракций липидного профиля, выступающих альтернативными источниками энергии для материнского организма в условиях ограничения поступления глюкозы на фоне ИР. При развитии ПЭ уровни ОХ, ТГ, отношение ТГ/ЛПВП статистически значимо превышают (р<0,001), а уровень ЛПВП статистически значимо ниже уровня контроля (р<0,001), что дополнительно потенцирует формирование патологических ИР и ГИ. Следовательно, у беременных с ПЭ, наряду с патологическими ИР и ГИ, отмечаются выраженные атерогенные нарушения, являющиеся также критериями МС, что указывает на схожесть патофизиологических изменений при данных патологиях.
Рассматривая пусковой механизм перечисленных диабетогенных и атерогенных нарушений, можно провести аналогию между МС и ПЭ. Большинство исследователей сходятся во мнении, что при МС ведущая пусковая роль отводится висцеральной жировой ткани [6, 16, 21]. В то же время при беременности схожим органом, обладающим колоссальным секреторным потенциалом, является плацента, контринсулярная активность которой направлена на энергообеспечение плода. У женщин с ПЭ без соматической патологии и ПЭ на фоне МС концентрация ПЛ – главного контринсулярного плацентарного гормона имела схожую направленность и статистически значимо превышала уровни в III и IV группах (p<0,001), что подчеркивает вовлеченность данного показателя в патогенез ПЭ через формирование патологических ИР и ГИ. Концентрация ПАМГ-1 также имела наибольшие значения в I и II группах (pI-III, pI-IV, pII-III, pII-IV<0,001). Указанный пептид, отражающий состояние материнской части плаценты, синтезируется клетками децидуальной оболочки и регулирует активность инсулиноподобного фактора роста. Повышенная концентрация ПАМГ-1 у беременных с ПЭ избыточно блокирует инсулиноподобный фактор роста, способствуя формированию патологических ИР и ГИ. Широко известно участие гиперлептинемии и лептинорезистентности в механизмах развития гиперсимпатикотонии и АГ, провоспалительного статуса, патологических ИР и ГИ при МС [23]. Важно отметить, что беременность сопровождается дополнительной активацией синтеза лептина в плаценте и молочных железах [6, 23]. В группах с ПЭ без соматической патологии и ПЭ на фоне МС уровень данного гормона статистически не различался (р=0,65), однако значимо превышал показатели у женщин с МС без ПЭ и в контроле (pI-III, pI-IV, pII-III, pII-IV<0,001), что отражает участие гиперлептинемии в патогенезе ПЭ. В развитии патологических ИР и ГИ также принимает участие кортизол – неспецифический стрессовый гормон с выраженным контринсулярным эффектом [8, 9]. Уровень кортизола в I, II, III группах был статистически значимо выше, чем в контроле (pI-IV, pII-IV, pIII-IV<0,001). Повышение указанных контринсулярных гормонов, синтезируемых плацентой, у беременных с ПЭ подтверждает роль данного провизорного органа в качестве пускового механизма патологической ИР.
Гиперурикемия относится к одному из дополнительных признаков МС [7]. Нами отмечено статистически значимое повышение уровня мочевой кислоты в группах с ПЭ и с МС (pI-IV, pII-IV, pIII-IV<0,001), что в очередной раз отражает схожесть лабораторных изменений при МС и ПЭ.
Неотъемлемой частью МС выступает хроническое низкоинтенсивное системное метавоспаление. При МС жировая ткань выступает источником ФНО-α – ведущего воспалительного цитокина и медиатора ИР [24]. У беременных с ПЭ и с МС выявлено преобладание ФНО-α по сравнению с контролем (pI-IV, pII-IV<0,001, pIII-IV=0,03), причем в группах с ПЭ без соматической патологии и ПЭ на фоне МС уровень показателя имел однонаправленное изменение и был выше, чем в группе с МС без ПЭ (pI-III, pII-III<0,001). Следовательно, описанная патогенетическая связь ФНО-α с диабетогенными и атерогенными нарушениями, активацией лейкоцитов, эндотелиальной дисфункцией аналогично реализуется при МС и ПЭ. Анализ С-реактивного белка, как наиболее распространенного маркера воспаления, показал схожие с ФНО-α изменения параметра. Повышенные уровни лейкоцитарных показателей в I, II, III группах также свидетельствуют о формировании иммунометаболических нарушений при ПЭ и МС. Протромботический статус у беременных с ПЭ и МС подтверждается более низкими значениями общего количества тромбоцитов вследствие усиления их потребления (pI-IV, pII-IV <0,001, pIII-IV=0,56), увеличением среднего объема клетки за счет молодых и активированных форм (pI-IV, pII-IV, pIII-IV<0,001), увеличением агрегационной активности тромбоцитов (pI-IV, pII-IV, pIII-IV<0,001), что также имеет место при МС вне беременности [8, 22]. Полученные данные о снижении ФРП – плацентарного белка из семейства сосудистого эндотелиального фактора роста у беременных с ПЭ и с МС, дополняемые литературными данными о дефиците сосудистого эндотелиального фактора роста при МС вне беременности [25], отражают схожесть антиангиогенных изменений при МС и ПЭ.
Вышеописанные показатели через связанные с патологическими ИР и ГИ механизмы вызывают структурно-функциональную дестабилизацию и гибель эндотелиоцитов сосудов, что приводит к клинической реализации АГ, протеинурии и полиорганной недостаточности [8, 26]. Это подтверждается выраженным снижением метаболитов оксида азота (важнейшего вазодилататора, синтезируемого эндотелием сосудов), повышением количества ЦЭК и ФН, выделяемого при слущивании эндотелиоцитов, у беременных I, II и III групп по сравнению с контролем, причем указанные изменения находят отражение и при МС вне беременности [9, 26].
 Реализация патологии при наличии предрасполагающих факторов риска и направленных изменений гомеостаза является индивидуальным процессом. На наш взгляд, отсутствие развития ПЭ в III группе беременных с МС можно объяснить существующей клинической вариабельностью проявлений МС, критерии которого предусматривают наличие/отсутствие АГ, сахарного диабета 2 типа, гиперурикемии с подагрическими проявлениями, клинической картины гиперандрогении и тромбогенного состояния. Отсутствие реализации ПЭ у беременных с МС может быть связано с длительным сохранением резервных возможностей механизмов адаптации и ауторегуляции («норма компенсированной патологии») без срыва в патологический процесс при отсутствии экспрессии характерных генных девиаций и эпигенетических нарушений [2, 6, 8, 11]. Согласно полученным данным, у беременных III группы с МС без клинической реализации ПЭ контринсулярная активность плаценты соответствует уровню плацентарной контринсулярной активности физиологической беременности (ПЛ 7,9 [6,5;9,1] мг/мл против 7,4 [6,2;8,7] мг/мл; p=0,27), что указывает на отсутствие дополнительной стимуляции наряду с жировой тканью патологической ИР плацентарными факторами. Анализ количества тромбоцитов и уровня ФН как интегративных клинически значимых показателей эндотелиальной дисфункции и протромбогенного состояния не показал статистически значимых различий между беременными III и контрольной групп, что свидетельствует об отсутствии избыточного потребления тромбоцитов, выраженного повреждения сосудистого эндотелия и уровня протромбогенного статуса, характерных для беременных с ПЭ. Следовательно, реализация ПЭ при МС обусловлена индивидуальными особенностями, связанными с наличием/отсутствием факторов высокого риска и степенью выраженности изменений метаболического, воспалительного, оксидативного, протромботического, антиангиогенного характера.
Реализация патологии при наличии предрасполагающих факторов риска и направленных изменений гомеостаза является индивидуальным процессом. На наш взгляд, отсутствие развития ПЭ в III группе беременных с МС можно объяснить существующей клинической вариабельностью проявлений МС, критерии которого предусматривают наличие/отсутствие АГ, сахарного диабета 2 типа, гиперурикемии с подагрическими проявлениями, клинической картины гиперандрогении и тромбогенного состояния. Отсутствие реализации ПЭ у беременных с МС может быть связано с длительным сохранением резервных возможностей механизмов адаптации и ауторегуляции («норма компенсированной патологии») без срыва в патологический процесс при отсутствии экспрессии характерных генных девиаций и эпигенетических нарушений [2, 6, 8, 11]. Согласно полученным данным, у беременных III группы с МС без клинической реализации ПЭ контринсулярная активность плаценты соответствует уровню плацентарной контринсулярной активности физиологической беременности (ПЛ 7,9 [6,5;9,1] мг/мл против 7,4 [6,2;8,7] мг/мл; p=0,27), что указывает на отсутствие дополнительной стимуляции наряду с жировой тканью патологической ИР плацентарными факторами. Анализ количества тромбоцитов и уровня ФН как интегративных клинически значимых показателей эндотелиальной дисфункции и протромбогенного состояния не показал статистически значимых различий между беременными III и контрольной групп, что свидетельствует об отсутствии избыточного потребления тромбоцитов, выраженного повреждения сосудистого эндотелия и уровня протромбогенного статуса, характерных для беременных с ПЭ. Следовательно, реализация ПЭ при МС обусловлена индивидуальными особенностями, связанными с наличием/отсутствием факторов высокого риска и степенью выраженности изменений метаболического, воспалительного, оксидативного, протромботического, антиангиогенного характера.
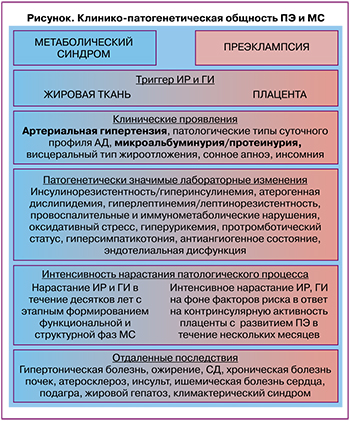
Выявленные клинические и лабораторные параллели между МС и ПЭ схематично отражены на рисунке.
Заключение
Прослеживающуюся клиническую схожесть ПЭ и МС, заключающуюся в формировании АГ и протеинурии/микроальбуминурии в качестве критериальных признаков, убедительно доказывают и дополняют результаты проведенного исследования, согласно которым у беременных с ПЭ без соматической патологии выявлены клинические проявления, характерные для МС вне беременности: патологические типы суточной вариабельности АД (non-dipper, night-picker), висцеральный тип жироотложения, эпизоды сонного апноэ, инсомния.
Клинические проявления МС и ПЭ выступают лишь верхушкой айсберга сложнейших патофизиологических нарушений, исследование которых позволило доказать, что выявленная общность ПЭ и МС обусловлена схожими патогенетическими механизмами развития, представленными патологическими ИР, ГИ и ассоциированными с ними дислипидемией атерогенного характера, гиперлептинемией и лептинорезистентностью, гиперурикемией, провоспалительными и иммунометаболическими нарушениями, оксидативным стрессом, протромботическим статусом, гиперсимпатикотонией, антиангиогенным состоянием, эндотелиальной дисфункцией.
Доказанное единство клинико-патогенетических закономерностей ПЭ и МС открывает принципиально новые подходы к изучению патогенеза, разработке методов прогнозирования и профилактики, ранней диагностики и лечения ПЭ, что позволит улучшить гестационные и перинатальные исходы при данном осложнении гестации, а также оптимизировать последствия отдаленных осложнений, связанных с высоким риском сердечно-сосудистой патологии.



