Успешная профилактика пороков развития плода (ПРП) основана: на 1) санации очагов хронической инфекции, 2) исключении курения, алкоголя, вредных производственных факторов, 3) адекватном двигательном режиме, 4) поддержании положительного психоэмоционального фона и, конечно же, 5) обеспечении организма беременной всеми макро- и микронутриентами, необходимыми для оптимального развития плода. Использование специализированных витаминно-минеральных комплексов (ВМК) – наиболее рациональный способ нутрициальной поддержки беременности.
Для эффективной профилактики ПРП необходимо преодоление повсеместно распространенных полигиповитаминозов, т.е. сочетанных дефицитов многих витаминов. Дефициты цинка, железа, йода, селена, витаминов А, Е, D, С и практически любого из витаминов группы В, в том числе фолатов (В9), пиридоксина (В6) и цианокобаламина (В12), чрезвычайно опасны, так как способствуют возникновению патологий беременности и ПРП [1]. Поэтому ВМК для поддержки беременности должен включать максимально расширенную «линейку» витаминов и микроэлементов в адекватных дозах. Кроме того, используемые субстанции микронутриентов должны характеризоваться хорошими фармакокинетическими показателями, в том числе высокой биодоступностью [2].
Фолаты являются одним из важнейших витаминов для профилактики ПРП. Именно фолаты обеспечивают: 1) метилирование ДНК, 2) синтез пуриновых и пиримидиновых оснований, 3) синтез аминокислот (метионина, серина, гистидина) и белков, 4) синтез холина, 5) обезвреживание гомоцистеина. Участие фолатов в метилировании ДНК и синтезе нуклеотида тимина принципиально важно для митоза (процесса клеточного деления). Поэтому при добавлении фолатов к культуре клеток отмечается стимуляция роста и деления клеток, а в организме фолаты стимулируют пластические процессы во всех тканях, особенно в тканях с быстрым циклом обновления клеток (кровь, эпителий ЖКТ, паренхима печени и др.) [3].
Общеизвестно, что дефицит фолатов в плазме крови приводит к патологиям беременности и порокам развития. Особенно ярко эффекты дефицита фолатов проявляются при наличии факторов риска фолатного дефицита (пиелонефрит, тромбофилия, артериальная гипертония, ожирение, прием фолатвыводящих лекарств, потребление алкоголя, курение и др.). Дефицит фолатов нарушает биосинтез S-аденозилметионина, необходимого для метилирования ДНК растущих клеток. В результате дефицит фолатов приводит к нарушению процессов роста и развития клеток и формированию дефектов эмбриона (в частности, врожденных пороков сердца, дефектов нервной трубки (ДНТ), дефектов формирования неба, так называемой «волчьей пасти», «заячьей губы» и др.), а также расстройств аутистического спектра и синдрома дефицита внимания с гиперактивностью [4].
Компенсация дефицита фолатов может осуществляться посредством фолиевой кислоты, биологически активных форм фолатов (дигидрофолат (ДГФ), тетрагидрофолат (ТГФ), 5-метилтетрагидрофолат (5-МТГФ) и др.) и комбинаций фолиевой кислоты и активных фолатов. Как показано далее, повсеместная распространенность дефицитов фолатов в различных популяциях, существование определенных вариантов генов фолатного метаболизма, влияющих на усвоение фолиевой кислоты, воздействия на уровни гомоцистеина, различия в метаболизме фолиевой кислоты и 5-МГТФ, дозозависимые фармакокинетические и фармакодинамические особенности фолиевой кислоты и активных фолатов диктуют необходимость их сочетанного применения.
Результаты исследований обеспеченности фолатами различных популяций
Дефицит диетарного потребления фолатов широко распространен даже в западных странах. Исследование когорты женщин в Канаде (n=35107) показало, что только 18% женщин репродуктивного возраста потребляли 400 мкг/сут фолиевой кислоты [5]. По данным комитета EFSA Евросоюза [6], во многих европейских странах уровни потребления фолатов с пищей оставляют желать лучшего: суточное потребление фолатов составляет менее 75% от минимально допустимого для здоровых женщин (400 мкг/сут) и не более 40–50% от оптимального уровня потребления (600–800 мкг/сут).
Результаты анализа базы данных ИМБД (база данных Института микроэлементов) на предмет обеспеченности витаминами когорты женщин репродуктивного возраста из России и стран западной Европы (n=2141, 20–45 лет) показал, что в таком, казалось бы, «обеспеченном» регионе, как современная западная Европа, потребление определенных витаминов не всегда достигает даже минимально рекомендуемых норм суточного потребления. Например, витамина В6 потребляется в среднем 1,6 мг/сут (при норме 2 мг/сут), фолатов – 375 мкг/сут (с учетом витаминных препаратов с фолиевой кислотой) при норме 400 мкг/сут, а витамина Е – 6,2 мг/сут при норме 15 мг/сут. Также отмечено недостаточное потребление женщинами репродуктивного возраста магния, калия, кальция и железа не только в РФ, но и западной Европе (хотя и в меньшей степени). Более того, одновременно всеми рассмотренными эссенциальными микронутриентами было обеспечено менее 10% (!) участниц. Следует отметить, что диета обследованных характеризуется избыточным потреблением натрия (3,06 г/сут при норме 1,3 г/сут) и фосфора (1,19 г/сут при норме 0,8 г/сут) [7].
По данным исследования [7], обеспеченность россиянок фолатами существенно ниже, чем в западной Европе (только 15%, западная Европа – 35%). Тем не менее большинство женщин и в западной Европе были недостаточно обеспечены фолатами для профилактики ПРП: средние уровни фолатов в эритроцитах составили всего 628±284 нмоль/л, тогда как для эффективной профилактики необходимы уровни не менее 906 нмоль/л. При этом процент участниц из западной Европы, у которых уровни фолатов (в эритроцитах) превышали 906 нмоль/л, составил всего 13%. Таким образом, диета, даже в «обеспеченных» западных странах, заведомо не предоставляет количества фолатов, необходимого для эффективной профилактики ПРП.
Исследование [7] также показало, что нормализация уровней фолатов в эритроцитах при беременности и лактации достигалась именно за счет приема специальных ВМК для беременных, содержащих фолаты в дозировках не менее 400 мкг/сут. Вклад приема таких ВМК в уровни фолатов в эритроцитах составил +193 нмоль/л (р=0,035). В то же время вклад только диеты в уровни фолатов в эритроцитах составил всего +42 нмоль/л, что не являлось даже статистически достоверным (р=0,21) [7]. Сопоставимые результаты были получены и в других крупномасштабных популяционных исследованиях [8, 9].
Полиморфизмы генов фолатного метаболизма, усвоение фолиевой кислоты и 5-МТГФ
Помимо недостаточного потребления и всасывания, к дефициту фолатов могут приводить определенные варианты нуклеотидных полиморфизмов генов фолатного обмена (MTHFR, DHFR, MTRR, TYMS, MTFHD1 и др.) [10], которые влияют на биотрансформации фолиевой кислоты. Поэтому компенсация фолатного дефицита только с использованием фолиевой кислоты не всегда успешна, так как фолиевая кислота должна преобразоваться в организме в активные формы фолатов (ДГФ, ТГФ, 5-МТГФ и др.).
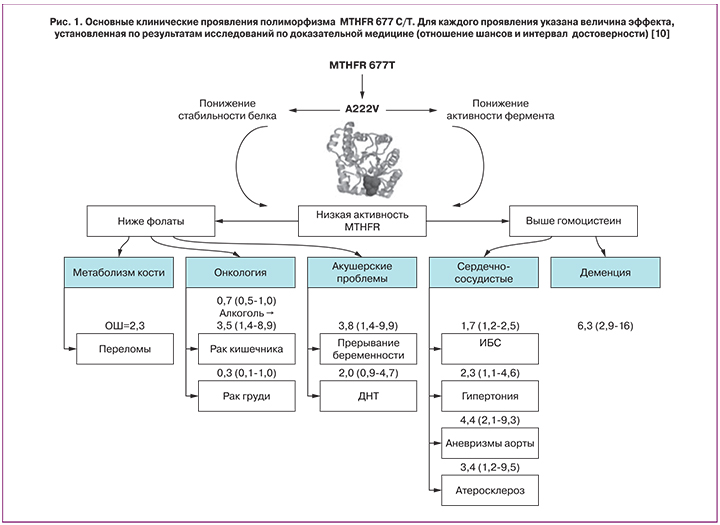
Систематический анализ нуклеотидных полиморфизмов, влияющих на усвоение фолиевой кислоты, представляет собой отдельное направление исследований. Одним из наиболее подробно исследованных генетических полиморфизмов является полиморфизм 677CàT 5,10-метилентетрагидрофолатредуктазы (ген MTHFR). Замена нуклеотида «С» в 677-й позиции кодирующей ДНК на нуклеотид «Т» приводит к образованию «термолабильной» (низкостабильной) формы фермента и способствует снижению уровней активных фолатов. Более чем за 30 лет исследований было установлено, что этот полиморфизм был достоверно ассоциирован с широким кругом патологий (рис. 1) [10].
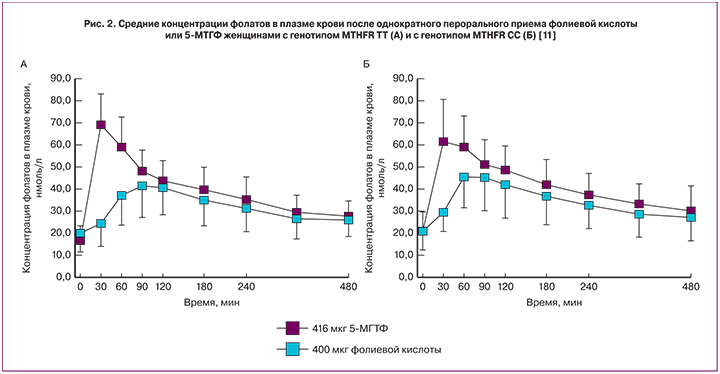
При приеме per os 5-МТГФ повышает уровни фолатов в плазме крови более эффективно, чем фолиевая кислота. При этом всасывание 5-МТГФ в малой степени зависит от генотипа полиморфизма MTHFR 677CàT. Здоровые женщины-добровольцы (генотип MTHFR TT, n=16; генотип MTHFR CC, n=8) принимали фолиевую кислоту (400 мкг, т.е. 906 нмоль) или 5-МТГФ (416 мкг, т.е. 906 нмоль) однократно per os. Площадь под кривой (AUC) и максимальная концентрация (Cmax) были значительно выше в случае приема 5-МТГФ. Время достижения пика концентрации (tmax) было значительно короче также для 5-МТГФ по сравнению с фолиевой кислотой (рис. 2) [11].
Фолаты в терапии гипергомоцистеинемии
Как известно, гомоцистеин является побочным продуктом фолатного метаболизма, требующим дальнейшего обезвреживания. При дефиците фолатов или при наличии у пациентки тех или иных неблагоприятных вариантов генов метаболизма фолатов уровни гомоцистеина в плазме крови возрастают. Поэтому гипергомоцистеинемия – известный биомаркер дефицита фолатов, требующий неотложной компенсации фолатного дефицита.
Повышенные уровни гомоцистеина во время беременности стимулируют развитие спонтанных абортов, преэклампсии, венозной тромбоэмболии и других патологий. Гипергомоцистеинемия встречается у женщин с так называемым «необъяснимым» бесплодием (21±8 мкМ, n=20) и с «привычным» невынашиванием (19±6 мкМ, n=20); у здоровых пациенток уровни гомоцистеина плазмы ниже (8±3 мкМ, р<0,05) [12]. Повышение концентраций гомоцистеина и метионина в крови и снижение отношения восстановленный:окисленный глутатион – информативные предикторы рождения ребенка с пороком сердца [13].
Клинические исследования указали на существование минимальной дозы фолиевой кислоты, необходимой для достоверного снижения концентраций гомоцистеина в крови. В рандомизированном исследовании дозозависимого эффекта фолиевой кислоты на уровни гомоцистеина в плазме крови (n=316) участники в течение 12 недель ежедневно получали фолиевую кислоту в дозировках 50, 100, 200, 400, 600 или 800 мкг/сут. В результате было установлено, что потребление фолиевой кислоты в дозировке 392 мкг/сут является минимальной дозой фолатов, при которой отмечается достоверное снижение уровней гомоцистеина в среднем на 22% [14].
Дозозависимые эффекты фолиевой кислоты на концентрацию гомоцистеина в крови были подтверждены в метаанализе 25 рандомизированных контролируемых исследований (n=2596). Потребление фолиевой кислоты в дозах 200, 400, 800, 2000 и 5000 мкг/сут было связано со снижением гомоцистеина на 13 (95% ДИ 10%–16%), 20 (17–22%), 23 (21–26%), 23 (20–26%) и 25% (22–28%) соответственно. Дополнение фолиевой кислоты витамином B12 приводило к дополнительному снижению гомоцистеина на 7% (95% ДИ 4–9%) [15]. Таким образом, доза фолатов порядка 400–800 мкг/сут является достаточно эффективным способом лечения гипергомоцистеинемии, а увеличение дозы 2000 мкг/сут, 5000 мкг/сут достоверно не приводило к повышению эффективности (р=0,001).
Прием фолиевой кислоты в дозах 500 мкг/сут и более может нарушать внутриклеточный обмен эндогенных фолатов. Например, в двойном слепом исследовании группа добровольцев (n=50) была рандомизирована на получение фолиевой кислоты (500 мкг/сут, 8 недель) или плацебо. Фолиевая кислота значительно снижала уровень гомоцистеина в плазме (р=0,001), но не внутри мононуклеарных клеток периферической крови. Более того, без дотаций фолиевой кислоты концентрации гомоцистеина внутри клеток коррелировали с концентрациями S-аденозилметионина (SAM), а после курсового приема фолиевой кислоты корреляция между гомоцистеином и SAM в клетках не была установлена. Последнее наблюдение указывает на то, что фолиевая кислота в дозе 500 мкг/сут начинает вмешиваться в процесс регуляции фермента MTHFR регуляторным метаболитом SAM [16].
Различия в метаболизме фолиевой кислоты и 5-МТГФ
Фолиевая кислота, будучи фолатом растительного происхождения, не является эндогенным фолатом и должна пройти определенные биотрансформации в организме беременной. Эти биотрансформации фолиевой кислоты подразумевают взаимодействия с определенными белками протеома. Анализ протеома человека указал на существование не менее 20 белков, так или иначе взаимодействующих с фолатами [19]. К ним относятся прежде всего ферменты метаболизма фолатов (метилентетрагидрофолатредуктаза, метионин-синтаза-редуктаза, метилентетрагидрофолатциклогидролаза, дигидрофолатсинтаза и др.), фолат-транспортеры (гены FOLR1, FOLR2, FOLR3, SLC19A1, MFTC), обеспечивающие поступление фолатов внутрь клетки, тимидилат синтетаза и др. (рис. 3).
Не являясь эндогенным метаболитом, фолиевая кислота перерабатывается в организме достаточно медленно. Поэтому передозировка фолиевой кислоты (возникающая зачастую в результате употребления так называемых «фортифицированных» продуктов или высокодозных препаратов синтетической фолиевой кислоты по 5000–1500 мкг/сут) перегружает и без того замедленные метаболические пути переработки фолатов. При этом происходит блокировка некоторых белков фолатного метаболизма, что вызывает физиологический дефицит эндогенных фолатов (так называемый «фолиевый парадокс»).
В частности, избыток фолиевой кислоты будет перегружать и блокировать фолат-транспортеры, осуществляющие приток активных фолатов внутрь клеток. ДГФ, накапливающийся при избыточном дозировании фолиевой кислоты, является ингибитором тимидилат синтетазы (TYMS), производящей тимидилатмонофосфат (ТМФ) для использования в синтезе ДНК и РНК и также ингибитором метилентетрагидрофолатредуктазы (MTHFR), опосредующей взаимопревращение 5-метил-ТГФ и 5,10-метилен-ТГФ. Ингибирование этого фермента при избытке фолиевой кислоты имеет эффект, биохимически схожий с эффектом обсуждаемого ранее полиморфизма 677 С/Т в гене MTHFR и соответствует ослаблению интенсивности биотрансформаций в цикле фолатов.
Избыток фолиевой кислоты может вызывать подавление синтеза молочно-фолатсвязывающего белка (FBP). В группе кормящих женщин (n=69) концентрации FBP были значительно ниже в результате обогащения пищи фолиевой кислотой. Неметаболизированная фолиевая кислота была обнаружена в 96% протестированных образцов молока [17]. Следует подчеркнуть, что так называемая «фортификация» продуктов питания синтетической фолиевой кислотой является сомнительной практикой, не имеющей четких положительных эффектов, но создающей риск неоправданно повышенного потребления фолиевой кислоты [18].
В отличие от фолиевой кислоты и ДГФ, избыток которых приводит к блокированию фолатного метаболизма, такой активный фолат, как 5-МТГФ не тормозит фолатный метаболизм. Поэтому 5-МТГФ, экзогенно поступающий в организм беременной в адекватных дозировках, не имеет побочных эффектов, характерных для избыточного потребления фолиевой кислоты (от 1000 мкг/сут и более). Кроме того, 5-МГТФ эффективно восполняет дефицит фолатов при любом генотипе ферментных систем биотрансформаций фолатов [19].
Курсовой прием 5-МТГФ позволяет достигать более высоких концентраций фолатов в крови, чем фолиевая кислота (в среднем на +200 нмоль/л). Беременные (n=72) принимали фолиевую кислоту (1000 мкг/сут) в течение всего срока гестации. После родов группа женщин была рандомизирована на прием 5-МТГФ (416 мкг/сут, 906 нмоль/сут), фолиевой кислоты (400 мкг/сут, 906 нмоль/сут) или плацебо. Через 16 недель лактации суммарная концентрация фолатов в эритроцитах у женщин в группе принимавших 5-МТГФ (2178 нмоль/л; 95% ДИ 1854–2559 нмоль/л) была выше, чем в группе принимавших фолиевую кислоту (1967 нмоль/л; 95% ДИ 1628–2377 нмоль/л; p<0,05) или значительно выше, чем в группе плацебо (1390 нмоль/л, 95% ДИ 1198–1613 нмоль/л; p<0,002) [20].
В исследовании [20] профили концентраций отдельных форм фолатов в крови различались между группами: в группе женщин, принимавших фолиевую кислоту, установлено достоверно более высокое количество 5-формил-ТГФ (p<0,03). Нарастание уровней 5-формил-ТГФ в ответ на прием фолиевой кислоты ассоциировано с недостаточностью витамина B12. При недостаточности витамина B12 резко снижена активность фермента метионинсинтазы, участвующего в биосинтезе S-аденозилметионина, необходимого для метилирования ДНК. Физиологически избыточная фолиевая кислота может производить ТГФ в обход метионинсинтазы, через ДГФ. При этом, однако, и будет происходить наблюдаемое накопление 5-формил-ТГФ. Таким образом, при восполнении недостаточности витамина В12 применение и фолиевой кислоты (в надлежащих дозах, не более 500 мкг/сут [16]), и 5-МТГФ будут приводить к близким профилям содержания различных фолатов в крови.
Дозозависимость эффектов приема фолиевой кислоты и 5-МГТФ
 В сравнительно краткосрочных исследованиях (менее 40 недель приема) использование дозировок фолиевой кислоты не более 400 мкг/сут не позволяет достичь стабильных концентраций фолатов в эритроцитах. Например, было проведено сравнение приема фолиевой кислоты в дозах 140 мкг/сут (n=49) и 400 мкг/сут (n=48) женщинами детородного возраста в течение 40 нед. В качестве конечной точки использовали достижение уровней фолатов в эритроцитах более 906 нмоль/л. В конце исследования прием фолиевой кислоты в дозе 400 мкг/сут приводил к меньшей частоте встречаемости пациенток с субоптимальными уровнями фолатов в эритроцитах (т.е. менее 906 нмоль/л: 400 мкг/сут – 18%, 140 мкг/сут – 35%). В группе плацебо субоптимальные уровни фолатов составили 58% как на начало, так и в конце исследования [21]. Тем не менее не только при приеме 140 мкг/сут, но и при приеме 400 мкг/сут фолиевой кислоты уровни фолатов в эритроцитах не достигли плато насыщения у всех пациенток даже к 40-й неделе приема.
В сравнительно краткосрочных исследованиях (менее 40 недель приема) использование дозировок фолиевой кислоты не более 400 мкг/сут не позволяет достичь стабильных концентраций фолатов в эритроцитах. Например, было проведено сравнение приема фолиевой кислоты в дозах 140 мкг/сут (n=49) и 400 мкг/сут (n=48) женщинами детородного возраста в течение 40 нед. В качестве конечной точки использовали достижение уровней фолатов в эритроцитах более 906 нмоль/л. В конце исследования прием фолиевой кислоты в дозе 400 мкг/сут приводил к меньшей частоте встречаемости пациенток с субоптимальными уровнями фолатов в эритроцитах (т.е. менее 906 нмоль/л: 400 мкг/сут – 18%, 140 мкг/сут – 35%). В группе плацебо субоптимальные уровни фолатов составили 58% как на начало, так и в конце исследования [21]. Тем не менее не только при приеме 140 мкг/сут, но и при приеме 400 мкг/сут фолиевой кислоты уровни фолатов в эритроцитах не достигли плато насыщения у всех пациенток даже к 40-й неделе приема.
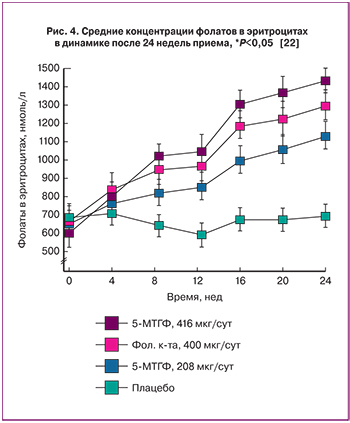
Прием 5-МТГФ женщинами детородного возраста способствует более выраженному насыщению фолатами эритроцитов. Здоровые добровольцы в возрасте 19–33 лет (n=144) получали 400 мкг/сут фолиевой кислоты, эквимолярное количество 5-МТГФ (416 мкг/сут), половинное количество 5-МТГФ (208 мкг/сут) или плацебо в течение 24 недель. Уровни фолатов в эритроцитах были достоверно выше в группе получавших 5-МТГФ (p<0,001). При этом насыщение эритроцитов фолатами (участок плато на кривой, рис. 4) было достигнуто спустя 16 недель приема 5-МТГФ [22].
О взаимосвязи дозировки, фармакокинетики и фармакодинамики сочетаний фолиевой кислоты и 5-МГТФ
Фолиевая кислота – провитамин, из которого синтезируются активные формы фолатов. Биотрансформации фолиевой кислоты включают несколько этапов, прохождение которых требует определенного времени (2–5 ч) [23]. При поступлении в организм фолиевая кислота преобразуется в несколько этапов. Сначала происходит преобразование фолиевой кислоты в ДГФ посредством присоединения двух атомов водорода. Затем из ДГФ образуется наиболее типичная эндогенная форма фолатов – ТГФ. В дальнейшем преобразования ТГФ включают синтез 5-МТГФ (рис. 5) и синтез 5,10-метилен-ТГФ посредством фермента серингидроксиметилтрансферазы (ген SHMT1), коферментом которого является пиридоксаль фосфат – одна из активных форм витамина В6.
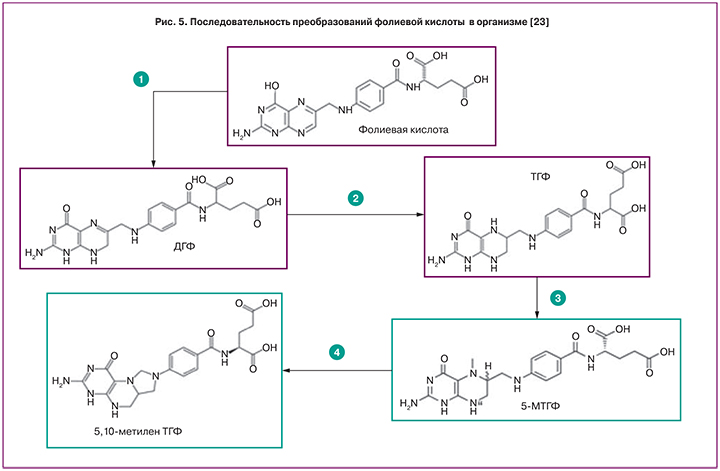
Таким образом, экзогенно поступающая фолиевая кислота постепенно преобразуется в организме, проходя стадии ДГФ, ТГФ, 5-МТГФ и др. В то же время экзогенно поступающий 5-МТГФ не требует прохождения по крайней мере трех стадий метаболизма фолатов, так что пик концентраций фолатов в плазме крови достигается быстрее именно при приеме 5-МГТФ.
Соответственно, основное преимущество сочетанного использования фолиевой кислоты и 5-МТГФ состоит в том, что такая смесь фолатов способствует поддержанию более стабильных концентраций фолатов в крови. Сначала формируется пик, вызванный 5-МГТФ, в то время как фолиевая кислота только начинает претерпевать описанные выше биотрансформации. Затем формируется пик, обусловленный нарастанием активных форм фолатов, синтезированных из фолиевой кислоты.
С фармакодинамической точки зрения, взаимодействие между фолиевой кислотой и активными фолатами в организме беременной существенно зависит от используемых доз. Как было показано в предыдущих разделах, избыток фолиевой кислоты может блокировать биотрансформации фолатов и вызывать «фолиевый парадокс» [1], тем самым нивелируя фармакокинетический синергизм фолиевой кислоты и 5-МТГФ [2]. Однако такого рода эффекты наблюдаются при дозировках фолиевой кислоты начиная с 500 мкг/сут (см. приведенный ранее пример с нарушением внутриклеточного обмена эндогенных фолатов [16]).
Заключение
Сочетание фолиевой кислоты и 5-МТГФ фармакокинетически выгодно. При соблюдении дозировок фолиевой кислоты не более 400 мкг/сут такое сочетание не порождает неблагоприятных фармакодинамических взаимодействий, связанных с ингибированием метаболизма эндогенных фолатов. Поэтому при использовании 200 мкг/сут фолиевой кислоты и 200 мкг/сут 5-МТГФ в составе Прегнотон Мама фолиевая кислота ни в коей мере не будет угнетать метаболизм эндогенных фолатов или 5-МТГФ, а наоборот, будет способствовать поддержанию более стабильных уровней фолатов в крови.



