Бактериальный вагиноз (БВ) как пограничное состояние микробиоценоза влагалища – одно из самых распространенных инфекционных заболеваний полового тракта женщин. Его определяют как инфекционный невоспалительный синдром, сопровождающийся чрезмерно высокой концентрацией облигатных и факультативно-анаэробных условно-патогенных микроорганизмов во влагалище при резком снижении количества – вплоть до полного исчезновения – молочнокислых бактерий (лактобактерий) [1].
Доля БВ среди всех вульвовагинальных инфекций составляет, по данным разных авторов, от 16 до 65% (столь высокий разброс обусловлен в первую очередь этническими различиями, а также экологическими факторами). В ряде отечественных и зарубежных исследований было показано, что частота этого заболевания во многом зависит от контингента обследуемых женщин: 17–19% – в группах планирования семьи, 24–37% – среди больных венерическими заболеваниями, 61–87% – у пациенток с патологическими белями. Кроме того, нарушение биоценоза влагалища обнаруживают у 37–42,4% беременных. Считается, что в современном мире каждая женщина хотя бы один раз в жизни имела БВ [2].
Наличие БВ сопряжено с тяжелыми инфекционновоспалительными заболеваниями в акушерскогинекологической практике. В гинекологии БВ ассоциирован с инфекционными осложнениями после гистерэктомии и некоторых других гинекологических операций, абортов [3, 4, 5]; воспалительных заболеваний органов малого таза (ВЗОМТ); тазовых абсцессов при установке внутриматочных контрацептивов; перитонита [6, 7]. В подавляющем большинстве случаев БВ не угрожает жизни, но очевидно, что ухудшаются показатели качества жизни женщины, рецидивы заболевания являются причиной формирования специфических психосоматических заболеваний и трудноразрешимых внутрисемейных проблем. Все это заставляет отнестись к данной патологии с повышенным вниманием.
Доказано, что БВ может быть причиной различных нарушений течения беременности (в том числе его ассоциируют с преждевременными родами), послеродовых осложнений, гистологически связан с подтвержденным хориоамнионитом, инфицированием раневой поверхности после операции кесарева сечения, послеродовым эндометритом, манифестацией других инфекций, передающихся половым путем (ИППП), как во время беременности, так и в ее отсутствие [1]. В метаанализе было продемонстрировано повышение в 1,5 раза относительного риска ВПЧ-инфекции, а следовательно, развития неоплазии шейки матки у женщин [8]. БВ часто ассоциирован с повышенной восприимчивостью к заболеваниям, передающимся половым путем, особенно к генитальному герпесу и ВИЧ [9, 10].
В связи с выраженной распространенностью БВ особую важность приобретает проблема его лечения. По причине того, что условно-патогенные микроорганизмы могут входить в состав нормальной микрофлоры влагалища, конечной целью лечения БВ является восстановление нормальных показателей микроэкосистемы влагалища, предотвращающих избыточную колонизацию этих микроорганизмов. В настоящее время в России принята двухэтапная схема терапии БВ: первый этап – антибактериальный (применяются антибиотики для подавления чрезмерной колонизации условно-патогенной микрофлоры), второй этап подразумевает применение пробиотиков (для восстановления нормобиоценоза влагалища) [2].
Обусловленные в последние годы процессами глобализации острые проблемы распространения и лечения инфекционных заболеваний были восприняты мировым сообществом как существенная угроза, для ликвидации которой были приняты положения «Политической декларации заседания высокого уровня Генеральной Ассамблеи по проблеме устойчивости к противомикробным препаратам» [11]. В соответствии с этими положениями проводится поиск способов сохранения эффективности имеющихся антибиотиков, в том числе путем создания условий повышения чувствительности патогенов к антимикробным веществам [12]. В последнее время отмечается тенденция к увеличению антибактериальной резистентности условно-патогенной микрофлоры, наиболее часто являющейся этиологической причиной БВ (Gardnerella vaginalis, Prevotella bivia). В некоторых проведенных исследованиях было выявлено формирование резистентности этих бактерий к антибиотикам первой линии для лечения БВ (метронидазол, клиндамицин) до 80% случаев [13, 14]. Это и данные о том, что дефицит нормальной микрофлоры обуславливает низкую результативность антимикробной терапии [15], стало причиной изучения влияния лактобацилл как представителей нормальной микрофлоры женского репродуктивного тракта на антибиотикорезистентность. При этом в исследованиях in vitro и in vivo был обнаружен феномен потенцирования действия антибиотиков метаболитами не только нормальной микрофлоры, но и пробиотического штамма Lactobacillus casei subsp. rhamnosus (LCR), входящего в состав лекарственного препарата «Лактожиналь» [16, 17]. Это открывает перспективы повышения эффективности терапии инфекционных заболеваний (БВ) за счет временного выполнения функции нормальной флоры пробиотиками на момент применения антимикробных веществ (одновременное применение антибиотика и пробиотика для лечения БВ).
Все вышеизложенное заставляет задуматься о необходимости формулировки и обсуждения нового показания для применения пробиотических препаратов с целью повышения эффективности антимикробной терапии. Пока неясно, все ли известные пробиотические штаммы подходят для применения по этому показанию. Эти штаммы должны быть как минимум устойчивы к используемым антибактериальным препаратам. При этом пробиотический штамм Lactobacillus casei subsp. rhamnosus (LCR), входящий в состав лекарственного препарата «Лактожиналь», обладает резистентностью к антибактериальным препаратам первой линии, используемым при лечении БВ (метронидазол, клиндамицин), что было показано в исследовании in vitro [18].
Кроме того, одновременное назначение антибиотика и пробиотика позволит сократить общую длительность курса лечения БВ в 1,5 раза. При использующейся рутинной схеме терапии БВ, принятой в России, курс лечения БВ составляет 14–21 день (7 дней антибактериальная терапия, затем 7–14 дней пробиотическая терапия) [2]. При совмещении антибактериального и пробиотического этапов (одновременном их применении) длительность общего курса терапии может сократиться. Сокращение продолжительности курса терапии, безусловно, повлияет на увеличение приверженности пациентов к проводимому лечению.
Таким образом, одновременное применение антибактериальной и пробиотической (лекарственным препаратом «Лактожиналь») терапии БВ позволит: 1) потенцировать действие антибиотиков метаболитами пробиотического штамма Lactobacillus casei subsp. rhamnosus (LCR), что, несомненно, является важным шагом в преодолении возрастающей антибактериальной резистентности; 2) сократить продолжительность курса лечения БВ в 1,5 раза; 3) увеличить приверженность пациентов к лечению.
Данное клиническое исследование фазы III было проведено с целью оценки эффективности и безопасности исследуемых схем терапии БВ препаратами «Лактожиналь», капсулы вагинальные («БИОС ИНДАСТРИ», Франция) и клиндамицин, крем вагинальный 2%, согласно Федеральному закону от 12.04.2010 г. №61-ФЗ «Об обращении лекарственных средств» (в последней редакции) и Руководству по экспертизе лекарственных средств (Москва, 2013).
Материалы и методы
В многоцентровом клиническом исследовании фазы III приняли участие 150 пациенток с БВ. Расчет размера выборки проводился с учетом необходимой мощности исследования 80% (бета-ошибка 20%), допустимой альфа-ошибки 5% и ожидаемой границы не меньшей эффективности в ±10,0% на основании данных ранее проведенного исследования [19–22].
В популяцию Intention-To-Treat (всех включенных в исследование) вошли 139 пациенток (1-я группа – 45, 2-я группа – 47, 3-я группа – 47), 11 пациенток были исключены из исследования в связи с несоответствием критериям включения/невключения на скрининге, в популяцию Рer Рrotocol (завершивших исследование в соответствии с протоколом) вошли 135 пациенток (1-я группа – 45, 2-я группа – 44, 3-я группа – 46), 4 пациентки выбыли из исследования после 2-го визита (с 3 пациентками был потерян контакт, у 1 пациентки был выявлен критерий невключения), рис. 1.
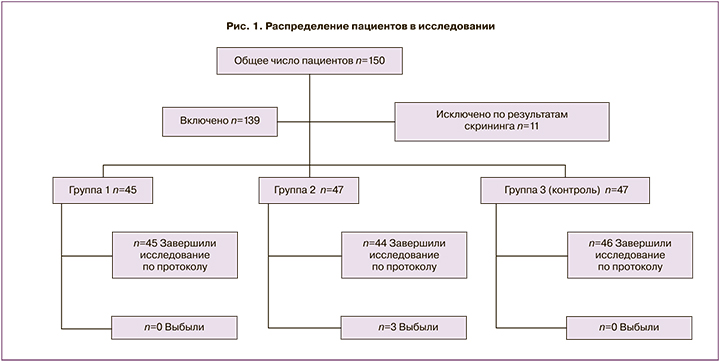
При проведении исследования соблюдались следующие критерии включения/исключения пациентов.
Критерии включения:
- женщины в возрасте 18–45 лет;
- лабораторно и клинически подтвержденный диагноз БВ:
- наличие по меньшей мере 3 из 4 признаков по критериям Амселя;
- 7–10 баллов по критериям Nugent;
- количественное молекулярно-биологическое подтверждение БВ (с помощью метода ПЦР-диагностики, например, тест-системой «Фемофлор 16») – незначительное количество или полное отсутствие лактобактерий, повышенная генерация анаэробных микроорганизмов;
- наличие по меньшей мере одного симптома БВ (обильные выделения с запахом несвежей рыбы, жжение, зуд) по оценке пациентки на скрининге;
- желание и способность подписать и датировать информационный листок пациента до включения в исследование.
Критерии исключения:
- повышенная чувствительность к любому из компонентов исследуемого препарата «Лактожиналь» и/или препарата комбинированной терапии клиндамицин;
- менструальный период в ожидаемые сроки приема исследуемого препарата «Лактожиналь» и/или препарата комбинированной терапии клиндамицин;
- использование системных или вагинальных форм антибиотиков, противогрибковых или антитрихомонадных лекарственных препаратов в период 30 дней, предшествующих скринингу;
- использование любых системных кортикостероидов, иммунодепрессантов или иммуностимуляторов в период 3 месяцев, предшествующих скринингу;
- вульвовагинальный кандидоз, любое вагинальное или вульварное состояние, способное помешать интерпретации результатов лечения;
- сахарный диабет;
- любые грибковые, бактериальные или системные вирусные инфекции в течение 30 дней до визита скрининга;
- период грудного вскармливания, беременность.
В ходе исследования было запрещено использование сопутствующей терапии: местных форм лекарственных препаратов, применяемых в области вульвы или вагины (антибиотиков, противогрибковых, антитрихомонадных или противовоспалительных препаратов); любых средств для интравагинального введения (препараты эстрогена, прогестерона, спермициды, презервативы, тампоны, противозачаточные диафрагмы, пены, пленки, кремы и т.д.); пероральных форм антибиотиков, противогрибковых или антитрихомонадных препаратов; пероральных или парентеральных форм кортикостероидов или иммунодепрессантов; других пероральных или вагинальных пробиотиков и кислот (за исключением исследуемого препарата).
Исследование состояло из 3 этапов (этап скрининга – до 3 дней, этап лечения – 7 дней (группа 2), 14 дней (группы 1 и 3), этап наблюдения – 15–24 дня) и 4 визитов пациентов (рис. 2).
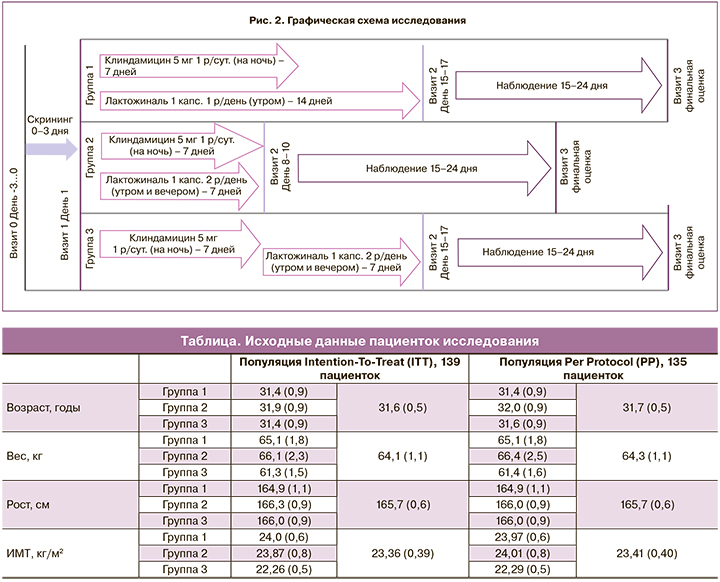
Пациентки, соответствующие всем критериям включения и не соответствующие ни одному критерию исключения, были разделены на 3 группы: 1-я группа (n=45) получала на 1-м этапе терапии клиндамицин 5 г крема интравагинально 1 раз в сутки (перед сном) и «Лактожиналь» вагинально по 1 капсуле 1 раз в день (утром) в течение 7 дней, на 2-м этапе – «Лактожиналь» вагинально по 1 капсуле 1 раз в день (утром) в течение 7 дней; 2-я группа (n=47) получала клиндамицин 5 г крема интравагинально 1 раз в сутки (перед сном) и «Лактожиналь» вагинально по 1 капсуле 2 раза в день (утром и вечером) в течение 7 дней; 3-я группа (n=47, группа сравнения) получала на 1-м этапе клиндамицин 5 г крема интравагинально 1 раз в сутки (перед сном) 7 дней, на 2-м этапе – «Лактожиналь» вагинально по 1 капсуле 2 раза в день (утром и вечером) в течение 7 дней.
В ходе исследования регистрировались демографические и антропометрические данные, медицинский и акушерско-гинекологический анамнез, клинические симптомы (выделения с запахом несвежей рыбы, жжение, зуд во влагалище), признаки БВ по критериям Амселя и Nugent, исследовалась микрофлора влагалища с помощью метода ПЦР, проводилась оценка лабораторных показателей клинического и биохимического анализов крови, а также общего анализа мочи. Также были проанализированы нежелательные явления, возникающие в течение всего периода исследования.
Главным критерием оценки эффективности проводимой терапии являлась частота достижения общего терапевтического излечения, являющаяся суммарным показателем клинической и лабораторной эффективности исследуемой терапии и определяемая как отношение количества пациенток, у которых к визиту 3 (финальная оценка) достигалось и клиническое, и лабораторное излечение к общему числу пациенток в каждой группе.
Клиническое и лабораторное излечение считалось подтвержденным только в случае соблюдения всех нижеприведенных критериев: отсутствие симптомов БВ (выделения с запахом несвежей рыбы, жжение, зуд во влагалище); наличие менее 3 из 4 признаков по критериям Амселя; менее 7 баллов по критериям Nugent; преобладание лактобактерий (≥80% Lactobacillus spp. от общей бактериальной массы) при количественном молекулярно-биологическом исследовании методом ПЦР (например, с помощью тест-системы «Фемофлор 16»), рис. 3.

Безопасность проводимой терапии оценивалась по параметрам жизненно важных показателей (артериальное давление, частота сердечных сокращений, частота дыхательных сокращений, температура тела), лабораторным исследованиям (клинический и биохимический анализы крови, анализ мочи) и оценке нежелательных явлений в течение всего периода исследования.
Статистическая обработка полученных данных была проведена с использованием пакета прикладных программ IBM SPSS Statistics 23.0. Анализ категориальных данных проводили с помощью критерия χ2 Пирсона. В качестве меры эффекта представляли разность относительных частот с 90% доверительными интервалами (90% ДИ). Статистически значимыми считали различия при р<0,05.
Результаты и их обсуждение
Анализ демографических и других исходных характеристик был проведен как для пациенток популяции Intention-To-Treat (ITT), так и для пациенток популяции Рer Рrotocol (РР) (таблица). Межгрупповое сравнение исходных данных пациенток показало отсутствие статистически значимых различий, что говорит об однородности анализируемых групп пациентов по изучаемым признакам (p>0,05).
Анализ эффективности проводился на популяции РР. В анализ безопасности были включены результаты обследований всех включенных пациентов.
В группах 1, 2 и 3 было выявлено 8 (17,8%), 7 (14,9%) и 16 (34,0%) пациенток с сопутствующими заболеваниями соответственно. Все хронические заболевания находились вне стадии обострения. При сравнительном анализе частот пациентов с сопутствующими заболеваниями не было выявлено статистически значимых различий (p>0,05), что указывает на однородность групп по данному показателю.
Оценка главного критерия эффективности (суммарный показатель и лабораторного, и клинического излечения)
К визиту 3 (финальная оценка) частота достижения общего терапевтического излечения (первичная конечная точка) у 30/45 пациентов группы 1 составила 66,7%, у 26/44 пациентов группы 2 – 59,1%, у 29/46 пациентов группы 3 – 63,0%. В результате сравнительного анализа частоты достижения общего терапевтического излечения к визиту 3 у пациентов групп 1, 2 и 3 значимых отличий не установлено (группы 1–3 p=0,717, группы 2–3 p=0,701, группы 1–2 p=0,459). Нижняя граница 90% ДИ разности частоты достижения основного показателя эффективности (общее терапевтическое излечение) между 1 и 3 группами не превысила величину границы не меньшей эффективности, установленную протоколом равной 10% на момент оценки терапии (90% ДИ -9,19% -16,44%). То есть не меньшая эффективность терапии исследуемой группы 1 по отношению к контрольной группе 3 может считаться доказанной. Нижняя граница 90% ДИ разности частоты достижения основного показателя эффективности (общее терапевтическое излечение) между 2 (59,1%) и 3 (63,0%) группами (90% ДИ -17,12% - 9,2%) составила 17,12% и превысила величину границы не меньшей эффективности, установленную протоколом равной 10% на момент оценки терапии. То есть не меньшая эффективность терапии исследуемой группы 2 по отношению к контрольной группе 3 не доказала своей эффективности.
Оценка вторичных критериев эффективности
К визиту 2 (завершение терапии) частота достижения клинического излечения у 30/45 пациентов группы 1 составила 66,7%, у 22/44 пациентов группы 2 – 50,0%, у 30/46 пациентов группы 3 – 65,2% (рис. 4). В результате сравнительного анализа частоты достижения клинического излечения к визиту 2 у пациентов групп 1, 2 и 3 значимых отличий не установлено (группы 1–3 p=0,884, группы 2–3 p=0,144, группы 1–2 p=0,111). К визиту 3 (финальная оценка) частота достижения клинического излечения у 40/45 пациентов группы 1 составила 88,9%, у 38/44 пациентов группы 2 – 86,4%, у 40/46 пациентов группы 3 – 87,0%. В результате сравнительного анализа частоты достижения клинического излечения к визиту 3 у пациентов групп 1, 2 и 3 значимых отличий не установлено (группы 1–3 p=0,777, группы 2–3 p=0,934, группы 1–2 p=0,717).
К визиту 2 (завершение терапии) частота достижения лабораторного излечения по критериям Амселя (наличие менее 3 из 4 признаков) у 40/45 пациентов группы 1 составила 88,9%, у 40/44 пациентов группы 2 – 90,9%, у 44/46 пациентов группы 3 – 95,7%. В результате сравнительного анализа частоты достижения лабораторного излечения по критериям Амселя (наличие менее 3 из 4 признаков) к визиту 2 у пациентов групп 1, 2 и 3 значимых отличий не установлено (группы 1–3 p=0,226, группы 2–3 p=0,367, группы 1–2 p=0,752). К визиту 3 (финальная оценка) частота достижения лабораторного излечения по критериям Амселя (наличие менее 3 из 4 признаков) у 43/45 пациентов группы 1 составила 95,6%, у 41/44 пациентов группы 2 – 93,2%, у 43/46 пациентов группы 3 – 93,5%. В результате сравнительного анализа частоты достижения лабораторного излечения по критериям Амселя (наличие менее 3 из 4 признаков) к визиту 3 у пациентов групп 1, 2 и 3 значимых отличий не установлено (группы 1–3 p=0,664, группы 2–3 p=0,955, группы 1–2 p=0,627).
К визиту 2 (завершение терапии) частота достижения лабораторного излечения по критериям Nugent (менее 7 баллов) у 42/45 пациентов группы 1 составила 93,3%, у 42/44 пациентов группы 2 – 95,5%, у 45/46 пациентов группы 3 – 97,8%. В результате сравнительного анализа частоты достижения лабораторного излечения по критериям Nugent (менее 7 баллов) к визиту 2 у пациентов групп 1, 2 и 3 значимых отличий не установлено (группы 1–3 p=0,296, группы 2–3 p=0,531, группы 1–2 p=0,664). К визиту 3 (финальная оценка) частота достижения лабораторного излечения по критериям Nugent (менее 7 баллов) у 43/45 пациентов группы 1 составила 95,6%, у 40/44 пациентов группы 2 – 90,9%, у 43/46 пациентов группы 3 – 93,5%. В результате сравнительного анализа частоты достижения лабораторного излечения по критериям Nugent (менее 7 баллов) к визиту 3 у пациентов групп 1, 2 и 3 значимых отличий не установлено (группы 1–3 p=0,664, группы 2–3 p=0,649, группы 1–2 p=0,382).
К визиту 2 (завершение терапии) частота достижения лабораторного излечения по ПЦР-диагностике (преобладание лактобактерий при количественном молекулярно-биологическом исследовании) у 43/45 пациентов группы 1 составила 95,5%, у 39/44 пациентов группы 2 – 87,8%, у 45/46 пациентов группы 3 – 97,8%. В результате сравнительного анализа частоты достижения лабораторного излечения по ПЦР-диагностике (преобладание лактобактерий при количественном молекулярно-биологическом исследовании) к визиту 2 у пациентов групп 1, 2 и 3 значимых отличий не установлено (группы 1–3 p=0,531, группы 2–3 p=0,066, группы 1–2 p=0,200). К визиту 3 (финальная оценка) частота достижения лабораторного излечения по ПЦР-диагностике (преобладание лактобактерий при количественном молекулярно-биологическом исследовании) у 35/45 пациентов группы 1 составила 77,8%, у 27/44 пациентов группы 2 – 61,4%, у 32/46 пациентов группы 3 – 69,6%. В результате сравнительного анализа частоты достижения лабораторного излечения по ПЦР-диагностике (преобладание лактобактерий при количественном молекулярно-биологическом исследовании) к визиту 3 у пациентов групп 1, 2 и 3 значимых отличий не установлено (группы 1–3 p=0,374, группы 2–3 p=0,413, группы 1–2 p=0,092).
Оценка безопасности
Оценку безопасности проводили для всех 150 пациенток, включенных в исследование. За весь период исследования было зарегистрировано 63 нежелательных явления (НЯ) у 29,33% (44/150) пациентов. Из наиболее частных случаев НЯ были зафиксированы боли внизу живота (9), головная боль (8) и повышение температуры тела (5). В наименьшей степени были отмечены жжение во влагалище (2), зуд в области половых губ (2), зуд и выделения из влагалища (3). Случаев серьезных НЯ в ходе исследования не зафиксировано. У пациенток всей популяции отмечалось 92,1% (58/63) НЯ легкой степени тяжести и 7,9% (5/63) НЯ средней степени тяжести. По оценке врачей-исследователей, причинно-следственная связь с терапией исследуемым препаратом/препаратом сравнения отсутствовала в 63,5% (40/63) случаев, оценивалась как сомнительная – в 11,1% (7/63) случаев, как возможная – в 23,8% (15/63) случаев, как вероятная – в 1,6% (1/63) случаев. К завершению исследования «выздоровление/прекращение НЯ» отмечалось в 95,2% (60/63) случаях, исход был неизвестен в 4,8% (3/63) случаях. В результате сравнительного анализа наличия НЯ, степени выраженности, причинно-следственной связи НЯ с терапией исследуемым препаратом и частоты исходов НЯ у пациентов в группах 1, 2 и 3 с зарегистрированными НЯ не было выявлено межгрупповых различий (p>0,05). В ходе анализа данных не обнаружено отрицательной динамики по результатам оценки витальных функций, биохимического и клинического анализа крови, клинического анализа мочи. Выявленные отклонения от нормальных значений лабораторных показателей были расценены врачами-исследователями как клинически незначимые.
Таким образом, оценка лабораторных показателей эффективности терапии во всех 3 группах сразу после окончания лечения показала численно высокие результаты и была сопоставима во всех 3 терапевтических группах, что является объективным критерием оценки эффективности терапии. Субъективная оценка частоты клинического излечения (полное отсутствие клинических симптомов) сразу после окончания терапии показала численно менее высокий результат, поскольку симптомы БВ, такие как выделения из влагалища, не являются специфичными [2].
Частота достижения лабораторного излечения по данным ПЦР-диагностики сразу после окончания терапии была достаточно высокой, что объясняется не только активным размножением собственных лактобактерий, но и наличием действующих Lactobacillus casei rhamnosus препарата «Лактожиналь» среди общей бактериальной массы. Через 2 недели после окончания терапии процент женщин с наличием более 80% лактобактерий среди общей бактериальной массы несколько снизился, это может быть объяснено тем, что микробиота влагалища без доминирования Lactobacillus встречается у 20–30% здоровых женщин [23], т.е. наличие в микробиоте влагалища менее 80% лактобактерий может являться физиологической нормой. При этом наиболее распространенным лабораторным методом диагностики являются критерии Амселя, в которых оцениваются характер и запах выделений, pH влагалищного содержимого, наличие ключевых клеток в мазке. По данному показателю эффективность лабораторного излечения была сравнимо высокой во всех трех группах как сразу после лечения, так и через 2 недели после окончания терапии.
В данном исследовании не проводилась оценка эффективности антибактериальной терапии без использования пробиотика, однако существуют научные данные, показывающие меньшую в 2 раза эффективность антибактериальной терапии препаратом клиндамицин по критериям Nugent (снижение не менее чем на 5 баллов) по сравнению с группой, получавшей «Лактожиналь» на 2-м этапе терапии, сразу после окончания курса антибиотиком [24]. На основании этих данных, а также исследований in vitro и in vivo можно предположить, что «Лактожиналь» улучшает эффективность терапии за счет восстановления колонизационной резистентности, антагонистического действия к возбудителям БВ и выработки метаболитов, по сравнению с одноэтапной антибактериальной терапией [16, 17].
Заключение
Проведенное многоцентровое клиническое исследование применения препарата «Лактожиналь», капсулы вагинальные («БИОС ИНДАСТРИ», Франция), у пациенток с БВ в сочетании с курсом антибактериальной терапии препаратом клиндамицин, крем вагинальный 2%, продемонстрировало сопоставимую эффективность двух схем применения препарата «Лактожиналь» для восстановления нормальной микрофлоры влагалища: совместного применения с первого дня антибактериальной терапии в течение 14 дней и последовательного сразу после окончания приема антибиотика. Согласно ранее действовавшей инструкции по медицинскому применению препарата «Лактожиналь», было возможно только последовательное применение препарата после курса антибактериальной терапии, в результате чего длительность общего курса терапии могла достигать 21 дня (7 дней антибиотик и 14 дней пробиотическая терапия по 1 капсуле в день). После проведенного исследования в инструкцию была внесена новая схема терапии, которая позволяет совмещение обоих этапов лечения общим курсом 14 дней (7 дней антибиотик совместно с препаратом «Лактожиналь» + 7 дней «Лактожиналь» после окончания антибиотикотерапии). Это может способствовать сокращению продолжительности общего курса лечения в 1,5 раза (14 дней против 21 дня). Совместное применение «Лактожиналя» с антибактериальной терапией клиндамицином и сокращение курса, в свою очередь, может увеличить приверженность к лечению и, следовательно, общий эффект от него. Полученные в результате этого исследования данные позволили зарегистрировать новую схему применения лекарственного препарата «Лактожиналь».



