Преждевременная недостаточность яичников (ПНЯ), определяемая как гипогонадизм в возрасте до 40 лет у женщин, ранее имевших нормальный менструальный цикл, может быть верифицирована путем получения минимум двух результатов повышенного ФСГ (> 25 МЕ/л) с интервалом в 4 недели [1]. Частота данной нозологии, по данным литературы, колеблется от 1 до 13% [2]. Одним из принципиальных моментов является создание классификации различных форм ПНЯ – классической, латентной и биохимической, позволяющей обосновать необходимость решения репродуктивных задач до полной клинической манифестации заболевания (в латентной фазе) [3].
Особое место занимает проблема сохранения и реализации репродуктивного потенциала у пациенток с ПНЯ, решение которой невозможно без репродуктивной хирургии. Инновационные возможности минимально инвазивной хирургии, направленной на восстановление репродуктивного потенциала женщин со сниженным овариальным резервом различного генеза представлены в методике группы японских исследователей [4].
Существует несколько модификаций технологии, но каждая из них не обходится без хирургического этапа – забора коркового слоя яичников с дальнейшей его фрагментацией.
Начиная с 2010 года, появляются публикации, касающиеся активации in vitro остаточных фолликулов при помощи индуцированных изменений в системе сигнальных путей, предложенной, как альтернативный донорским программам метод лечения бесплодия у пациентов с ПНЯ [4]. Изначально процедура предполагала проведение овариоэктомии с последующей криоконсервацией ткани, ее фрагментацией и двухдневной активацией in vitro (добавление в среду ингибитора PTEN и активатора PI3K-сигнальных путей). В дальнейшем производили ипсилатеральную трансплантацию фрагментированной размороженной ткани под серозную оболочку маточной трубы [5]. Дальнейшие фундаментальные исследования показали, что, сама по себе, процедура фрагментации овариальной ткани приводит к инактивации Hippo сигнального пути с последующим ростом первичных фолликулов вне всякого фармакологического воздействия, что позволило не только сократить объем операции до биопсии коры яичника, но и применять методику у пациентов с «бедным» овариальным ответом яичников на стимуляцию.
Благодаря данной модификации, испанской группой авторов было достигнуто 3 спонтанных беременности у 14 пациенток, включенных в исследование [6].
Также представлен случай беременности 32-летней пациентки с ПНЯ после хирургической активации овариальной ткани без фармакологического воздействия «drug-free in vitro activation», описанный группой авторов из Испании. В настоящее время беременность достигла срока 32 недели [7].
На сегодняшний день процедура in vitro activation одобрена и апробирована в Испании, Польше, Китае, Мексике и Японии.
Клиническое наблюдение
Больная К., 36 лет, с верифицированным диагнозом ПНЯ обратилась в ФГБУ «НМИЦ АГП им. В.И. Кулакова» для решения вопроса о возможности реализации репродуктивной функции с использованием собственных ооцитов. Менархе с 13 лет, менструации установились сразу, регулярные, по 4–5 дней, через 28 дней, умеренные, безболезненные. В последние 3 года отмечает нарушение менструального цикла по типу аменореи, в связи с чем обоснован прием заместительной гормональной терапии (эстрадиола валерат 2 мг + дидрогестерон 10 мг) в непрерывном режиме в течение указанного времени.
Было проведено полное клинико-лабораторное исследование. Базальные уровни гонадотропинов: ФСГ-114 МЕ/л, ЛГ-33,6 МЕ/л, эстрадиол – 45,3 пмоль/л, АМГ < 0,13 нг/мл.
По данным осмотра и лабораторно-инструментального обследования, в том числе ультразвукового исследования в режиме 3Д сканирования, установлен диагноз: Бесплодие. ПНЯ.
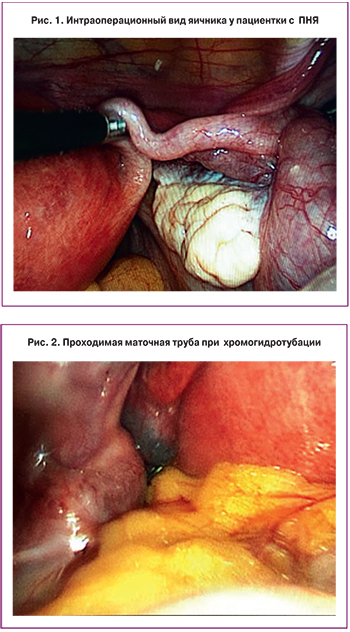
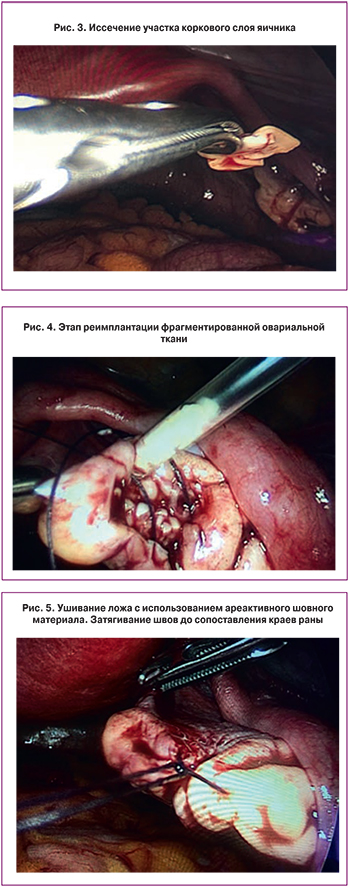 Учитывая наличие бесплодия в течение 5 лет, отсутствие эффекта от проведенного ранее лечения, резкое снижение овариального резерва, а так же настойчивое желание пациентки реализовать репродуктивную функцию с использованием собственных ооцитов, с целью оптимизации комплексного лечения бесплодия, было принято решение о проведении оперативного вмешательства в объеме: гистероскопия, биопсия эндометрия, лапароскопия, хромогидротубация, биопсия коркового слоя обоих яичников с последующей его фрагментацией и одноэтапной реимплантацией. После получения информированного добровольного согласия больной проведено оперативное вмешательство в планируемом на предоперационном этапе объеме. Интраоперационно было отмечено: яичники уменьшены в размерах (25×15×20 мм), белесовато-желтого цвета, с глубокими бороздами на поверхности, без стигм функциональной активности (без видимых фолликулов, желтых и белых тел), плотной консистенции (рис. 1), при разрезе – с минимальной васкуляризацией, утолщенной белочной оболочкой. Маточные трубы без видимых патологических изменений, фимбриальный отдел выражен. При хромогидротубации маточные трубы проходимы (рис. 2). При гистероскопии: эндометрий атрофичного типа, устья маточных труб доступны осмотру. Органы брюшной полости без видимых патологических изменений.
Учитывая наличие бесплодия в течение 5 лет, отсутствие эффекта от проведенного ранее лечения, резкое снижение овариального резерва, а так же настойчивое желание пациентки реализовать репродуктивную функцию с использованием собственных ооцитов, с целью оптимизации комплексного лечения бесплодия, было принято решение о проведении оперативного вмешательства в объеме: гистероскопия, биопсия эндометрия, лапароскопия, хромогидротубация, биопсия коркового слоя обоих яичников с последующей его фрагментацией и одноэтапной реимплантацией. После получения информированного добровольного согласия больной проведено оперативное вмешательство в планируемом на предоперационном этапе объеме. Интраоперационно было отмечено: яичники уменьшены в размерах (25×15×20 мм), белесовато-желтого цвета, с глубокими бороздами на поверхности, без стигм функциональной активности (без видимых фолликулов, желтых и белых тел), плотной консистенции (рис. 1), при разрезе – с минимальной васкуляризацией, утолщенной белочной оболочкой. Маточные трубы без видимых патологических изменений, фимбриальный отдел выражен. При хромогидротубации маточные трубы проходимы (рис. 2). При гистероскопии: эндометрий атрофичного типа, устья маточных труб доступны осмотру. Органы брюшной полости без видимых патологических изменений.
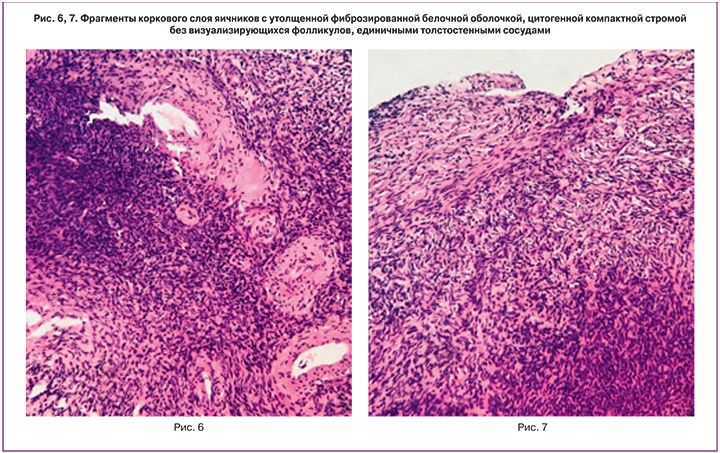
Произведено иссечение участка коркового слоя обоих яичников максимально вдоль к поверхности органа. В условиях операционной выполнялась фрагментация иссеченного участка коркового слоя яичника до размеров 1×1 мм, с последующей его одноэтапной реимплантацией ипсилатерально в предварительно сформированное пространство между остаточной корой и мозговым веществом яичника. Далее производилось ушивание ложа с использованием ареактивного шовного материала. Затягивание швов выполнялось до сопоставления краев раны, исключая перетягивание и ишемизацию ткани (рис. 3, 4, 5). При проведении описанного оперативного вмешательства исключалось использование каких-либо хирургических энергий.
 Биоптат эндометрия и 10% объема каждого фрагмента яичниковой ткани были отправлены на гистологическое исследование. При проведении гистологического исследования обнаружено: фрагменты коркового слоя яичников с утолщенной фиброзированной белочной оболочкой, цитогенной компактной стромой без визуализирующихся фолликулов, единичными толстостенными сосудами (рис. 6, 7). Эндометрий стадии ранней пролиферации с рассеянной и очаговой лимфоцитарной инфильтрацией в строме, в том числе вокруг желез, фиброзными изменениями в строме и расстройством кровообращения на отдельных участках (рис. 8).
Биоптат эндометрия и 10% объема каждого фрагмента яичниковой ткани были отправлены на гистологическое исследование. При проведении гистологического исследования обнаружено: фрагменты коркового слоя яичников с утолщенной фиброзированной белочной оболочкой, цитогенной компактной стромой без визуализирующихся фолликулов, единичными толстостенными сосудами (рис. 6, 7). Эндометрий стадии ранней пролиферации с рассеянной и очаговой лимфоцитарной инфильтрацией в строме, в том числе вокруг желез, фиброзными изменениями в строме и расстройством кровообращения на отдельных участках (рис. 8).
На 6-й день после оперативного вмешательства проведено повторное гормональное исследование с определением уровня гонадотропинов и эстрадиола. Уровень эстрадиола составил 278 пмоль/л, что соответствует более чем 6-ти кратному увеличению показателя. Существенной динамики в уровнях гонадотропинов выявлено не было, что, по-видимому свидетельствует об отсутствии действия механизма отрицательной обратной связи в оси «гипоталамус-гипофиз-яичники» в данном временном интервале. По данным ультразвукового исследования отмечено: Эхо- структура правого яичника: размеры 1,6×1,2×0,7 см, содержит 2 фолликула, наибольший диаметром 0,3 см. Эхо- структура левого яичника: размеры 1,9×1,5×0,9 см, содержит 2 фолликула, наибольший диаметром 0,5 см.
В дальнейшем планируется динамическое наблюдение за состоянием пациентки с детальной оценкой гормонального статуса и ультразвуковых параметров овариального резерва с решением вопроса о дальнейшей тактике ведения.
Заключение
Таким образом, преодоление стойкого бесплодия, как одной из ведущих жалоб у пациенток с ПНЯ, становится возможным при своевременной постановке вопроса о реализации репродуктивных планов с применением минимально инвазивной хирургии и вспомогательных репродуктивных технологий, основание для использования которых при данной нозологии подкреплено результатами молекулярно-генетических исследований [8].