Хромосомные анеуплоидии являются одной из основных причин перинатальной смертности и детской инвалидности [1]. По статистике Всемирной организации здравоохранения, с диагнозом «синдром Дауна» (наиболее распространенной трисомией плода по 21-й хромосоме) рождается каждый 700-й младенец в мире [2]. Эта частота практически не зависит от страны, климатической зоны или социального статуса. По статистике Министерства Здравоохранения, в России ежегодно рождаются около 2500 детей с трисомией 21-й хромосомы; среди детей 0–14 лет наблюдается около 10 тысяч человек больных синдромом Дауна [3]. Совершенствование методов параллельного секвенирования в совокупности с открытием свободноциркулирующей ДНК плода в кровотоке матери позволило разработать принципиально новую методику пренатальной диагностики трисомий плода, сочетающей в себе высокую точность с безопасностью как для матери, так и для ребенка [4].
В настоящий момент в России стандартной практикой выявления трисомий плода являются двухэтапные обследования: неинвазивная пренатальная диагностика (ультразвуковое исследование (УЗИ) и биохимический анализ крови) и, при необходимости, инвазивное тестирование [5]. УЗИ в сочетании с биохимическим анализом крови беременной позволяет сформировать группу риска женщин с подозрением на наличие анеуплоидии у плода. Точность данной группы методов составляет 60–70% [6]. Беременным, попавшим в группу риска, а также беременным в возрасте от 35 лет рекомендуется проведение дополнительного инвазивного исследования (биопсия хориона, амниоцентез, кордоцентез) [7]. Инвазивные процедуры предполагают кариотипирование полученных тканей плода, являющееся основным методом для прямого определения наличия трисомии как в пренатальной, так и в постнатальной диагностике [8].
В то же время получение тканей плода несет с собой высокие риски незапланированного прерывания беременности [9–11]. Статистика, собранная в Дании с 1996 по 2006 год по более чем 63 тыс. случаев проведения амниоцентеза и биопсии хориона, показала, что частота выкидышей после процедуры составила 1,4% для амниоцентеза и 1,9% для биопсии хориона [12]. Такая высокая вероятность неблагоприятного исхода становится серьезным аргументом для отказа от проведения инвазивных процедур. Поэтому разработка нового метода анализа анеуплоидий плода, с одной стороны абсолютно безопасного, с другой стороны обладающего достаточно высокой точностью, критически необходима.
Внеклеточная ДНК
Для разработки высокоточного прямого метода неинвазивной диагностики необходимо найти возможность получения генетического материала плода, не причиняя ему вреда. Было показано присутствие клеток плода в кровотоке матери, однако клетки плода встречаются крайне редко (1:100,000 материнских клеток), и к тому же могут оставаться там продолжительное время после беременности, что снижает чувствительность диагностики при повторной беременности [13]. Альтернативой использованию геномной ДНК клеток плода из кровотока матери стало использование внеклеточной ДНК (вкДНК) плазмы материнской крови. В 1997 году Lo с соавт. обнаружили присутствие в крови матери, помимо собственной материнской вкДНК (вкДНКм), плодной вкДНК (вкДНКпл) [14].
Годом позже была показана возможность использования вкДНКпл для анализа резус-фактора плода [15]. Количественный анализ показал, что относительная концентрация вкДНК плода в сыворотке крови матери значительно выше, чем относительная концентрация геномной ДНК плода в клеточной фракции [13, 16].
В среднем вкДНКпл составляет 10–12% общей вкДНК в крови матери [17]. Фрагменты вкДНКпл равномерно представляют геном плода и выводятся из организма матери вскоре после родов [18]. Это позволило предположить, что вкДНК плода в материнской плазме крови может стать отличным материалом для неинвазивной пренатальной диагностики.
Характеристика вкДНК
ВкДНК представлена фрагментами двухцепочечной ДНК, не связанными с клетками в плазме или сыворотке крови человека [19]. Присутствие в крови внеклеточных или циркулирующих нуклеиновых кислот впервые было показано в 1948 году Mandel и Metias [20]. В последующие годы были представлены работы, показавшие увеличение концентрации вкДНК в сыворотке крови больных раком и показавшие, что ее источником могут быть опухолевые клетки [21, 22], причем изменение концентрации вкДНК может быть ассоциировано с развитием онкологических заболеваний [19]. Кроме того, изменение концентрации вкДНК может быть связано с травмами, сепсисом, инсультом, инфарктом миокарда и, наконец, беременностью [23, 24].
ВкДНК попадает в кровь в результате апоптоза, дифференциации эритроцитов и тромбоцитов, иногда в результате активной секреции клетками (например, гемопоэтические клетки активно секретируют фрагменты ДНК, которые могут выполнять регуляторную функцию межклеточного общения) [19]. Возможно также, что незначительная ее часть возникает в результате некроза [25].
Интересен вопрос удаления вкДНК из крови. Наряду с предположением об элиминации вкДНК клетками печени или же фагоцитами существует гипотеза о возможной инкорпорации вкДНК в геном клеток, способных к захвату фрагментов нуклеиновых кислот из сыворотки крови для использования их в качестве матрицы для исправления мутаций посредством гомологичной рекомбинации [25].
В плазме крови матери кроме вкДНКпл была обнаружена вкРНК плода (вкРНКпл), что потенциально может быть использовано для получения информации об экспрессии генов плода [25]. ВкРНКпл, полученная из амниотической жидкости, впервые позволила анализировать профиль экспрессии жизнеспособного плода [26]. Источником вкДНКпл в крови беременных женщин является апоптоз клеток трофобласта, плаценты и гемопоэтических клеток плода [25]. Фракция вкДНКпл представлена фрагментами длиной в среднем 150–180 пар нуклеотидов [19]. ВкДНКпл начинает определяться в крови матери, начиная с 5-й недели беременности [27], при этом ее процент в общей массе вкДНК строго индивидуален и может варьироваться в широких пределах [17]. Содержание вкДНКпл возрастает на протяжении всей беременности. В исследовании более 22 тыс. образцов плазмы крови беременных женщин, взятых на разных сроках гестации, было показано, что для образцов, взятых с 10-й по 20-ю неделю беременности, фракция вкДНК в среднем содержит 10% вкДНКпл и увеличивается на 0,1% в неделю; начиная с 21-й недели, процент вкДНКпл растет в среднем уже на 1% в неделю [28]. Также процент вкДНКпл отрицательно коррелирует с весом матери. Было показано, что в среднем для матери с весом в 60 кг вкДНКпл составляет 12%, в то время как для матери с весом в 120 кг – только 6% [17]. Это может быть связано с ростом концентрации вкДНКм в кровотоке по мере увеличения веса матери, при том, что количество вкДНКпл остается на прежнем уровне. Увеличение вкДНКм происходит по причине повышения уровня смертности адипоцитов и макрофагов в результате метаболической и иммунологической дисфункции [29]. Альтернативным объяснением может быть разведение вкДНКпл при увеличении объема крови матери [28]. Процент вкДНКпл в крови матери снижается также после физической нагрузки за счет увеличения количества вкДНКм, вызванного процессами механического повреждения мышц и повреждениями ДНК, связанными с оксидативным стрессом [19, 30]
Как было показано Ashoor с соавт., на 11–13-й неделях беременности, в среднем по популяции медианное значение концентрации вкДНКпл составляет 11,4%, при этом значительной разницы для случаев с нормальной беременностью и для плода с трисомией не наблюдается [17, 28]. Концентрация вкДНКпл не зависит от возраста, национальности, курения, пола плода, а также времени хранения плазмы после ее получения [17].
Неинвазивные генетические методики пренатальной диагностики
Еще в 2005 г. Zimmerman с соавт. представили оптимизацию протокола количественной полимеразной цепной реакции (ПЦР) в реальном времени на локус DYS14 на Y-хромосоме, который позволял определить концентрацию вкДНКпл для беременностей с мужским плодом [31]. Какое-то время обсуждалась возможность применения подобного протокола для обнаружения увеличения копийности потенциально трисомийных хромосом [32]. Однако для достоверного определения наличия анеуплоидии требуется анализ большого количества локусов [18], поэтому технология, основанная на ПЦР в реальном времени, неудобна для клинического применения. Большинство ученых сосредоточились на разработке методики, в основе которой лежит массовое параллельное секвенирование нового поколения (NGS), которое позволяет одновременно в автоматическом режиме анализировать большое количество коротких фрагментов ДНК. На сегодняшний день результаты внедрения методики, основанной на секвенировании вкДНК, весьма впечатляющи [33–36].
В ряде стран (Дания, Швеция и Нидерланды) метод диагностики трисомий плода, основанный на секвенировании вкДНК плазмы крови матери уже включен в стандартную медицинскую практику [18, 37].
Одним из вариантов решения задачи о предсказании копийности хромосом является наивный подход, предполагающий чтение всего генома и сравнение представленности исследуемых и контрольных хромосом. Для этого производится полногеномное секвенирование всей вкДНК, после чего данные секвенирования (так называемые чтения) картируются на референсный геном человека [36].
Длина чтений обычно составляет 25–50 пар нуклеотидов [4, 38]. Далее производится подсчет количеств чтений, относящихся к каждой хромосоме в каждом образце, эти количества нормализуются на общее количество полученных с образца чтений [36]. Для учета возможной неравномерности секвенирования, связанной с GC-составом читаемой ДНК, может также проводиться дополнительная коррекция на GC-состав [39]. Для усиления статистической мощности анализа, а также чтобы избавиться от необходимости в априорной контрольной выборке, вместо единой кумулятивной метрики по целой хромосоме используют разбиение генома на множество последовательно идущих неперекрывающихся коротких участков (окон) и подсчет количества чтений, приходящихся на каждое такое окно. Для этого координаты чтений группируются по окнам, после чего определяется покрытие окон (количество чтений, чьи координаты совпали с координатами окон).
После определения координат, из последующего анализа могут исключаться чтения, координаты которых совпадают с координатами известных копийных полиморфизмов и геномных повторов человека. Исключение таких участков позволяет избежать ситуаций, вызванных несовершенством построения референсного генома и/или алгоритмов выравнивания последовательностей, используемых в процедуре картирования; такие ситуации могут приводить к ошибочному определению координат чтений и/или к аномальным значениям покрытия отдельных регионов генома, что снижало бы точность проводимого анализа.
Перед дальнейшим анализом отсеиваются окна, потенциально способные повлиять на точность анализа, например, являющиеся явными статистическими выбросами по покрытию. Для дальнейших расчетов используется корректированное покрытие окон, равное произведению покрытия окна на соответствующий его GC-составу коэффициент коррекции [39]. В результате чего определение анеуплоидии производится посредством сравнения двух выборок: окон с исследуемой хромосомы и окон со всех остальных хромосом.
Важно заметить, что полногеномный подход не требует разделения вкДНКпл и вкДНКм и в то же время дает возможность проверять наличие всех возможных трисомий одновременно в автоматическом режиме. Основным ограничением метода является снижение достоверности расчета наличия трисомий плода при содержании вкДНКпл менее 4% [40]. Это обуславливает необходимость предварительной оценки количества вкДНКпл в образце. Как было сказано выше, процент вкДНКпл коррелирует со сроком гестации и весом матери. В период с 10 по 20 неделю беременности примерно 2% образцов содержат менее 4% вкДНКпл [28]. Такие образцы исключаются из дальнейшего анализа и требуют перезабора крови на более поздних сроках гестации. Было показано, что при повторном заборе крови (в среднем интервал между двумя заборами составлял 3,6 недели) процент вкДНКпл увеличивается в среднем на 1% и для более половины образцов составляет более 4% вкДНК [28].
Для стандартного протокола подготовки образцов был предложен ряд усовершенствований, например, исключение этапа ПЦР, который может вносить сдвиг за счет неравномерной амплификации разных участков генома [41]. Однако, как показала практика, процесс нормализации данных после секвенирования образцов, приготовленных по протоколу, содержащему этап амплификации, эффективно справляется с подобными погрешностями.
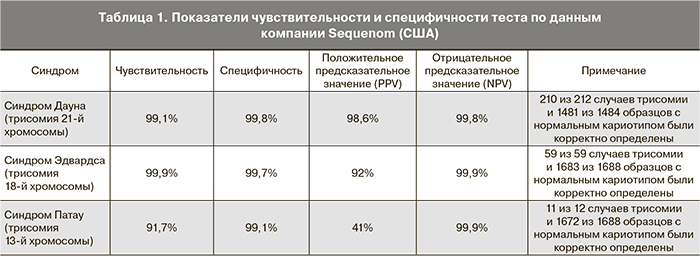
Методика, основанная на полногеномном чтении вкДНК на сегодняшний день успешно применяется на практике. Первой коммерческой компанией, предлагающей услуги по проведению неинвазивной диагностики с помощью данной методики, стала компания Sequenom (США), организованная в 2011 году [42]. К 2014 году объемы продаж теста MaterniT21 PLUS составили 50 тыс. тестов в квартал. Заявленные показатели чувствительности и специфичности тестов указаны в табл. 1 и сравнимы с соответствующими показателями инвазивных процедур. С 2014 г. компания включила в свой тест проверку субхромосомных делеций, в том числе синдромы Якобсона (делеция 11р), Лангера–Гиедиона (делеция 8q) и Вольфа–Хиршхорна (делеция 4р).
Кроме компании Sequenom, такие компании, как Verinata Health (США) и Ariosa (США) также используют полногеномный подход для анализа анеуплоидий плода.
Несмотря на успех полногеномного подхода продолжаются поиски альтернативных подходов, связанных с выборочным секвенированием отдельных участков генома. Преимуществом таргетного похода является возможность существенно уменьшить минимально необходимое количество чтений [4]. Сокращение необходимого объема секвенирования позволяет использовать секвенаторы с меньшей производительностью и получать данные для большего количества образцов за один запуск прибора. Это значительно снижает себестоимость эксперимента, в то время как сравнительно высокая стоимость анализа до сих пор считаться главным препятствием для внедрения методики в стандартную медицинскую практику. С другой стороны, выборочное секвенирование обычно требует отдельных наборов реагентов и включения дополнительных стадий обработки образцов, что может негативно влиять на себестоимость и перевешивать экономию на объемах секвенировании, особенно при больших масштабах. С точки зрения перспектив расширения функциональности, таргетный подход способен обеспечить анализ большего количества генетических отклонений плода — инсерций и делеций и, возможно в перспективе, моногенных заболеваний.
Единственным коммерчески применяемым таргетным подходом на сегодняшний день является метод, основанный на подсчете аллельных вариантов полиморфных локусов [42]. Перед проведением секвенирования геномные библиотеки обогащаются (например, за счет селективной гибридизации) фрагментами, содержащими полиморфные локусы [43]. Отбор регионов генома, которые содержат полиморфные локусы, отличающие мать и плод, позволяют разделить чтения, происходящие от геномного материала матери и ребенка. Ограничением этого метода является необходимость знать генотипы родителей (хотя бы генотип матери), чтобы выбрать полиморфизмы, подходящие для анализа по аллельной частоте и отделить реальные полиморфизмы от ошибок секвенирования. Таргетный подход для неинвазивной пренатальной диагностики анеуплоидий плода используется также компанией Natera (США) [44].
Кроме полиморфных локусов, для разделения чтений плода и матери предлагалось использовать эпигенетические различия тканей плода (а именно плаценты, как основного источника вкДНК плода) и клеток крови матери [45]. Поиск дифференциально метилированных регионов дает возможность определения регионов, полностью метилированных у матери и неметилированных у плода (либо наоборот, полностью метилированных у плода и полностью неметилированных в клетках крови матери). Перед секвенированием проводят бисульфитную конвертацию геномных библиотек. Благодаря бисульфитной конвертации можно точно отделить метилированные чтения от неметилированных, и как следствие – чтения плода от чтений матери. Ряд работ были посвящены идентификации подходящих дифференциально метилированных регионов [46]. Однако при попытке применения найденных регионов для анализа анеуплоидий плода по вкДНК плазмы крови матери, были обнаружены значительные индивидуальные различия. Кроме того, остаточное метилирование предположительно неметилированных тканей вносило серьезные искажения в расчеты.
Биологические ограничения неинвазивного теста
При цитогенетических исследованиях материала, полученного при биопсии ворсин хориона примерно в 1% случаев наблюдается мозаицизм плаценты [47]. Плацентарный мозаицизм может быть как митотического, так и мейотического происхождения. В первом случае зигота имеет нормальный кариотип, а клетки с анеуплоидиями появляются в процессе последующих ее делений. Обычно в этом случае наблюдаются отдельные трисомийные области в плаценте, плод при этом имеет нормальный кариотип. Во втором случае зигота имеет изначально трисомный кариотип, а в процессе эмбриогенеза происходит избавление от лишней хромосомы. При этом наблюдается высокая степень мозаицизма или полная трисомия плаценты; плод может иметь как нормальный, так и мозаичный кариотип. В случае нормального кариотипа плода есть риск однородительской дисомии, что может привести к наличию у плода болезней импринтинга. В любом случае, мозаицизм плаценты может приводить к ложноположительным результатам теста.
Ложноположительные результаты также могут возникать в случае спонтанной редукции одного из эмбрионов при многоплодной беременности. Такое явление встречается примерно в 0,18% случаев [48]. Наличие информации о редукции эмбриона имеет большое значение при принятии решения о дальнейшем ведении беременности, поэтому детальное УЗИ в таких случаях играет очень важную роль.
Еще одним источником ложноположительных результатов неинвазивной генетической пренатальной диагностики анеуплоидий может быть мозаицизм самой матери [49]. С увеличением возраста матери возрастает частота изменения количества копий X-хромосомы в крови матери [50].
Проведение массового цитогенетического анализа клеток крови матери при положительных результатах неинвазивного пренатального теста может в некоторых случаях предотвратить проведение инвазивной процедуры [49].
В случаях, когда алгоритм анализа данных подразумевает подсчет покрытия всей хромосомы и не происходит проверки равномерности покрытия вдоль хромосомы, проблемой могут оказаться также крупные копийные вариации в геноме матери. Причем они могут быть источником как ложноположительных, так и ложноотрицательных результатов [49]. Модификация алгоритмов анализа данных может решить эту проблему.
Опухолевые процессы нередко сопровождаются крупными хромосомными перестройками и анеуплоидиями. Из-за активного роста и нестабильной природы опухолевых тканей их вкДНК может составлять большую долю от всей вкДНК в крови и приводить к ложноположительным результатам теста. По этой причине не рекомендуется проведение неинвазивного генетического теста в случае диагностирования онкологических заболеваний у матери.
Наличие множества биологических причин, приводящих к ложноположительным и ложноотрицательным результатам исследования, указывает на необходимость обязательного подтверждения положительных результатов неинвазивной генетической пренатальной диагностики инвазивными методами, и не позволяет полностью исключить наличие анеуплоидий при отрицательных результатах. Несмотря на перечисленные ограничения, методика обладает высокими показателями чувствительности и специфичности, а также высоким отрицательным предсказательным значением и может использоваться в качестве скрининговой в массовом порядке наравне с другими неинвазивными методами.
Международное общество пренатальной диагностики (ISPD) с 2011 года рекомендует клиникам использовать представленные на рынке неинвазивные генетические методики пренатальной диагностики для беременных женщин как с высоким, так и с низким риском рождения ребенка с анеуплоидией.
Публикация была написана при поддержке Министерства образования и науки Российской Федерации в рамках выполнения Соглашения №14.576.21.0069 о предоставлении субсидии (уникальный идентификатор прикладных научных исследований (проекта) RFMEFI57614X0069).



