Остеопороз – многофакторное заболевание, характеризующееся низкой минеральной плотностью кости (МПК) и микроархитектурными нарушениями, что приводит к потере прочности костной ткани и увеличению риска переломов [1]. Низкотравматичные переломы являются наиболее важными последствиями остеопороза, приводящими к инвалидизации, повышенной заболеваемости и смертности. По данным денситометрии распространенность остеопороза в Российской Федерации составляет 30,5–33,1% женщин в возрасте 50 лет и старше [2, 3].
Большинство исследований костной ткани на фоне дефицита половых гормонов посвящено женщинам в пери- и постменопаузе [4, 5]. Крайне важной представляется оценка состояния костной ткани у молодых женщин с дефицитом эстрогенов (аменореей).
Вторичная аменорея развивается у 3–5% женщин репродуктивного возраста [6] и встречается в 8–10% в структуре женского бесплодия. Основные метаболические нарушения у данных пациенток затрагивают липидный обмен (а именно повышение уровня общего холестерина, липопротеинов низкой плотности и аполипопротеина В) и костный обмен [7, 8]. У большинства женщин с аменореей наблюдаются высокие темпы снижения МПК (от 3 до 14% в год), что сопровождается повышением риска переломов позвоночника и дистальных отделов лучевой кости [9].
Следовательно, эти женщины составляют особую группу риска по развитию низкотравматичных переломов и тяжелого остеопороза после достижения среднестатистического возраста наступления менопаузы [10].
«Золотым стандартом» диагностики постменопаузального остеопороза является двухэнергетическая рентгеновская абсорбциометрия (остеоденситометрия). Приборы для данного дорогостоящего исследования доступны лишь в крупных медицинских центрах.
Распространенность низкой МПК у пациенток с аменореей по данным различных авторов – до 52% пациенток при оценке по Z-критерию и 75% по Т-критерию; частота низкотравматичных переломов – до 26,5% [11, 12]. Это подтверждает значимость оценки состояния плотности кости для проведения своевременной профилактики последующего снижения МПК, переломов и/или выбора оптимальных видов, доз, режимов и длительности патогенетической терапии с учетом формы аменореи, а также перед решением вопроса о проведении программы ЭКО данной категории пациенток и лактации.
Согласно данным мировой литературы, особую роль в условиях дефицита эстрогена, в том числе в аспекте состояния костной ткани, играет жировая ткань [13]. В ней экспрессируется фермент ароматаза, необходимый для локальной конверсии андрогенов в эстрогены [14]. Более того, похудание и недостаточная масса тела являются одним из этиопатогенетических звеньев некоторых форм аменореи [15].
Значительная распространенность низкой МПК у женщин с аменореей, а также низкая доступность своевременного проведения остеоденситометрии всем пациенткам с дефицитом эстрогена, связанная с экономическими факторами и недостаточным техническим обеспечением ряда медицинских учреждений, обусловили цель нашего исследования – разработка широкодоступного метода неинструментального скрининга низкой МПК у женщин с вторичной аменореей, с учетом имеющихся известных факторов риска.
Материал и методы исследования
В исследование вошли 109 женщин в возрасте 18–39 лет с вторичной аменореей – 55 пациенток с преждевременной недостаточностью яичников (ПНЯ) и 54 – с функциональной гипоталамической аменореей (вторичной гипогонадотропной аменореей (ГГА)). Данные формы вторичной аменореи являются наиболее распространенными в популяции и могут быть связаны со снижением МПК. Гиперпролактинемия, хирургические и другие ятрогенные формы аменореи не вошли в исследование. Все включенные пациентки не получали препараты заместительной терапии половыми гормонами минимум 6 месяцев до исследования.
Были проведены основные клинические, гормональные (фолликулостимулирующий гормон (ФСГ), лютеинизирующий гормон (ЛГ), пролактин, тиреотропный гормон (ТТГ), паратгормон, эстрадиол, дегидроэпиандростерон сульфат (ДГЭАС), тестостерон общий, тестостерон свободный в слюне, витамин D), биохимические исследования (включая липидограмму, коэффициент атерогенности (КА), маркеры костного обмена), ультразвуковое исследование (УЗИ) органов малого таза, молочных желез, по показаниям – магнитно-резонансная томография (МРТ) головного мозга, консультация окулиста (с оценкой периферических полей зрения). Из исследования исключались пациентки с пороками развития органов репродуктивной системы (по результатам УЗИ органов малого таза), а также пациентки с органической патологией гипоталамо-гипофизарной системы (по результатам МРТ головного мозга). Измерение МПК проводили методом двухэнергетической рентгеновской абсорбциометрии в области поясничного отдела позвоночника (L1-L4) и проксимального отдела бедренных костей (femoral neck, total femur) на рентгеновском денситометре GE «Lunar» (США).
 В исследовании учитывалось снижение МПК в стандартных отклонениях (SD). С учетом рекомендаций Международного общества по клинической денситометрии (ISCD) от 2013 года об оценке состояния МПК у женщин до наступления менопаузы, в данной работе использовался Z-критерий (сравнение с подобранной по возрасту референсной популяцией) для оценки МПК у пациенток. Z-критерий ≤ –2,0 в указанных выше участках скелета расценивался как «МПК ниже уровня, ожидаемого по возрасту» («низкая МПК»); Z-критерий > –2,0 – «МПК в пределах ожидаемого уровня по возрасту» («нормальная МПК»).
В исследовании учитывалось снижение МПК в стандартных отклонениях (SD). С учетом рекомендаций Международного общества по клинической денситометрии (ISCD) от 2013 года об оценке состояния МПК у женщин до наступления менопаузы, в данной работе использовался Z-критерий (сравнение с подобранной по возрасту референсной популяцией) для оценки МПК у пациенток. Z-критерий ≤ –2,0 в указанных выше участках скелета расценивался как «МПК ниже уровня, ожидаемого по возрасту» («низкая МПК»); Z-критерий > –2,0 – «МПК в пределах ожидаемого уровня по возрасту» («нормальная МПК»).
Индекс массы тела (ИМТ) рассчитывался по формуле: ИМТ = масса тела (кг) / (рост (м))2. КА рассчитывался по формуле: КА = (общий ХС – ЛПВП)/ЛПВП, где ХС – холестерин (ммоль/л), ЛПВП – липопротеины высокой плотности (ммоль/л). Данные биохимические показатели определялись фотометрическими и турбидиметрическими методами на автоматических анализаторах BA-400, A-25, с использованием реагентов производства Biosystems (Испания).
Статистическая обработка полученных результатов проводилась при помощи программного пакета SPSS Statistics 21 for Windows, для построения моделей использовался метод бинарной логистической регрессии.
Результаты исследования
Средний возраст женщин составил 28,1±6,9 года (95% ДИ 26,6-29,6). Клинико-биохимическая характеристика групп с ПНЯ и вторичной ГГА представлена в табл. 1.
Как видно из таблицы, в группе пациенток с ПНЯ средний возраст начала аменореи, ИМТ, ЛГ, ФСГ был достоверно выше, чем в группе с ГГА, что объясняется этиопатогенезом данных двух форм вторичной аменореи. Средний уровень эстрадиола был ниже нормы (норма >150 пмоль/л) (ГГА) либо близок к нижней границе нормы (ПНЯ). Группа пациенток с ГГА в целом характеризовалась недостаточностью витамина D (норма >30 нг/мл) и уровнем холестерина, превышающим нормативные показатели (норма 3,1–5,2 ммоль/л), в отличие от группы ПНЯ. Средние показатели МПК в поясничном отделе позвоночника (включая Z-критерий) в ГГА были достоверно ниже, что отчасти можно объяснить более ранним началом аменореи (не произошел набор достаточной пиковой костной массы) и более выраженным дефицитом эстрогенов, по сравнению с группой ПНЯ. Средние значения маркеров костного обмена, таких как β-crosslaps, были повышены в обеих группах (норма в пременопаузе 0,17–0,43 нг/мл), тогда как остеокальцин был выше нормы (в пременопаузе 11,4–24,4 нг/мл) в группе пациенток с ГГА, в группе ПНЯ – близок к верхней границе нормы, что говорит об увеличении костного обмена при дефиците эстрогенов.
Низкая МПК в поясничном отделе позвоночника была обнаружена у 48,2% (n=26) пациенток с функциональной гипоталамической аменореей и 23,6% (n=13) пациенток с ПНЯ. Низкая МПК в шейке бедра была обнаружена в 5,6% (n=3) пациенток с функциональной гипоталамической аменореей, все случаи сопровождались низкой МПК в поясничном отделе позвоночника. У пациенток с ПНЯ низкой МПК в шейке бедра обнаружено не было. Следовательно, Z-критерий ≤–2,0 в поясничном отделе позвоночника был выбран в качестве основного ориентира для постановки диагноза «низкая МПК». У 12,8% пациенток были выявлены низкотравматичные переломы в анамнезе: у 16,7% с функциональной гипоталамической аменореей (n=9); у 9% с ПНЯ (n=5).
В зависимости от показателей МПК в поясничном отделе позвоночника все пациентки были разделены на 2 группы: 39 пациенток с низкой МПК (35,8%) и 70 пациенток с нормальной МПК (64,2%).
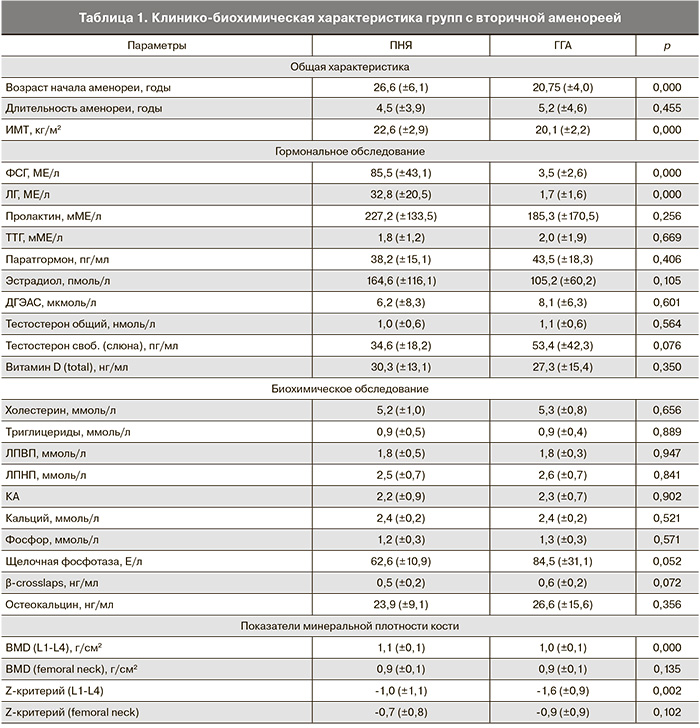
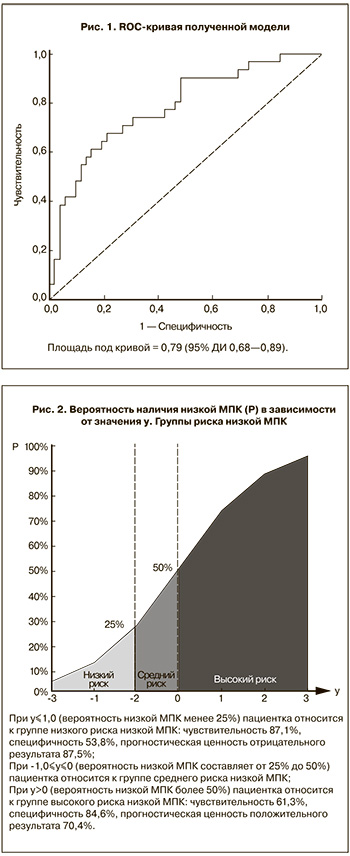
В группе пациенток с низкой МПК средняя длительность аменореи была достоверно больше (р=0,0003) и КА достоверно выше (р<0,05), чем в группе пациенток с нормальной МПК. Также была выявлена умеренная положительная корреляционная зависимость между МПК (г/см2) в поясничном отделе позвоночника и ИМТ (r=0,432, р=0,001). С помощью бинарной логистической регрессии нами построена модель для оценки вероятности наличия низкой МПК у данной категории женщин (рис. 1). При у>0 вероятность наличия низкой МПК составляет более 50% (чувствительность 61,3%, специфичность 84,6% (рис.2), прогностическая ценность положительного результата 70,4%); пациентка относится к группе высокого риска низкой МПК.
Вероятность (Р) низкой МПК определяется по формуле: Р=1/(1+е-у), где у=2,67+0,22*ДА– 0,29*ИМТ+0,74*КА, где ДА – длительность аменореи (годы).
Каждый коэффициент в формуле характеризовался р<0,05; для всей модели р=0,0001.
1) При у>0 вероятность наличия низкой МПК составляет более 50% (чувствительность 61,3%, специфичность 84,6% (рисунок), прогностическая ценность положительного результата 70,4%); пациентка относится к группе высокого риска низкой МПК;
2) При у<–1,0 вероятность наличия низкой МПК составляет менее 25% (чувствительность 87,1%, специфичность 53,8% (рисунок), прогностическая ценность отрицательного результата 87,5%); пациентка относится к группе низкого риска низкой МПК;
3) При –1,0≤у≤0 вероятность наличия низкой МПК составляет 25–50%, пациентка относится к группе среднего риска низкой МПК.
Обсуждение
Анализ данных остеоденситометрии у женщин с различными формами вторичной аменореи в поясничном отделе позвоночника и шейке бедра (одних из наиболее уязвимых участках скелета при эстроген-дефиците) по Z-критерию позволил выявить значительную распространенность низкой МПК – 35,8%: 48,2% пациенток с функциональной гипоталамической аменореей и 23,6% пациенток с ПНЯ.
Согласно детальному анализу включенных пациенток, установлено, что некоторые расхождения с данными предыдущих исследований объясняются тем, что они включали группу с дисгенезией гонад. Данная категория пациенток чаще характеризуется первичной аменореей, а значит, более ранним развитием дефицита эстрогенов, когда еще не была набрана достаточная пиковая костная масса. Наша цель была оценить состояние костной ткани при вторичной аменорее, что и обусловило более высокие показатели МПК и более низкую частоту переломов.
При этом отсутствие возможности своевременного проведения остеоденситометрии всем пациенткам с вторичной аменореей, а также социально-экономические последствия низкотравматичных переломов в течение жизни обусловили необходимость разработки широкодоступного метода неинструментального скрининга низкой МПК для реализации эффективных стратегий диагностики, профилактики и/ или лечения данного состояния и соответствующих осложнений.
Костная ткань является мишенью для половых гормонов, в частности, в ней экспрессируются как α, так и β-эстрогеновые рецепторы [16]. В связи с этим важную роль в развитии снижения МПК играет длительность эстроген-дефицита.
Установлено, что жировая и костная ткань имеют взаимосвязи на многих уровнях. Остеобласты (основные клетки, ответственные за процесс костеобразования) и адипоциты костного мозга имеют общий предшественник – мезенхимальную стволовую клетку [17]. В костном мозге адипоциты и их предшественники играют важную роль в регуляции функции остеобластов. Они экспрессируют ароматазу и ряд факторов, играющих важную роль в дифференцировке и/или функции остеобластов [18]. Жировая ткань синтезирует ряд активных веществ, влияющих на костное ремоделирование. Например, цитокины оказывают прямое воздействие на костную ткань; адипокины, которые, влияя на ядра гипоталамуса, изменяют симпатические импульсы на кость; а также паракринные эффекты на прилежащие костные клетки [19].
Лептин, секретируемый адипоцитами, повышает экспрессию остеогенных генов в стромальных клетках, направляя их по пути остеогенеза, в противоположность адипогенезу. Кроме того, лептин взаимодействует со стромальными клетками костного мозга, остеобластами и остеокластами, стимулируя процессы формирования костной массы и тормозя процессы резорбции кости [20]. При этом существуют данные, что повышенный уровень холестерина является фактором риска низкой МПК [21].
Исходя из вышеизложенного, нам представляется целесообразным сопоставить некоторые данные, характеризующие длительность аменореи, ИМТ, липидный обмен и МПК у пациенток с вторичной аменореей.
У пациенток с низкой МПК длительной аменореи была достоверно больше, а КА достоверно выше, по сравнению с пациентками с нормальной МПК. А также выявлена прямая корреляция между ИМТ и МПК.
Полученные нами данные о взаимосвязи МПК, ИМТ и липидного обмена в определенной степени подтверждают теоретическую взаимосвязь двух данных структур, и позволили предложить формулу для оценки вероятности низкой МПК на основании трех показателей: длительности аменореи, ИМТ и КА.
Согласно полученным результатам, представляется возможным определить группу риска низкой МПК, к которой относится пациентка (рисунок) и рассматривать данную формулу как метод скрининга низкой МПК:
1) При у>0 (вероятность низкой МПК более 50%) пациентка относится к группе высокого риска низкой МПК, в данном случае показано проведение двухэнергетической рентгеновской абсорбциометрии;
2) При у<–1,0 (вероятность низкой МПК менее 25%) пациентка относится к группе низкого риска, при назначении этиопатогенетической терапии основного заболевания проведение двухэнергетической рентгеновской абсорбциометрии не показано в течение ближайших 3–5 лет;
3) При –1,0≤у≤0 (вероятность низкой МПК составляет от 25 до 50%) пациентка относится к группе среднего риска, решение о необходимости проведения двухэнергетической рентгеновской абсорбциометрии остается на усмотрение специалиста, в зависимости от наличия или отсутствия других факторов риска (в том числе низкотравматичных переломов в анамнезе, дефицита массы тела, недостаточности витамина D, повышения уровня маркеров костного обмена и др.).
Заключение
Таким образом, у женщин с вторичной аменореей на фоне дефицита эстрогенов происходят изменения как в липидном, так и в костном обмене. Процессы в жировой и костной ткани имеют патогенетические взаимосвязи на многих уровнях. Отсутствие возможности своевременного проведения двухэнергетической рентгеновской абсорбциометрии всем пациенткам с эстроген-дефицитом (экономические факторы и техническое обеспечение) обусловило необходимость разработки неинструментального метода скрининга для определения групп риска низкой МПК, что имеет большое значение для реализации эффективных стратегий диагностики, профилактики и/или лечения данного состояния и соответствующих осложнений. В связи с этим предложенная формула для определения вероятности низкой МПК на основании показателей длительности аменореи, ИМТ и КА представляется теоретически и клинически обоснованным широкодоступным неинструментальным методом ранней оценки состояния костной ткани у пациенток с вторичной аменореей.
Подана заявка на изобретение № 2014123531 от 10.06.2014 г. «Метод скрининга низкой минеральной плотности костной ткани у женщин с вторичной аменореей».



