Гипертензивные расстройства у беременных представлены различными нозологическими формами – хроническая артериальная гипертензия (ХАГ), гипертензия, вызванная беременностью, гестационная артериальная гипертензия, преэклампсия (ПЭ) и присоединившаяся ПЭ у женщин с ХАГ [1]. Индивидуально подобранная антигипертензивная терапия (АГТ) направлена на предотвращение тяжелых осложнений данных состояний, пролонгирование беременности с минимальным повреждающим воздействием на плод, а также на снижение риска сердечно-сосудистых и церебрально-сосудистых заболеваний в последующей жизни женщины [2–4]. Важными звеньями патогенеза АГ при беременности являются: изменение эластичности сосудистой стенки в сторону увеличения жесткости, нарушение регуляции сосудистого тонуса, что возможно определить с помощью оценки скорости распространения пульсовой волны (СРПВ) и вариабельности ритма сердца [5, 6]. Другой важный аспект патогенеза артериальной гипертензии у беременных – синдром системного воспалительного ответа, при котором изменяется функциональная активность лейкоцитов, усиливается экспрессия молекул адгезии, активируется миграция клеток в зону воспаления, меняются параметры хемотаксиса [7, 8]. При различных видах гипертензивных расстройств экспрессия молекул клеточной адгезии лейкоцитов, участвующих в этапе трансэндотелиальной миграции, имеет свои особенности [9]. В то же время имеются данные о взаимосвязи субклинического воспаления и повышенной жесткости артериального русла у пациентов при АГ, в том числе во время беременности [10–12]. В ряде работ показано, что под влиянием АГТ происходит нормализация иммунологических и функциональных параметров [6, 13]. Следовательно, можно предположить, что от степени выраженности изменений в сосудистой стенке, регуляции тонуса сосудов зависят эффективность АГТ, выбор схемы лечения и тактики ведения беременных с различными видами гипертензивных расстройств.
Цель исследования – разработать и обосновать персонифицированную систему выбора АГТ и тактики ведения беременных с различными видами гипертензивных расстройств.
Материалы и методы
На базе акушерской клиники ФГБУ «Ивановский НИИ МиД им. В.Н. Городкова» Минздрава России были обследованы 457 беременных с гипертензивными расстройствами различного генеза в сроке от 22 до 36 недель. Согласно международной статистической классификации болезней и проблем, связанных со здоровьем, 10-го пересмотра (МКБ-10), обследованные с гипертензивными нарушениями были разделены на группы: 1-я – 147 пациенток с ХАГ (код по МКБ-10 О10.0); 2-я – 109 женщин с ХАГ и присоединившейся ПЭ (код по МКБ-10 О11); 3-я – 201 беременная с ПЭ (код по МКБ-10 О14), которые в зависимости от тяжести клинических проявлений были разделены на подгруппы: 3а – 107 женщин с ПЭ средней степени тяжести (код по МКБ-10 О14.0) и 3б – 94 пациентки с тяжелой ПЭ (код по МКБ-10 О14.1). Критерием начала АГТ у беременных являлся уровень артериального давления (АД) ≥140/90 мм рт.ст.; целевой (безопасный для матери и плода) уровень АД при проведении АГТ – 130–150/80–95 мм рт.ст. Все беременные 1-й, 2-й групп и подгруппы 3а были разделены на две подгруппы в зависимости от назначаемого лечения: находившиеся на однокомпонентной и комбинированной АГТ. Пациентки с умеренной ПЭ (независимо от наличия ХАГ) (n=147) были разделены на подгруппы: с эффектом от терапии (n=92) и с отсутствием эффекта от проводимой терапии или с нарастанием симптомов ПЭ (n=55). Беременные с ранней тяжелой ПЭ (в том числе на фоне ХАГ) (n=142) были разделены на подгруппы: с выжидательной (n=98) и активной тактикой ведения (n=44).
Критериями исключения явились: вторичная (симптоматическая) АГ (коды по МКБ-10 О10.1, О10.2, О10.3, О10.4), гестационная артериальная гипертензия (код по МКБ-10 О13), острые и обострение хронических воспалительных заболеваний, аллергические реакции на момент обследования, опухоли различной локализации, системные заболевания соединительной ткани, хроническая почечная недостаточность.
Оценка состояния эластических свойств сосудов проводилась сфигмографическим методом, исследование вегетативной регуляции сосудистого тонуса осуществляли методом спектрального анализа вариабельности ритма сердца с помощью аппаратно-программного комплекса «Поли-спектр-8Е» (ООО «Нейрософт», Иваново).
Содержание лимфоцитов, моноцитов и нейтрофилов, экспрессирующих молекулы адгезии CD62L, CD11b, CD49b, CD99, а также рецепторы хемокинов CCR2, CCR5, CX3СR1, CXCR1, CXCR2 в периферической венозной крови определяли методом проточной цитофлуориметрии на приборе FACSCanto II (Becton Dickinson, США) с использованием моноклональных антител (eBioscience, Франция); сывороточный уровень MCP-1 (eBioscience, Австрия), RANTES (eBioscience, Австрия), Fractalkine (Ray Biotech, США), IL-8 (ООО «Цитокин», Россия) исследовали методом иммуноферментного анализа на микропланшетном ридере Multiscan ЕХ (Labsystems, Финляндия).
Статистический анализ полученных данных проводили в пакете прикладных лицензионных программ Microsoft Office 2010, Statistica for Windows 6.0, SPSS Statistic, MedCalc 7.4.4.1. Значения величин представляли в виде медианы с указанием 25-го и 75-го перцентилей (Ме (Q25%–Q75%)). Для сравнения групп по качественным бинарным признакам применяли критерий χ2 Пирсона или двусторонний точечный критерий Фишера. Для сравнения двух групп по количественным признакам, распределение которых не соответствует нормальному, использовали критерий Манна–Уитни (уровень р<0,05 считался статистически значимым). Для выявления взаимосвязи между одним качественным дихотомическим признаком и подмножеством количественных и качественных признаков применялся метод логистической регрессии с расчетом коэффициентов регрессии с получением математической формулы P=1/(1+e-z), где z=b1X1+b2X2+…+bnXn+a; b – коэффициенты регрессии; а – константа; Х – значения независимых переменных; е – основание натурального логарифма, имеет значение 2,72. В качестве зависимой переменной выступала эффективность АГТ, при положительном эффекте которой присваивался код «0», при его отсутствии – «1». Для оценки прогностической значимости исследуемых показателей применялся ROC-анализ с расчетом площади, ограниченной ROC-кривой, а также уровней чувствительности и специфичности.
Результаты и обсуждение
Данные об исходных клинических, функциональных, иммунологических показателях сравниваемых групп приведены в табл. 1.
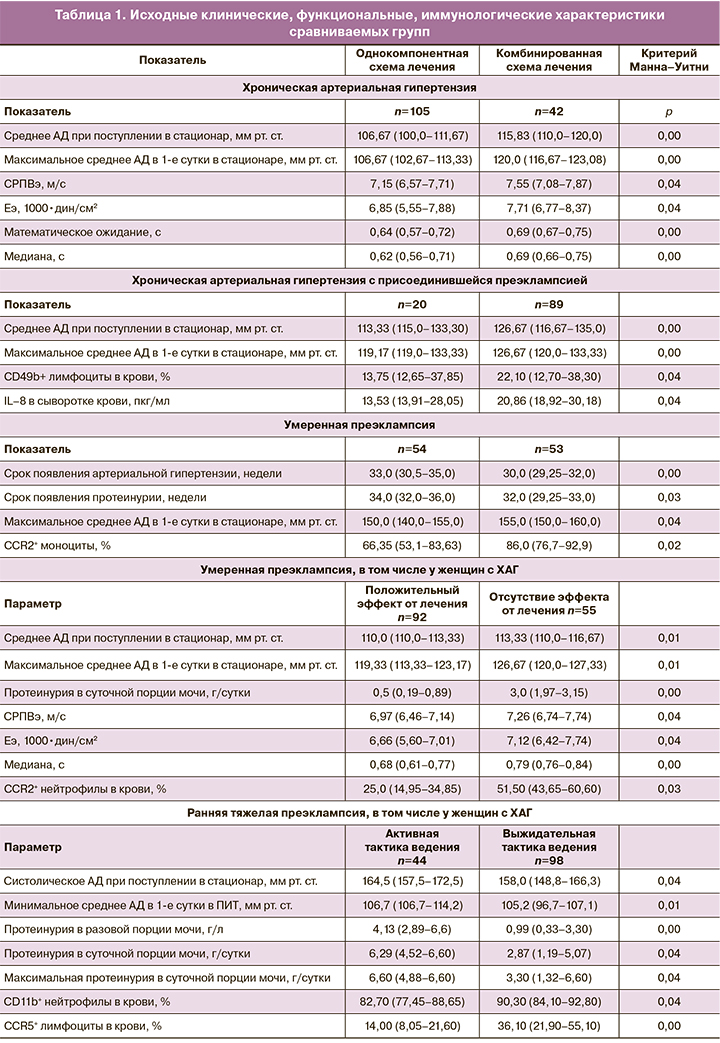
Анализ клинических данных показал, что у пациенток с ХАГ и с ХАГ с присоединившейся ПЭ, получавших для достижения целевого уровня АД комбинированную схему АГТ, при поступлении в стационар среднее АД было статистически значимо выше, чем в подгруппе с монотерапией, как и зафиксированное в 1-е сутки пребывания в стационаре среднее максимальное АД. ПЭ, осложнившая беременность у пациенток с ХАГ, потребовавшая назначения комбинированной терапии, в 70,8% случаев имела раннее начало в сроке 31,0 (28,0–34,0) неделя (р=0,04 относительно пациенток, получавших один препарат). Уровни протеинурии из разовой и суточной порций мочи значимо не различались между подгруппами (р=0,05).
У пациенток с умеренной ПЭ, применявших комбинированную схему АГТ, отмечалось более раннее появление АГ, протеинурии; а также статистически значимо более высокий уровень максимального систолического АД в 1-е сутки пребывания в стационаре по сравнению с теми, кому достаточно было приема одного антигипертензивного препарата для достижения целевого уровня АД.
Ретроспективный анализ показателей, характеризующих эластические свойства сосудистой стенки и вегетативную регуляцию сосудистого тонуса, определенных при поступлении в стационар, выявил их статистически значимые различия в зависимости от схемы АГТ только в группе с ХАГ – при необходимости комбинированной терапии значения СРПВ по артериям эластического типа (СРПВэ) и модуля упругости артерий эластического типа (Еэ) были статистически значимо выше, чем у пациенток, получавших однокомпонентную схему лечения, как и математическое ожидание (М) и медиана (Ме), характеризующие вегетативную регуляцию тонуса сосудов.
Анализ иммунологических показателей, определенных при поступлении в стационар, показал, что необходимость назначения комбинированной терапии ассоциировалась: в группе с ХАГ и присоединившейся ПЭ – со статистически значимо более высоким содержанием CD49b+ лимфоцитов и высоким сывороточным уровнем IL-8 по сравнению с пациентками, применявшими однокомпонентную схему лечения; в группе с умеренной ПЭ – со статистически значимо более высоким уровнем CCR2+ моноцитов по сравнению с беременными, получавшими однокомпонентную схему лечения. В группе с ХАГ зависимости между схемой лечения и иммунологическими параметрами выявлено не было.
Среди пациенток с умеренной ПЭ и ПЭ на фоне ХАГ, получавших лечение в условиях отделения патологии беременных, нарастание симптомов ПЭ на фоне проводимой терапии отмечалось у 55 (37,4%) женщин, эффект от лечения наблюдался у 92 (62,6%) пациенток. Анализ клинических данных показал, что при поступлении в стационар беременные с отсутствием эффекта от АГТ имели в 100,0% случаев выраженные отеки нижних конечностей против 74,1% (р=0,01), статистически значимо более высокое среднее АД, по сравнению с беременными с эффектом от лечения. На фоне проводимой АГТ в 1-е сутки пребывания в стационаре среднее максимальное АД у женщин данной подгруппы сохранялось на статистически значимо более высоком уровне по сравнению с другой подгруппой, как и уровень суточной протеинурии. Показаниями для досрочного родоразрешения в данной подгруппе являлись неконтролируемая тяжелая АГ, появление церебральной симптоматики в виде стойких головных болей, протеинурии в суточной моче более 5 г/сутки.
Отсутствие эффекта от АГТ ассоциировалось также при поступлении в стационар со статистически значимо более высокими значениями СРПВэ и Еэ, с повышенным уровнем Ме относительно женщин с положительным эффектом от лечения; а также со статистически значимо более высоким относительным содержанием CCR2+ нейтрофилов в периферической крови.
Остальные изученные иммунологические и функциональные показатели не имели статистически значимых различий в зависимости от схемы применяемой АГТ и ее эффективности у беременных с умеренной степенью выраженности гипертензивных нарушений (р>0,05 во всех случаях).
Анализ данных обследования в зависимости от тактики ведения беременных с тяжелой ранней ПЭ, в том числе на фоне ХАГ, показал, что при поступлении в стационар в случаях активной тактики ведения, по сравнению с выжидательной тактикой, отмечены: более высокое систолическое АД, более частое наличие церебральной симптоматики в виде головных болей (35,7% против 12,5%; р=0,04). Во время 1-х суток пребывания в палате интенсивной терапии – более высокие уровни среднего минимального АД, протеинурии в разовой порции мочи, суточной протеинурии. Срок поступления в стационар пациенток обеих подгрупп не имел статистически значимых различий и составил 30,0 (27,2–31,3) недель в подгруппе с выжидательной тактикой и 30,5 (28,4–32,1) недель с активной тактикой ведения (р>0,05). Средний период пролонгирования беременности у женщин с выжидательной тактикой ведения составил 7 (5–10) дней, с активной – 24 (6–42) ч (минимальное время до родоразрешения составило 3 ч, максимальное – 48 ч).
При ретроспективном анализе иммунологических показателей выявлено, что уровень CD11b+ клеток в популяции нейтрофилов и относительное содержание CCR5+ лимфоцитов, определенные при поступлении в стационар, у пациенток с активной тактикой ведения были статистически значимо ниже, чем при выжидательной тактике ведения беременных с тяжелой ПЭ. Остальные изученные иммунологические и функциональные показатели не имели статистически значимых различий в зависимости от примененной тактики ведения беременных с тяжелой ранней ПЭ (р>0,05 во всех случаях).
Полученные результаты показали, что у пациенток с ХАГ, применявших комбинированную схему АГТ для достижения целевого уровня АД, отмечалась повышенная жесткость сосудистой стенки и преобладание симпатического тонуса, что нашло отражение в более выраженных клинических проявлениях. По данным литературы, при ХАГ происходит ремоделирование сосудистой стенки, увеличивается ее жесткость, что проявляется повышением СРПВэ и Еэ [14]. Просвет сосуда сужается, что является компенсаторным механизмом для поддержания постоянного кровотока в тканях при гипертензии; при этом активируется симпатический отдел вегетативной нервной системы (ВНС), осуществляющий регуляторную функцию тонуса сосудов [15, 16]. Полученные данные свидетельствуют также о более высокой жесткости сосудистой стенки и повышенной активности симпатического отдела ВНС при неэффективности АГТ умеренной ПЭ, в том числе у женщин с ХАГ. В ряде работ имеются сведения о более выраженных изменениях при присоединении ПЭ к ХАГ, что позволяет предположить дополнительное повреждающее воздействие патогенетических механизмов при ПЭ на уже измененную ранее сосудистую стенку, приводящее к утяжелению симптомов ПЭ. Преобладание симпатикотонии в регуляции сосудистого тонуса у этих пациенток можно расценить как напряжение компенсаторных возможностей при повышенной нагрузке на аппарат кровообращения. По данным некоторых исследователей, при ПЭ, в том числе тяжелой, происходит уменьшение вегетативного контроля симпатической нервной системы, что расценивается как угнетение адаптивных процессов [15].
Как показали наши исследования, применение иммунологических показателей предоставляет дополнительные возможности в оценке состояния беременных женщин с гипертензивными расстройствами с учетом особенностей развития воспалительной реакции, характерной для данной патологии [17]. Так, IL-8, являясь основным фактором хемотаксиса нейтрофилов, может способствовать развитию более выраженного нейтрофильного воспаления у женщин с ХАГ и присоединившейся ПЭ на уровне эндотелия сосудов, тем самым определяя необходимость применения комбинированной терапии для достижения целевого уровня АД. В группе с умеренной ПЭ наиболее значимым неблагоприятным эффектом обладал моноцитарный хемотаксический протеин-1 (MCP-1), уровень которого достоверно повышался при умеренной ПЭ и коррелировал с параметрами АД [12], показателями функции почек и печени [18, 19]. По нашим данным, повышенная экспрессия его рецепторов моноцитами сочеталась с необходимостью применения комбинированной схемы лечения, а дополнительное усиление его рецепции нейтрофилами ассоциировалось с неэффективностью АГТ, в том числе при ПЭ, развившейся на фоне ХАГ. MCP-1 преимущественно индуцирует запуск плотной адгезии клеток к эндотелию [20]. Усиление экспрессии CCR2 моноцитами и нейтрофилами при ПЭ создает условия для интенсивной миграции клеток в органы-мишени, в том числе и в местах поврежденного эндотелия сосудистой стенки, обусловливая ее выраженные нарушения, что приводит к неэффективности терапии ПЭ и утяжелению клинической симптоматики. Более того, CCR2 регулирует мобилизацию нейтрофилов во время ишемии–реперфузии в поврежденные участки [21, 22]. Активация нейтрофилов при их прохождении через реперфузированный орган способствует высвобождению медиаторов воспаления в поток крови, дренирующий реперфузированный орган, а затем и в отдаленные участки кровообращения [23]. Эти события создают условия для удаленного повреждения органов и проявления синдромов системного воспалительного ответа (SIRS) и полиорганной дисфункции (MODS). Особый интерес представляют данные о возможности применения выжидательной тактики ведения женщин с тяжелой ПЭ при повышенном уровне CCR5+ лимфоцитов в периферической крови. Вероятно, это определяется рекрутированием CCR5+ Treg в места повреждения органов-мишеней, предотвращая чрезмерную деградацию матрикса и ослабляя неблагоприятные эффекты воспалительных реакций [24].
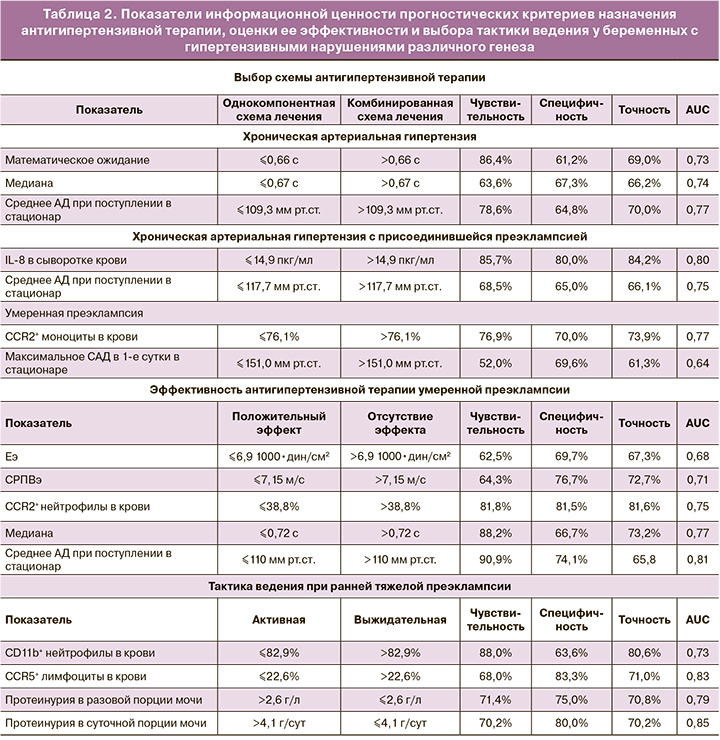
С целью обоснования персонифицированного подхода к назначению АГТ, оценки ее эффективности и выбора тактики ведения у беременных с гипертензивными нарушениями различного генеза при помощи одномерного математического ROC-анализа была рассчитана прогностическая ценность полученных клинических данных и результатов функционального и иммунологического обследования. Параметры, показавшие наилучшие информационные характеристики, представлены в табл. 2.
На следующем этапе статистической обработки данных полученные критерии были проанализированы при помощи многомерного анализа с применением логистической регрессии. В результате пошагового включения в математическую формулу всех прогностических критериев были получены следующие модели с наилучшими операционными характеристиками (табл. 3).

Модель № 1 для выбора схемы антигипертензивной терапии у пациенток с ХАГ можно представить в виде формулы:
P=1/(1+e-z),
где z = -18,372 + 0,111×Х1 + 0,077×Х2×100, где Х1 – уровень среднего АД при поступлении в стационар (мм. рт.ст.); Х2 – значение медианы (с). Трактовка полученных результатов производится следующим образом – при Р≤0,34 прогнозируется эффективность однокомпонентной антигипертензивной терапии; при Р>0,34 – отсутствие эффекта и необходимость назначения комбинированной терапии у пациенток с ХАГ.
В модели № 2 для выбора схемы антигипертензивной терапии у пациенток с ХАГ и присоединившейся ПЭ:
z = -12,910 + 0,084×Х1 + 0,240×Х2,
где Х1 – уровень среднего АД при поступлении в стационар (мм. рт.ст.); Х2 – значение сывороточного уровня IL-8 (пкг/мл); при Р≤0,58 прогнозируется эффективность применения одного антигипертензивного препарата; при Р>0,58 – отсутствие эффекта и необходимость назначения комбинированной терапии у пациенток с ХАГ и присоединившейся ПЭ.
Модель № 3 для выбора схемы антигипертензивной терапии у пациенток с умеренной ПЭ имеет значение:
z = -12,190 + 0,074×Х1 + 0,043×Х2,
где Х1 – относительное содержание CCR2+ клеток в популяции моноцитов (%); Х2 – уровень максимального систолического АД в течение 1-х суток пребывания в стационаре (мм рт.ст.); при Р≤0,34 прогнозируется положительный эффект однокомпонентной антигипертензивной терапии; при Р>0,34 – отсутствие эффекта и необходимость назначения комбинированной терапии у пациенток с умеренной ПЭ.
В модели № 4 для прогнозирования эффективности лечения умеренной ПЭ, в том числе у беременных с ХАГ:
z = -10,294 + 0,057×Х1 + 0,953×(Х2×10),
где Х1 – относительное содержание CCR2+ нейтрофилов в крови (%); Х2 – значение медианы (с). Трактовка полученных результатов производится следующим образом – при Р<0,5 прогнозируется положительный эффект от проводимой антигипертензивной терапии; при Р≥0,5 – отсутствие эффекта.
Модель № 5 для выбора тактики ведения при тяжелой ранней ПЭ, в том числе у пациенток с ХАГ, имеет значение
z = -0,325 — 0,0562×Х1 + 0,427×Х2,
где Х1 – 1 – относительное содержание CCR5+ лимфоцитов в крови ≤22,6%; 0 – относительное содержание CCR5+ лимфоцитов в крови >22,6%; Х2 – 1 – уровень суточной протеинурии >4,1 г/сут; 0 – уровень суточной протеинурии ≤4,1 г/сут; при Р≤0,53 прогнозируется положительный эффект от лечения тяжелой ранней ПЭ, возможна выжидательная тактика; при Р>0,53 – отсутствие эффекта терапии, рекомендуется применение активной тактики ведения.
Для быстрого расчета предложенных формул логистической регрессии на базе программы Excel были созданы калькуляторы для каждой модели. Числовые значения показателей вводятся в предлагаемые поля. Автоматически происходит расчет математической формулы, определяется значение Р (CutOff) от 0 до 1,0, которое появляется в соответствующем окне; затем оценивается результат по предложенному алгоритму. Разработанные математические модели легли в основу схемы персонифицированной терапии и тактики ведения беременных женщин с различными гипертензивными расстройствами.
Пример применения модели № 4: Пациентка Л., 30 лет, беременность 2-я, предстоят 2-е роды. Диагноз при поступлении в стационар: «Беременность 34 недели. Головное предлежание плода. ПЭ средней степени тяжести». При поступлении АД 150/95 мм рт.ст., пульс 80 ударов в минуту, протеинурия в разовой порции мочи 0,5 г/л, при повторном взятии через 6 ч – 0,6 г/л. Диагноз установлен на основании клинико-лабораторных данных, женщина госпитализирована в отделение патологии беременных. Состояние плода по данным обследования удовлетворительное. При иммунологическом и функциональном обследовании было установлено, что показатель содержания CCR2+ клеток в популяции нейтрофилов составил 51%, значение медианы – 0,8 с. При расчете формулы при помощи калькулятора на базе программы Excel получено значение Р=0,56. В данном случае прогнозируется отсутствие эффекта от лечения ПЭ средней степени тяжести. Начата АГТ с тщательным контролем за клинико-лабораторными показателями пациентки и внутриутробным состоянием плода. Через 3 дня диагностировано утяжеление ПЭ (отмечено нарастание протеинурии в суточной моче – 6,6 г/л, стойкая АГ 155–160/95–100 мм рт.ст., не поддающаяся коррекции с применением комбинированной схемы (АГТ)). Учитывая нарастание тяжести ПЭ, выполнено досрочное родоразрешение путем операции кесарева сечения в сроке беременности 34 недели 3 дня. Прогноз подтвердился.
Заключение
Предложенная схема персонифицированной терапии и тактики ведения беременных женщин с различными гипертензивными расстройствами позволит оптимизировать ведение данной категории пациенток, предотвратить тяжелые осложнения, встречающиеся при этой патологии, улучшить перинатальные исходы и качество последующей жизни женщин, страдающих ХАГ и перенесших гипертензивные нарушения во время беременности.



