Решающую роль в процессе имплантации эмбриона играет рецептивность эндометрия – комплекс структурно-функциональных характеристик эндометрия с четкими временными и пространственными константами, определяющими способность эндометрия к имплантации [1]. Эндометрий восприимчив к имплантации бластоцисты только в течение ограниченного периода времени «окна имплантации», период которого составляет несколько дней – примерно с 20-го по 24-й день нормального менструального цикла, на 6–10-й день после пика лютеинизирующего гормона ЛГ) 2–4]. Хорошо известно, что изменения уровней сывороточных гормонов в естественном менструальном цикле, которые предопределяют развитие эндометрия, значительно изменяются в стимулированных циклах программ экстракорпорального оплодотворения (ЭКО), в связи с чем «окно имплантации» может изменяться во времени или отсутствовать [5].
Влияние стимуляции суперовуляции на рецептивность эндометрия была показана в исследовании J.H. Check и соавт. (1992), в котором частота имплантации была значительно ниже у доноров ооцитов, чем у соответствующих по возрасту и качеству эмбрионов реципиентов [2, 6]. Доказательством негативного эффекта овариальной стимуляции на рецептивность эндометрия также является более высокая частота имплантации, клинической и прогрессирующей беременности в криоциклах ЭКО [7]. В исследованиях, оценивающих эндометрий в стимулированных циклах ЭКО в сравнении с натуральным циклом, были выявлены преждевременная секреторная трансформация и изменение экспрессии маркеров рецептивности в постовуляторную и раннюю лютеиновую фазы, что, возможно, приводит к несинхронному взаимодействию между жизнеспособным эмбрионом и рецептивным или субрецептивным эндометрием. Однако данные о влиянии овариальной стимуляции на эндометрий противоречивы. Так, результаты исследований A.J. evi и соавт. (2001), M.H. Van der Gaast и соавт. (2008) не выявили различий в экспрессии различных маркеров рецептивности эндометрия при сравнении натуральных и стимулированных циклов [8, 9].
Результатом овариальной стимуляции и одной из возможных причин негативного влияния на рецептивность эндометрия может быть повышение уровня сывороточного прогестерона P) в день назначения препаратов хорионического гонадотропина человека (ХГч) для финального созревания ооцитов [10, 11]. Этот феномен, получивший название «преждевременная лютеинизация» (ПЛ), является одной из причин низкой эффективности программ ЭКО и по разным данным осложняет 12,4–52,3% циклов с использованием аналогов гонадотропин-рилизинг гормона (ГнРГ) [12]. До настоящего времени не определен абсолютный уровень Р, позволяющий установить наличие ПЛ. Верхняя его граница по данным различных исследований колеблется от 0,8 до 2,0 нг/мл [12]. Остаются непонятными механизмы влияния на рецептивность эндометрия повышенных концентраций Р в день введения триггера. С. uang и соавт. (2012) показали, что продолжительное повышение концентрации Р приводит к преждевременному созреванию эндометрия и, как следствие, раннему закрытию «окна имплантации» и снижению частоты наступления беременности [13]. При этом высказано предположение, что именно продолжительность воздействия Р, а не его абсолютный уровень имеет решающее значение для адекватного функционирования «окна имплантации» [4, 13]. Более того, результаты исследования М. Melo и соавт. (2006), проведенного в программе донации ooцитов, показали, что на частоту наступления беременности реципиентов не влиял сывороточный уровень Р доноров в конце стимуляции, что также позволяет предположить неблагоприятное влияние ПЛ на эндометрий [11].
Отсутствие однозначных данных о влиянии ПЛ на рецептивность эндометрия послужило основанием для проведения настоящего исследования. Целью исследования была оценка влияния овариальной стимуляции и уровня сывороточного Р в позднюю фолликулярную фазу цикла в протоколах с агонистами ГнРГ на рецептивность эндометрия.
Материал и методы исследования
Основную группу составили 19 доноров ооцитов и 9 пациенток с трубно-перитонеальным и/или мужским факторами бесплодия, группу сравнения 22 пациентки с трубно-перитонеальным и/или мужским факторами бесплодия. Причиной для отмены переноса в лечебном цикле явились: у 4 пациенток – сохранение генетического материала и у 5 – проведение преимплантационной генетической диагностики.
Стимуляцию функции яичников проводили по стандартному длинному протоколу с использованием препаратов рекомбинантного фолликулостимулирующего гормона (рФСГ) и человеческого менопаузального гонадотропина (чМГ). В день введения овуляторной дозы ХГч 10000 МЕ для финального созревания ооцитов определяли сывороточную концентрацию Р. Использовали пороговое значение сывороточного уровня Р для определения преждевременной лютеинизации – 4,77 нмоль/л (1,5 нг/мл; коэффициент пересчета 3,18). Пороговое значение Р в день введения триггера овуляции было выбрано на основании данных литературы [14]. В зависимости от уровня Р в день введения ХГч пациентки основной группы были разделены: 1-я группа (n=13) – Р≥4,77 нмоль/л; 2-я группа (n=15) – Р<4,77 нмоль/л. Аспирационная пайпель-биопсия эндометрия проводилась из области дна матки с помощью аспирационной кюретки Pipelle de Cornier (Laboratoire C.C.D., Франция) в день забора ооцитов. День пайпель-биопсии эндометрия в группе сравнения определяли по пику ЛГ в мочевом тесте (ЛГ+7).
Проведено морфологическое и иммуногистохимическое (ИГХ) исследование 50 биоптатов эндометрия, в том числе 28 (основная группа) полученных в день аспирации ооцитов в лечебном цикле ЭКО без последующего переноса эмбрионов, и 22 (группа сравнения) – в натуральном цикле (день ЛГ+7).
Материалы биоптатов фиксировали в 10% нейтральном формалине в течение 24 ч. Образцы были обработаны по общепринятой стандартной методике и заключены в парафин. Срезы толщиной 4 мкм готовили на роторных микротомах и окрашивали гематоксилином и эозином. Исследование гистологических препаратов проводилось в световом микроскопе при увеличении от х50 до х600. Гистологическое датирование эндометрия, оценку процента клеток поверхностного эпителия с наличием зрелых пиноподий осуществляли в световом микроскопе при увеличении х400 в 5 полях зрения. ИГХ реакции проводили на серийных депарафинированных срезах толщиной 3–4 мкм по общепринятым методикам (DAKO protocols).
Определение стероидных рецепторов проводили с использованием мышиных моноклональных антител к ЭРα (клон 1D5 RTU«DAKO», Дания) и ПР-А (клон 636 RTU«DAKO», Дания). Для выявления экспрессии лейкемия ингибирующего фактора (ЛИФ) использовали первичные антитела к ЛИФ (R@DSystems, USA, clone: 9824, 1:100).
Анализ результатов ИГХ-реакций для эстрогеновых рецепторов (ЭРα) и прогестероновых рецепторов (ПР) проводили с учетом количества окрашенных клеток и интенсивности окраски в железах и строме эндометрия, используя метод гистологического счета Н-score по формуле: HS=1a±2b±3c, где а – процент слабо окрашенных клеток, b – процент умеренно окрашенных клеток, с – процент интенсивно окрашенных клеток; 1, 2, 3 – интенсивность окрашивания, выраженная в баллах.
Степень выраженности экспрессии ЭРα и ПР расценивали следующим образом: 0–10 баллов – отсутствие экспрессии, 11–100 баллов – слабая экспрессия, 101–200 баллов – умеренная экспрессия, 201–300 баллов – выраженная экспрессия. Рассматривали также коэффициент ПР/ЭР, рассчитанный по строме.
Пиноподии оценивались как изобилующие, умеренные и незначительные в зависимости от процента занимаемой ими поверхности эндометрия (>50, 20–50 и <20 соответственно).
Результаты ИГХ реакции для ЛИФ оценивали полуколичественным методом в баллах по общепринятой методике: отсутствие иммуноокрашенных клеток (-) – 0 баллов, менее 5% иммуноокрашенных клеток (±) – 0,5 балла, менее 20% иммуноокрашенных клеток (+) – 2 балла, от 20 до 40% иммуноокрашенных клеток (++) – 4 балла, более 40% иммуноокрашенных клеток (+++) – 6 баллов.
Датирование эндометрия проводили по критериям Noeyes [15]. День аспирации ооцитов расценивали как 14-й день условного 28-дневного цикла.
Информированное согласие на участие в исследовании было получено у всех пациенток.
Статистический анализ результатов проводили с использованием программы IPM SРSS Statistics, версия 21. Для сравнения непараметрических данных применяли метод Манна–Уитни (для 2 групп) для несвязанных совокупностей; критерий χ2 для таблиц сопряженности признаков 2*2, 2*3 и 2*4 (для сравнения частот встречаемости признаков в анализируемых группах). Результаты представлены как среднее ± стандартная ошибка среднего (М±m). Статистически значимыми считали отличия при р<0,05 (95% уровень значимости).
Результаты исследования
Анализ морфологической структуры эндометрия в стимулированном цикле показал, что в день аспирации ооцитов у большинства пациенток (75%) наблюдалась секреторная трансформация эндометрия. При этом ранняя стадия фазы секреции обнаружена у 15 (53,6%), средняя стадия фазы секреции – у 4 (14,3%) и поздняя стадия фазы секреции – у 2 (7,1%) пациенток. Средняя и поздняя стадия фазы пролиферации встретилась в 1 (3,6%) и 6 (21,4%) случаях соответственно. В «окно имплантации» естественного цикла преобладала средняя стадия фазы секреции (рис. 1 см. на вклейке).
При оценке поверхностного эпителия эндометрия было установлено, что в стимулированном цикле в день получения ооцитов пиноподии выявлялись в 100% случаев, из них у 26 (92,9%) – зрелые и у 2 (7,1%) – регрессирующие (рис. 2 см. на вклейке). В «окно имплантации» натурального цикла пиноподии также наблюдались во всех образцах эндометрия. При этом в стимулированном цикле среднее количество клеток поверхностного эпителия, содержащих пиноподии, составило 21,7±1,7%, что было сопоставимо с натуральным циклом в «окно имплантации» (22,8±3,1%; р=0,937).
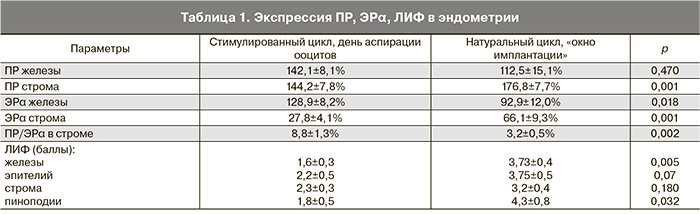
При ИГХ-исследовании эндометрия в день аспирации ооцитов наблюдалась умеренная и высокая экспрессия ПР в железах и строме эндометрия. В железах уровень колебался от 10 до 200% и составил в среднем 142,1±8,1%. В строме наблюдалась экспрессия ПР от 10 до 220%, среднее значение составило 144,2±7,8% (табл. 1).
Экспрессия ПР в железах в день аспирации ооцитов была сопоставима с натуральным циклом в «окно имплантации» (112,5±15,1; р=0,470), а в строме – существенно ниже (144,2±7,8 и 176,8±7,7; р=0,001). Показатели экспрессии ЭРα в железах эндометрия стимулированного цикла были умеренными, в строме – низкими (рис. 3 см. на вклейке).
Количество ЭРα в железах находилось в пределах от 20 до 180%, в среднем – 128,9±4,1%. В строме уровень ЭРα колебался от 4 до 70%, среднее значение составило 27,8±4,1%. В «окно имплантации» натурального цикла экспрессия ЭРα в железах колебалась от 5 до 200% (в среднем 92,9±12,0%), что было существенно ниже, чем в стимулированном цикле (р=0,018). В строме экспрессия ЭРα составила от 5 до 180% (в среднем 66,1±9,3%), что значительно превышало этот показатель в стимулированном цикле (р=0,001).
Коэффициент ПР/ЭРα в строме эндометрия стимулированного цикла в день аспирации ооцитов был значительно выше (8,8±1,3), чем в «окно имплантации» натурального цикла (3,2±0,5; р=0,002), что, вероятно, связано с высокой экспрессией ПР и низкой ЭРα.
В стимулированном цикле у 23 из 28 пациенток (82,1%) в день аспирации ооцитов была выявлена экспрессия ЛИФ (рис. 4). При этом экспрессия ЛИФ в поверхностном эпителии и в строме соответствовала аналогичному показателю в «окно имплантации» натурального цикла, а в железах и пиноподиях была существенно ниже (табл. 1).
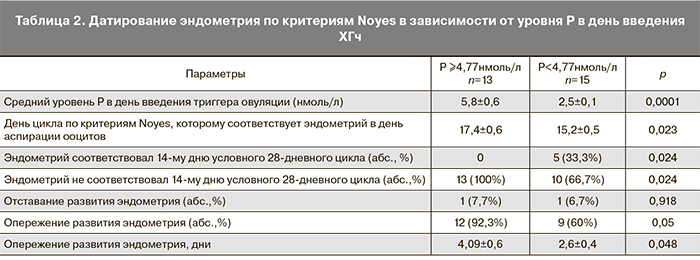
Таким образом, наличие секреторной трансформации эндометрия, обнаружение зрелых пиноподий, снижение экспрессии ЭР в строме, а также ранняя экспрессия ЛИФ в эпителии и строме в день аспирации ооцитов свидетельствует об опережении созревания эндометрия в стимулированных циклах. Эти данные подтверждаются результатами датирования эндометрия по критериям Noyes, согласно которым эндометрий в стимулированных циклах в день аспирации ооцитов в среднем соответствовал 16,29±0,4 дню условного 28-дневного цикла, опережая при этом на 3,2±0,4 дня.
Датирование эндометрия по критериям Noyes в зависимости от уровня Р в день введения ХГч показало, что у 5 (33,3%) пациенток с нормальным уровнем Р эндометрий в день аспирации ооцитов соответствовал дню цикла. При повышенном уровне Р у 1 из 13 (7,7%) пациенток наблюдалось отставание и у 12 из 13 (92,3%) – опережение развития эндометрия. У пациенток с повышенным уровнем сывороточного Р эндометрий в день аспирации ооцитов соответствовал 17,4±0,6 дню цикла, опережая развитие в среднем на 4,09±0,6 дня. При нормальном уровне Р эндометрий в этот день соответствовал 15,2±0,5 дню цикла, опережая развитие в среднем на 2,6±0,4 дня. При этом разница была статистически значима (табл. 2).
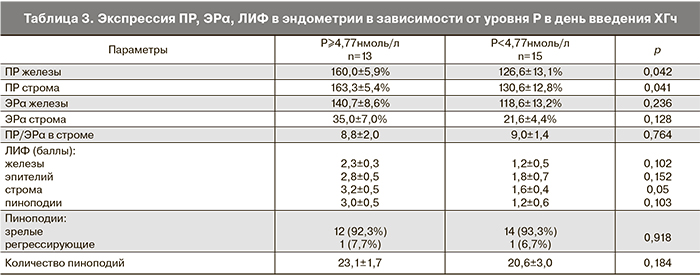
При анализе экспрессии рецепторов ПР и ЭРα в эндометрии в зависимости от уровня Р в день введения ХГч (табл. 3) выявлена статистически значимая разница экспрессии ПР в железах и строме. При нормальном уровне Р в день введения триггера овуляции экспрессия ПР в железах колебалась от 10 до 180%, в среднем 126,6±13,1%. В группе с повышенным уровнем Р – от 120 до 200% среднее значение составило 160,0±5,9% (р=0,042). При нормальном уровне Р в день введения триггера овуляции экспрессия ПР в строме находилась в пределах от 10 до 220% (среднее значение 130,6±12,8%), при повышенном Р – от 120 до 200% (среднее значение 163,3±5,4%; р=0,041).
Экспрессия ЭРα как в железах, так и строме была сопоставима между группами. Также не было выявлено различий в коэффициенте ПР/ЭРα в строме эндометрия (8,8±2,0 и 9,0±1,4; р=0,764). Экспрессия ЛИФ в строме эндометрия была существенно выше у пациенток в повышенным уровнем Р (3,2±0,5 и 1,6±0,4 балла; р=0,05). Зрелые пиноподии в день аспирации ооцитов выявлялись с одинаковой частотой у пациенток с нормальным и повышенным Р (93,3 и 92,3%; р=0,918).
Таким образом, оценка эндометрия в день аспирации ооцитов показала, что у пациенток с повышенным уровнем сывороточного Р в день введения триггера овуляции наблюдается опережение развитие эндометрия в среднем на 4,09±0,6 дня, ранняя экспрессия ЛИФ преимущественно в строме эндометрия, умеренная экспрессия ПР в железах и строме, появление зрелых пиноподий более чем на 20% поверхности эпителия.
Обсуждение
Одной из возможных причин неудач ЭКО может быть изменение рецептивности эндометрия в стимулированных циклах. Поскольку эффективность программы ЭКО во многом зависит от функциональной зрелости и готовности эндометрия к имплантации, а также от синхронизации с развитием эмбриона, то предполагают, что беременность не наступает при опережении развития эндометрия более чем на 3 дня [2, 16, 17].
В данном исследовании результаты гистологического датирования эндометрия по критериям Noyes в день аспирации ооцитов свидетельствуют об опережении развития эндометрия. При этом у пациенток с повышенным уровнем сывороточного Р в день введения ХГч имеет место опережение развития более, чем на 3 дня. Полученными данными можно объяснить снижение частоты наступления беременности в циклах с ПЛ. Большинство исследователей подтверждают опережение созревания эндометрия при проведении овариальной стимуляции. Так, E. Kolibianakis и соавт. (2002) выявили опережение развития эндометрия в среднем на 2,5±0,1 дня при стимуляции рФСГ в протоколе с антагонистом ГнРГ [17]. Результаты гистологического датирования эндометрия в исследовании I. Van Vaerenbergh и соавт (2009) показали, что во всех образцах эндометрия, полученных в день аспирации ооцитов, наблюдалось опережение развития эндометрия от +2 до +4 дней [18]. С другой стороны, в исследовании D. Kyrou и соавт (2009) в большинстве случаев эндометрий в день введения ХГч соответствовал поздней стадии пролиферации [19].
Известно, что в естественном менструальном цикле экспрессия в эндометрии рецепторов к стероидным гормонам претерпевает закономерные изменения, синхронные с изменением концентрации эстрадиола и Р в крови. В позднюю стадию фазы пролиферации естественного менструального цикла наблюдается максимальная экспрессия ПР и ЭРα в эндометрии [20]. Во время фазы секреции экспрессия ЭРα снижается во всех клетках эндометрия, а снижение ПР отмечено лишь в эпителиальных клетках, в то время как стромальные клетки поддерживают экспрессию ПР и сохраняют чувствительность к Р [2, 21]. При проведении стимуляции функции яичников умеренная экспрессия ЭРα в железах и низкая в строме эндометрия, выявленная нами в день аспирации ооцитов, свидетельствует о раннем снижении уровня ЭРα в строме и подтверждает мнение об опережении созревания эндометрия. При этом экспрессия ПР в железах в день аспирации ооцитов соответствовала таковой в «окно имплантации» натурального цикла и была существенно выше при повышенных уровнях Р в день введения триггера овуляции. Эти данные согласуются с результатами исследования Е. Рapanikolaou и соавт. (2005). Авторами при оценке эндометрия в позднюю фолликулярную фазу в циклах с антагонистом ГнРГ было показано, что экспрессия ЭРα и ПР в эндометрии в день введения ХГч сходна с таковой в первые дни лютеиновой фазы естественного цикла [21]. Однако данные об экспрессии стероидных рецепторов в эндометрии стимулированных циклов значительно варьируют от полного уменьшения их экспрессии до увеличения в железах [4]. Так, D. Kyrou и соавт. (2009) в фолликулярной фазе стимулированного цикла выявили повышенную экспрессию ПР во всех клетках эндометрия [19]. C. Bourgain и соавт. (2003) было обнаружено уменьшение экспрессии ПР в железах и строме в периовуляторную и лютеиновую фазы [4].
Об изменении экспрессии стероидных рецепторов при овариальной стимуляции в циклах ЭКО свидетельствует и высокое соотношение ПР/ЭРα, что не характерно для этой фазы цикла. По данным литературы коэффициент ПР/ЭРα в строме эндометрия в позднюю фазу стадии пролиферации натурального цикла не превышает 1, в «окно имплантации» находится в диапазоне от 2 до 4 [20].
Известно, что в естественном цикле пиноподии появляются на 6–8-й день после овуляции и присутствуют на поверхности эпителия полости матки не более чем в течение 48 часов [3, 22]. При этом появление пиноподий совпадает с увеличением уровня сывороточного Р и снижением количества ПР [20]. Обнаружение в данном исследовании зрелых пиноподий в день аспирации ооцитов на более чем 20% поверхности эпителия нами было расценено как достоверный признак опережения созревания эндометрия. Несмотря на то что образование пиноподий происходит под действием Р, отличий в формировании пиноподий в зависимости от уровня Р в день введения триггера овуляции мы не обнаружили. По данным различных авторов, появление пиноподий при стимуляции функции яичников значительно варьирует от 18-го до 22-го дня цикла, и в большинстве случаев зрелые пиноподии наблюдаются на 19-й день стимулированного цикла [23–25]. При этом M. Creus и соавт. (2003) при исследовании эндометрия в натуральном и стимулированном циклах у одной и той же пациентки не обнаружили различий в количестве пиноподий [26]. Подобную вариабельность появления пиноподий связывают с различным ответом каждой конкретной пациентки на стимуляцию суперовуляции [22]. Nikas и соавт. (1999) высказал предположение, что на количество пиноподий и продолжительность их существования стимуляция функции яичников не влияет [25]. По данным O.H. Develioglou и соавт. (1999), опережение эндометрия с точки зрения гистологического датирования, раннее уменьшение ПР в железах и ЭРα во всех клетках эндометрия коррелирует с более ранним появлением пиноподий в стимулированных циклах, что подтверждает концепцию сдвига окна имплантации вперед [27].
Подтверждением опережения развития эндометрия в стимулированных циклах можно считать и выявление умеренной экспрессии ЛИФ в эндометрии в день аспирации ооцитов, что соответствует «окну имплантации» естественного цикла. Известно, что экспрессия ЛИФ в фазе пролиферации натурального цикла минимальна, повышается после овуляции и достигает максимума в среднюю фазу секреции на 19–25-й день, снижаясь с началом менструации до базального уровня [3, 24]. Данные об экспрессии ЛИФ в стимулированных циклах ЭКО немногочисленны и противоречивы. Большинство исследователей обнаруживали снижение экспрессии ЛИФ. Так, Q.J. Chen и соавт. (2008) выявили снижение секреции ЛИФ в эндометрии стимулированных циклов [28]. В экспериментальных исследованиях на мышах при стимуляции суперовуляции в протоколах с агонистом ГнРГ также выявлено снижение экспрессии ЛИФ в эндометрии через 48 ч после введения ХГч в сравнении с естественным циклом [29]. С другой стороны, А. Arici и соавт. (1995) продемонстрировали отсутствие зависимости продукции ЛИФ от концентрации половых стероидов в сыворотке крови [29, 30]. Данных о зависимости экспрессии ЛИФ от уровня Р в день введения ХГч в доступной нам литературе мы не нашли.
Таким образом, стимуляция функции яичников и в частности феномен ПЛ оказывает негативный эффект на рецептивность эндометрия в циклах ЭКО. Опережение развития эндометрия и изменение экспрессии маркеров рецептивности приводит к асинхронному созреванию эндометрия и эмбриона, снижая тем самым частоту наступления беременности. Однако механизмы этих изменений остаются недостаточно изученными. Необходимо дальнейшее изучение и разработка наиболее оптимальных подходов предотвращения и коррекции негативного влияния стимуляции функции яичников на эндометрий в программах ЭКО.



