Беременность тройней относится к группе высокого риска и связана с осложнениями со стороны матери в виде преэклампсии (50%), анемии (44%), холестаза беременных (95,6%), послеродовых кровотечений (44%) [1]. Частота неонатальной смертности достоверно выше в группе трехплодных беременностей, по сравнению с одноплодной и двухплодной [2]. Применение вспомогательных репродуктивных технологий (ВРТ) и увеличение среднего возраста беременных женщин значительно повысили частоту многоплодия, в том числе беременностей тремя и более плодами [3]. В последние годы стремление к переносу только одного эмбриона привело к снижению частоты трехплодной беременности, которая колеблется от 0,3 до 0,7% [4, 5]. Однако в клинической практике стали встречаться многоплодные беременности со сложными вариантами плацентации возникшие в результате деления единственного перенесенного эмбриона [6–8]. Следует сказать, что и при спонтанной многоплодной беременности происходит поэтапное многократное деление эмбриона с формированием трех и более плодной беременности с разнообразными вариантами плацентации [9]. Монохориальная (МХ) тройня относится к редкой ситуации и встречается, по разным данным, с частотой 1:45 500–1:100 000 рождений, вызывая определенные трудности в диагностике [10]. На ранних стадиях деления бластоцисты в первые 15 дней может сформироваться такая патология многоплодной беременности, как синдром обратной артериальной перфузии (СОАП), относящаяся к бластопатиям. Частота встречаемости СОАП составляет 1:35 000 беременностей, 1:100 МХ двоен и 1:30 МХ троен.
При СОАП двойня представлена нормальным плодом, который является донором и часто в литературе называется плодом-помпой, и вторым плодом (акардиальный монстр, аморфус, акардиус и др.), который не имеет сердца либо имеет аномальное сердце, например, двухкамерное. Спектр описываемых пороков развития плода-акардиуса разнообразен: частичное или полное отсутствие свода черепа, голопрозэнцефалия, отсутствие лицевых структур, анофтальм, микрофтальм, расщелины губы и неба, отсутствующие или рудиментарные конечности, диафрагмальные дефекты, отсутствие легких и сердца, атрезия пищевода, дефекты передней брюшной стенки, асцит, отсутствие печени и желчного пузыря, отек кожи. Единственная артерия пуповины наблюдается в 75% случаев. В зависимости от аномалий развития существует несколько классификаций плода-акардиуса: гемиакардиус (hemiacardius), если сердце сформировано не полностью, и холокардиус (holocardius), если сердце отсутствует. Другая классификация: ацефалюс (acephalus), если голова отсутствует; анцепс (anceps), если голова плохо сформирована; акормус (acormus), если присутствует только голова и аморфус (amorphous), если плод представлен аморфной массой. Кровоснабжение акардиуса осуществляется через артериальные и венозные анастомозы за счет плода-помпы. Достаточно часто обе пуповины впадают в плаценту рядом, что подтверждается при морфологических исследованиях. Иногда пуповина акардиуса впадает прямо в пуповину плода-помпы [11]. СОАП ассоциируется с высокой перинатальной смертностью, прежде всего в связи с сердечной недостаточностью и неврологической патологией «нормального» плода. Среди акушерских осложнений часто встречаются многоводие, преждевременный разрыв плодных оболочек, преждевременные роды. Перинатальная смертность для здорового плода составляет 35–55% [12, 13].
Мы представляем собственный клинический опыт ведения двухплодных беременностей, осложненных СОАП, а также три клинических наблюдения МХ тройни с СОАП близнецов. В одном случае беременность наступила после применения экстракорпорального оплодотворения (ЭКО) и трансфера двух пятидневных эмбрионов, что затруднило постановку диагноза. В двух других клинических наблюдениях беременность наступила самопроизвольно.
Описание клинических наблюдений
Мы имеем собственный клинический опыт ведения беременностей с СОАП. В настоящее время это 25 случаев двойни и 4 – тройни. Все ультразвуковые исследования (УЗИ) проводились на сканерах Voluson 730 (GE) с использованием трансабдоминального конвексного (5 МГц) и трансвагинального (7 МГц) датчиков.
При всех двойнях беременность наступила самопроизвольно без применения ВРТ. Среди троен в 2 случаях было проведено ЭКО.
В 12 (41,4%) случаях диагноз СОАП был определен в I триместре. В 3 (10,3%) случаях плод-акардиус был пропущен и диагноз многоплодной беременности в I триместре не был установлен. В 9 (31,0%) случаях в I триместре плод-акардиус был принят за неразвивающуюся беременность и верный диагноз установлен только во II и III триместрах. В одном наблюдении правильный диагноз установлен в 27 недель, а ранее выявленные множественные врожденные пороки развития у второго плода (плода-акардиуса) правильно интерпретированы. Наш опыт ведения многоплодной беременности с СОАП включает оценку массы плодов с использованием формулы, предложенной Moore T.R. et al. (1990) [14], и хирургическое разделение кровообращения путем лазерной коагуляции пуповины плода-акардиуса [15]. Хирургическое разделение кровообращения плодов выполнено нами в 3 наблюдениях.
Согласно литературным данным, СОАП встречается в случаях как моноамниотической (МА) (25%), так и диамниотической (ДА) двойни [16]. В нашем наблюдении в 7 из 25 беременностей была МХ МА двойня, что составляет 28%.
Несмотря на редкость СОАП при наличии 3 и более плодов [17], мы также имеем четыре наблюдения. В одном случае установлена дихориальная триамниотическая (ДХТА) тройня после применения ЭКО. При динамическом наблюдении в 9, 10 и 12 недель на амбулаторно-поликлиническом этапе допущена диагностическая ошибка и установлен неверный диагноз внутриутробной гибели одного плода из МХ пары. При этом копчико-теменной размер (КТР) этого плода в динамике был 11, 24, 34 мм. Увеличение толщины воротникового пространства (ТВП) второго плода из МХ пары 4,5 мм оценено как риск по врожденному пороку сердца, в то время как увеличение ТВП было связано с сердечной недостаточностью у плода-помпы.
Однако особенно сложно выбирать акушерскую тактику при МХ тройне, и таких наблюдений у нас три.
Клиническое наблюдение № 1
Пациентка К., белоруска, 26 лет направлена в РНПЦ «Мать и дитя» для проведения консультации в связи с диагностикой врожденного порока развития (ВПР), выявленного у одного плода из двойни при ДХДА двойне. Настоящая беременность первая, наступила самопроизвольно. Беременность осложнилась кровянистыми выделениями из половых путей в 6 недель гестации. Брак первый, неродственный. Акушерско-гинекологический и семейный анамнез не отягощены. При УЗИ КТР 1 плода – 58 мм, ТВП 1 плода – 10,5 мм, КТР 2 плода – 70 мм, ТВП 2 плода – 0,9 мм. В описании указано, что в области шеи 1 плода визуализируется эхонеоднородное образование с жидкостным содержимым размерами 13×12 мм. Установлены два раздельных амниотических мешка с тонкой межамниотической перегородкой. Маловодие у 1 плода. Срок беременности по дате последней менструации 12 недель 6 дней. Установлен диагноз: ДХДА двойня. Гигрома шеи у одного плода. Проведено медико-генетическое консультирование, в ходе которого предложено прерывание беременности, от которого семья воздержалась. При контрольном УЗИ в 16 недель беременности в области шеи плода определялось многокамерное эхонеоднородное образование размерами 55×27 мм. Установлен диагноз: ДХДА двойня. Тератома шеи у одного плода. Резко выраженное маловодие. И только при УЗИ в сроке гестации 19 недель был правильно определен тип многоплодной беременности, которая оказалась МХДА тройней. Третий плод представлен частью позвоночника, грудной клетки и единственной бедренной костью длиной 16 мм (плод-акардиус, аморфус). При допплерометрическом исследовании фиксировался кровоток. После проведенного медико-генетического консультирования беременность была прервана во II триместре. При патоморфологическом исследовании: первый и второй плоды женского пола без ВПР, третий – акардиус, аморфус. Патоморфологическое исследование плодов массой менее 500 г проводилось в научно-исследовательской лаборатории цитогенетических, молекулярно-генетических и морфологических исследований РНПЦ «Мать и дитя». При проведении морфологического исследования плоды II триместра вскрывались по методике, описанной Шором Г.И., с полной эвисцерацией. Данное клиническое наблюдение является самым ранним (2007 г.). Аудит клинических случаев и диагностических ошибок при СОАП был выполнен нами позднее, результаты представлены в наших ранних публикациях [15].
Клиническое наблюдение № 2
Пациентка К., белоруска, 31 год. Постоянно проживает в Москве. Настоящая беременность первая, наступила в результате проведения ЭКО в одном из медицинских центров г. Москвы. Супруг пациентки чеченец, 36 лет страдает сахарным диабетом II типа. Со слов семьи, бесплодие связано с трубным фактором. При проведении ЭКО выполнен перенос двух эмбрионов на 5-е сутки. При УЗИ в 9 недель гестации диагностированы МХ МА тройня, анэнцефалия и саморедукция одного из плодов.
В сроке беременности 10 недель с признаками угрожающего самопроизвольного выкидыша, клинически проявившимися мажущими кровянистыми выделениями, пациентка была госпитализирована в гинекологическую больницу Минска. Для уточнения диагноза беременная была направлена в РНПЦ «Мать и дитя». При УЗИ определялись единственный хорион, расположенный по передней стенке матки, и три отдельные амниотические полости. Два плода соответствовали сроку беременности 11 недель 2 дня, третий плод имел сформированное туловище, головной конец, единственную нижнюю конечность. Сердце плода не визуализировалось. При допплерометрическом исследовании определялся кровоток в туловище и пуповине плода-акардиуса. В динамике осмотра четко фиксировалась двигательная активность плода-акардиуса. Таким образом, установлен диагноз: беременность 11 недель. Тройня. Монохориальная триамниотическая (МХТА). СОАП. Данное состояние при МХ тройне является исключительно редким событием, и подобных клинических наблюдений в мире описано мало [18–20].
В нашем случае беременность трехплодная, прогноз для жизни и здоровья плодов и тактика ведения беременности были не однозначны. В целом, учитывая установленный диагноз и продолжающиеся кровянистые выделения, высокий риск по акушерским осложнениям во II триместре, прогноз для беременности оценен как неблагоприятный. В связи с этим предложено прерывание беременности в I триместре, от которого семья отказалась.
Контрольное УЗИ выполнено в 14 недель, ранее декларированного срока (16 недель) по настоянию семьи. Установлено что два плода соответствуют сроку гестации 14 недель 6 дней (массой 89 г) и 15 недель 1 день (массой 102 г) и не имеют признаков сердечной недостаточности. Максимальная длина акардиуса – 53 мм, масса – 24 г. Поскольку определиться, какой из плодов является так называемой помпой, до момента появления эхографических признаков сердечной недостаточности невозможно, проведен расчет соотношения массы плода-акардиуса к обоим другим плодам, и оно составило 27 и 24% соответственно (рис. 1).
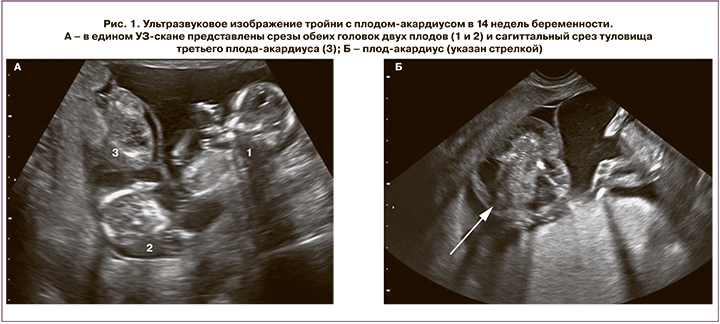
В сроке беременности 16 недель начали подтекать амниотические воды. При УЗИ установлено, что один из плодов массой 120 г соответствует сроку 15 недель 5 дней, ВПР не выявлено, второй плод массой 105 г по фетометрии выглядит на 15 недель 3 дня, третий плод-акардиус длиной 63 мм имеет массу 38 г. У второго плода определяется максимальный вертикальный карман 12 мм, что соответствует выраженному маловодию. При УЗИ через неделю установлено выраженное маловодие уже у двух плодов (рис. 2).

Учитывая неблагоприятный акушерский прогноз, повторно рекомендовано прерывание беременности, которое было выполнено одномоментно в 18–19 недель. Проведено патоморфологическое исследование постабортного материала (материал разрушен при кюретаже). Установлено, что первый и второй плоды женского пола без ВПР и соответствуют 17 неделям беременности; третий плод – холокардиус (holocardius), анцепс (anceps): свод черепа сформирован, анофтальм, носовые структуры и небо сформированы, рудиментарные верхние конечности, олигодактилия (слева – 2 пальца, справа – 3), монодактилия нижних конечностей. Отмечена деформация (полупозвонки) в грудном отделе позвоночника. Сердце в доставленном материале не обнаружено, имеются петли тонкого кишечника. При проведении молекулярно-генетического тестирования зиготности установлено монозиготное происхождение близнецов, что доказывает, что после трансфера двух пятидневных эмбрионов в период с 5-х по 8-е сутки, один из них поделился на три эмбриона с формированием МХТА тройни с бластопатией – СОАП, а второй не имплантировался. Молекулярно-генетическое исследование зиготности выполнялось в «Научно-практическом центре Государственного комитета судебных экспертиз Республики Беларусь» и заключалось в генотипировании ДНК с помощью STR-маркеров.
Клиническое наблюдение № 3
Пациентка К., белоруска, 33 лет обратилась в РНПЦ «Мать и дитя» для проведения комбинированного скрининга беременных для выявления группы высокого риска по синдрому Дауна. Настоящая беременность первая, наступила самопроизвольно. Брак для женщины первый, неродственный. Для супруга брак второй. В первом браке он имеет двоих здоровых сыновей. Акушерско-гинекологический и семейный анамнез не отягощены. Применение ЭКО и индукции овуляции семья категорически отрицает. Срок беременности по дате последней менструации 12 недель 1 день. При УЗИ установлен единственный хорион, расположенный по задней стенке матки, и три раздельных амниотических мешка с тонкими межамниотическими перегородками. Определялись два правильно сформированных плода, каждый из которых был расположен в отдельном амниотическом мешке, с КТР 1 плода – 64 мм, КТР 2 плода – 68 мм, и третий плод, представленный туловищем с головным и тазовым концом, единственной нижней конечностью. У всех трех плодов отсутствовало сердцебиение. Установлен диагноз: МХТА тройня. СОАП. Внутриутробная гибель плодов. Проведено медико-генетическое консультирование, и беременность прервана. При патоморфологическом исследовании установлено, что тройня была МХ. Первый и второй плоды женского пола без ВПР соответствовали сроку гестации 9 недель. Третий плод – гемикардиус, анцепс. Лицевые структуры не сформированы, анофтальм, аплазия верхних конечностей, сиреномиелия нижних конечностей. Имелось рудиментарное двухкамерное сердце с единственным сосудом, не имеющим клапанов. Другие внутренние органы не дифференцировались (рис. 3).

Обсуждение
Согласно литературным данным, акушерскую тактику ведения многоплодной беременности с СОАП следует планировать на основании оценки рисков для здорового плода (плода-помпы) и возможных акушерских осложнений. Moore T.R. et al. (1990) провели анализ исходов 49 случаев двойни с СОАП и установили, что в 18% случаев произошел спонтанный выкидыш, в 12% – плод-помпа замер внутриутробно, в 14% – проведена селективная редукция. Только 24% беременностей завершились рождением живого и зрелого ребенка, что составляет только 36% от всех беременностей, которые были пролонгированы. Прогноз для здоровья плода-помпы зависит от массы акардиуса и рассчитывается по формуле: масса (г)=-1,66×L+1,21×L², где L – максимальная длина акардиуса (см). Для оценки рисков имеет значение отношение массы акардиуса к массе плода-«помпы», выраженное в процентах [14].
При планировании акушерской тактики и оценке рисков для плодов при МХТА тройне ключевым моментом было определить, кто из плодов является плодом-помпой. Могут ли оба плода без ВПР быть так называемой помпой, и если это возможно, какова целесообразность проведения хирургического разделения кровообращения? Оценивать прогноз беременности при тройне, осложненной СОАП, не просто в связи с ограниченностью клинических наблюдений. К настоящему моменту в литературе описаны 15 клинических наблюдений, посвященных этому вопросу. Из них с МХ типом плацентации – 8 публикаций, включающих 9 наблюдений (таблица).
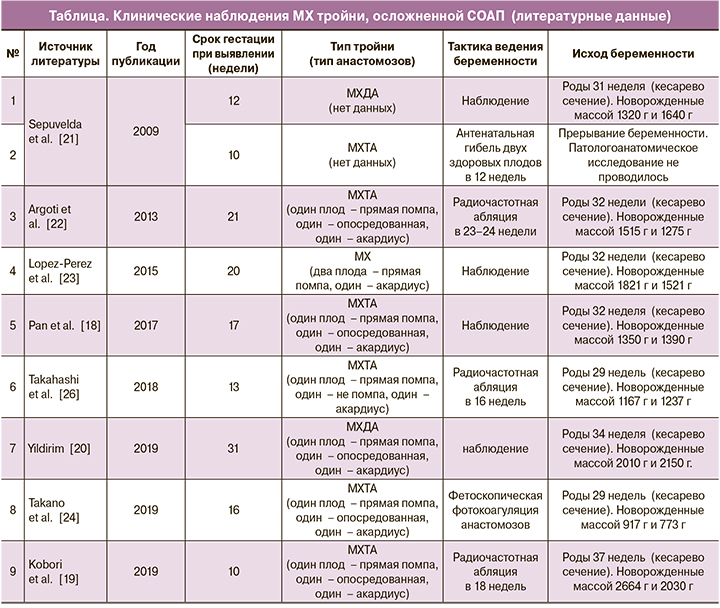
При анализе представленных публикаций видно, что авторы вводят понятия «прямой» помпы (плода, который непосредственно связан с плодом-акардиусом) и «опосредованной» (плода, имеющего плацентарные анастомозы с «прямой» помпой).
Pan P. et al. (2018) описали МХТА тройню с СОАП, диагностированную в 17 недель гестации. В 24 недели беременность осложнилась многоводием у одного из плодов («опосредованная» помпа) и завершилась родами в 32 недели мальчиками 1350 г и 1390 г и мертворожденным акардиусом с генерализованной водянкой массой 1460 г. При исследовании плаценты установлено, что пуповина акардиуса впадала в плаценту на расстоянии 0,5 см от пуповины первого плода («прямой» помпы) [18]. Yildirim E. (2019) описал МХДА тройню с СОАП, где плод-акардиус и плод-помпа имели общую амниотическую полость [20]. Как и в предыдущем случае, беременность была предоставлена естественному течению.
Учитывая неблагоприятный прогноз при МХ тройне с СОАП, в качестве тактик ведения рассматриваются прерывание беременности и хирургическое разделение кровообращения близнецов. В наших клинических случаях беременности завершились прерыванием до 22 недель гестации в связи с серьезными акушерскими осложнениями.
По данным литературы, частота благоприятных исходов беременности при двойне, осложненной СОАП, лучше у пациенток с внутриутробным разделением кровообращения [25]. Однако при обсуждении хирургического разделения кровообращения при трех и более плодах следует информировать пациентов, что при тройне, в отличие от двойни, технические сложности в ходе операции могут сделать ее невыполнимой. Кроме того, при окклюзии пуповины плода-акардиуса может произойти перераспределение кровотоков, что приведет к внутриутробной гибели всех трех плодов.
При планировании тактики ведения беременности необходимо понимать, а по возможности, прогнозировать, кто из плодов без ВПР может являться плодом-помпой. При анализе опубликованных 7 клинических наблюдений, где данный вопрос был исследован, установлено, что оба здоровых плода были помпой в одном случае; только один из здоровых плодов – также в одном случае; в 5 наблюдениях один из плодов направлял свою кровь по анастомозам («опосредованная» помпа) ко второму плоду без структурных аномалий («прямая» помпа), который затем – к плоду-акардиусу (таблица) [18, 22]. Таким образом, в 6 из 7 наблюдений, что составляет 85,6%, были задействованы оба плода без аномалий. В случае проведения коагуляции пуповины акардиуса вероятность внутриутробной гибели всех трех плодов велика, что в свою очередь говорит о необходимости с осторожностью применять данную технологию при МХ тройне. Именно поэтому в нашем клиническом наблюдении №2 при проведении медико-генетического консультирования в 11 недель мы не планировали внутриутробное хирургическое вмешательство в 16 недель, опасаясь гибели всех плодов. Как видно из таблицы, из 8 клинических случаев пролонгирования МХ беременности, в 4 оперативные лечебные мероприятия не проводились.
Тем не менее описаны наблюдения, где коагуляция пуповины при МХ тройне с СОАП выполнялась [22, 26]. В одном клиническом случае проведена фотокоагуляция артерио-артериальных и вено-венозных анастомозов между «прямой» помпой и акардиусом и четырех артерио-венозных анастомозов между прямой и опосредованной помпами. В данном клиническом наблюдении (№ 8 таблицы), через два дня после проведения лечебной процедуры начали подтекать воды. Подтекание околоплодных вод повторилось в 29 недель [24].
Kobori S. et al. (2019) описали МХТА тройню с СОАП. Плод-акардиус был представлен только нижней частью туловища. Авторы прибегли к методике ультразвуковой оценки допплерометрических кривых акардиуса и здоровых плодов, предложенной Takahashe Y. et al. (2018) [26]. При использовании допплерометрического исследования были установлены анастомозы между плодом-акардиусом и только одним из плодов без структурных аномалий, который был плодом-помпой. Проводилась оценка массы плода-акардиуса по описанной выше методике и установлено прогрессивное ее увеличение. Радиочастотная абляция сосудов пуповины плода-акардиуса выполнена в 18 недель, когда отношение масс акардиуса и «помпы» составило 70%, и появились признаки сердечной недостаточности и многоводие у плода-помпы. Беременность завершилась в 37 недель рождением мальчиков массой 2662 г и 2031 г. Исследование плаценты подтвердило анастомозы между пупочной артерией и пупочной веной плода-акардиуса и плода-помпы и сосудистые анастомозы между обоими плодами без структурных аномалий [19].
Как видно из таблицы, из 8 пролонгированных беременностей преждевременными родами завершились 7 (87,5%). Основной причиной для досрочного родоразрешения в 5 из 7 случаев стало преждевременное излитие околоплодных вод.
Заключение
Таким образом, несмотря на общее снижение частоты трехплодных беременностей, в клинической практике акушера-гинеколога стали появляться беременные женщины с тройнями с МХ типом плацентации и бластопатиями, к которым относится СОАП. В целом прогноз для течения и благополучного завершения беременности тройней с СОАП следует рассматривать как неблагоприятный. При продолжении беременности необходимо проводить расчет массы плода-акардиуса и его отношение к массам двух других плодов. Активный рост плода-акардиуса значительно ухудшает течение беременности и сопровождается многоводием и сердечной недостаточностью у плода-помпы, что является показанием для внутриутробного вмешательства. При планировании подобного вмешательства следует провести попытку допплерометрической оценки анастомозов по методике, предложенной в литературе [26], что позволит уточнить прогноз для здоровья и плода-помпы, и третьего плода и избежать рождения двух детей с кистозной энцефаломаляцией. В представленных нами клинических наблюдениях все МХТА тройни, осложненные СОАП, были прерваны до 22 недель гестации в связи с серьезными акушерскими осложнениями. Молекулярно-генетическое тестирование подтвердило монозиготное происхождение близнецов, а патоморфологическое исследование – тип плацентации, установленный при УЗИ.



