Для успешного развития беременности необходимо формирование иммунологической толерантности к клеткам плода, а также участие клеток иммунной системы в процессах имплантации и формирования сосудистой сети плаценты [1]. Нарушение механизмов становления иммунологической толерантности связывают с патогенезом репродуктивных патологий [2]. Одной из популяций клеток, вероятно вовлеченных в патогенез репродуктивных патологий являются естественные киллеры (natural killer cells, NK-клетки) [3]. Так, при лабораторном обследовании женщин с диагнозом привычное невынашивание беременности (ПНБ) выявлена высокая цитотоксичность NK-клеток, в модели in vitro, в отношении клеток трофобласта линии JEG-3. Показано, что этот параметр у пациенток с ПНБ превышал таковой у здоровых небеременных женщин [4, 5].
Данные о цитотоксичности NK-клеток у пациенток с бесплодием противоречивы. В ряде исследований описана повышенная по сравнению со здоровыми женщинами цитотоксичность NK-клеток, выделенных из периферической крови женщин с ПНБ и/или бесплодием [6, 7]. Однако метаанализ исследований, в которых оценивали роль NK-клеток в исходах экстракорпорального оплодотворения (ЭКО), не выявил различий в показателях живорождения у женщин с повышенной цитотоксической активностью NK-клеток по сравнению с женщинами с установленными в рамках нормы показателями цитотоксичности [8]. В то же время у женщин с бесплодием по сравнению со здоровыми женщинами, имевших в прошлом успешные беременности, установлена повышенная цитотоксичность NK-клеток периферической крови к клеткам линии K-562 [9].
Одним из препаратов, применяемых для преодоления бесплодия, связанного с иммунными факторами, являются иммуноглобулины для внутривенного введения (ВВИГ) [10, 11]. Показано, что применение ВВИГ при подготовке к процедуре ЭКО увеличивает вероятность успешной имплантации бластоцисты [10–12]. Однако точный механизм действия ВВИГ остается неясным. Предполагают, что он может влиять на цитотоксическую функцию NK-клеток [13, 14].
Одним из методов оценки цитотоксичности NK-клеток является оценка гибели клеток линии К-562 после их совместного культивирования с NK-клетками. Клетки линии К-562 являются стандартными клетками-мишенями, поскольку они не экспрессируют молекул локуса HLA, что делает их уязвимыми для естественных киллеров. Однако при беременности NK-клетки контактируют с другими клетками, в том числе с клетками трофобласта плода, которые экспрессируют на своей поверхности молекулы локуса HLA-C и неклассические молекулы локусов HLA E, G [15] и способны модулировать функции NK-клеток [16], что в значительной степени отличает их от стандартных клеток-мишеней. В связи с этим целью исследования явилась оценка влияния препарата ВВИГ на цитотоксичность NK-клеток к клеткам-мишеням линии К-562 и клеткам трофобласта линии JEG-3.
Материалы и методы
Клеточные линии
Использовали клетки линии NK-92 (ATCC, США). Эта клеточная линия выделена из костного мозга человека со злокачественной неходжкинской лимфомой. По основным фенотипическим и функциональным параметрам клетки линии NK-92 не отличаются от активированных NK-клеток [17]. Клетки культивировали в полной среде α-МЕМ («Биолот», Россия) с добавлением IL-2 (500 Ед/мл), согласно рекомендациям ATCC.
В качестве мишеней были использованы клетки хронической миелогенной лейкемии человека линии К-562 (ATCC, США) и клетки трофобласта линии JEG-3 (ATCC, США). Клетки линии К-562 культивировали в среде RPMI-1640 («Биолот», Россия) с добавлением 10% инактивированной FCS, 100 Ед/мл пенициллина и 2 мМ L-глутамина. Клетки линии К-562 не экспрессируют молекулы локуса MHC-I [18], в связи с чем эти клетки используют в качестве стандартных клеток-мишеней для оценки цитотоксичности NK-клеток.
Также использовали клетки линии JEG-3, по основным фенотипическим и функциональным параметрам соответствующие клеткам вневорсинчатого трофобласта [19]. Клетки культивировали в полной среде DMEM («Биолот», Россия), согласно рекомендациями ATCC.
Использовали также мононуклеары, которые выделяли из периферической крови стандартным методом центрифугирования в градиенте плотности фиколла ρ=1,077 («Биолот», Россия).
Пациенты
В исследование включены 2 группы женщин: здоровые небеременные женщины репродуктивного возраста с регулярным менструальным циклом без предшествующих беременностей (группа 1, n=10) и здоровые небеременные женщины репродуктивного возраста с регулярным менструальным циклом, у которых ранее были беременности, закончившиеся родами в срок, и в анамнезе отсутствуют неразвивающиеся беременности и/или самопроизвольные выкидыши (группа 2, n=12). Периферическую кровь собирали в секреторной фазе менструального цикла после контроля прохождения овуляции с помощью УЗИ. Для обеих групп были приняты одинаковые критерии исключения: наружный генитальный эндометриоз (3–4 стадия), антифосфолипидный синдром, аномалии развития половых органов, острые и обострение хронических заболеваний, наследственная форма тромбофилии высокого риска, сахарный диабет 1 и 2 типов, ожирение 2–3 степени, гормональная терапия, в том числе комбинированные оральные контрацептивы, отказ от участия в исследовании. Исследование одобрено локальным этическим комитетом ФГБНУ «НИИ АГиР им. Д.О. Отта» (протокол № 107 от 15.03.2021 г.). Получено информированное согласие пациенток на исследование, включающее согласие на обезличенный анализ полученных данных и их публикацию в общедоступных изданиях.
Препарат
Препарат ВВИГ, использованный в работе, имел стоковую концентрацию 50 мг/мл («Интратект» (Biotest, Германия)).
Оценку токсического действия препарата ВВИГ проводили в отношении клеток линий NK-92, К-562 и JEG-3. Для этого клетки линий NK-92 или К-562 помещали в круглодонные 96-луночные планшеты для суспензионных культур (Sarstedt, Германия) и осаждали с помощью центрифугирования (100g, 10 мин, 22°С), удаляя затем надосадочную жидкость. Затем к клеткам добавляли препарат ВВИГ, разведенный полной культуральной средой до концентраций (25 мг/мл, 12,5 мг/мл, 6,25 мг/мл, 3,175 мг/мл, 1,6 мг/мл, 0,8 мг/мл, 0,4 мг/мл, 0,2 мг/мл). Часть клеток культивировали без препаратов для определения базовой гибели клеток. Затем проводили оценку токсичности препарата ВВИГ в отношении клеток линии JEG-3.
Клетки инкубировали в планшетах в течение 24 ч при 37°С, СО2 5% во влажной атмосфере. Затем к клеткам добавляли раствор пропидия йодида (PI) в конечной концентрации 2 мкг/мл (Sigma-Aldrich, США) для определения относительного количества погибших клеток (PI+). Оценку проводили с помощью проточного цитофлуориметра FACSCanto II (BD, США). Пропидий йодид необратимо связывается с ДНК и под воздействием лазера (488 нм) проточного цитофлюориметра флюоресцирует с максимумом излучения около 615 нм. Пропидий йодид не способен преодолевать мембрану клетки, его флюоресценция характерна только для клеток с поврежденной поверхностной и ядерной мембранами. В связи с этим клетки, содержащие пропидий йодид (PI+), оценивали как мертвые.
Оценка цитотоксичности клеток линии NK-92 к клеткам линии К-562 в присутствии препарата ВВИГ
Клетки линии K-562 обрабатывали раствором 3,6 мкМ-ого 6-карбоксифлуоресцеин сукцинимидилового эфира (CFSE), являющегося флуоресцентным красителем, не вызывающим гибели клеток (Sigma-Aldrich, США). Затем в лунки круглодонного 96-луночного планшета (Sarstedt, Германия) вносили по 30000 клеток линии К-562 в 50 мкл полной среды α-МЕМ. Далее в эти же лунки добавляли 150 000 клеток линии NK-92 в 100 мкл полной среды альфа-МЕМ, достигая соотношения «эффектор:мишень» 5:1. Затем к клеткам добавляли препарат ВВИГ в концентрациях 12 мг/мл, 6 мг/мл, 3 мг/мл, 1,5 мг/мл, 0,8 мг/мл, 0,4 мг/мл и 0,2 мг/мл. К части клеток добавляли полную культуральную среду α-МЕМ без препарата для определения гибели клеток линии К-562 в присутствии NK-клеток. Кроме того, в каждом эксперименте проводили оценку базовой гибели клеток линии К-562.
Оценка цитотоксичности клеток линии NK-92 к клеткам линии JEG-3 в присутствии препарата ВВИГ
В лунки 96-луночного планшета к клеткам линии JEG-3, предварительно обработанным раствором CFSE (Sigma-Aldrich, США), помещали клетки линии NK-92 (BD, США). Использовали соотношение «эффектор:мишень» 5:1. Затем к клеткам добавляли препарат ВВИГ в концентрациях 6 мг/мл, 1,5 мг/мл и 0,375 мг/мл. Часть клеток прокультивирована без препарата для определения базовой гибели клеток трофобласта в присутствии NK-клеток. Также в каждом эксперименте проводили оценку базовой гибели клеток линии JEG-3.
Оценка цитотоксичности NK-клеток периферической крови к клеткам трофобласта линии JEG-3 в присутствии препарата ВВИГ
К клеткам линии JEG-3, обработанным CFSE, добавляли мононуклеары периферической крови в соотношении «эффектор:мишень» 10:1. Затем в лунки планшета вносили препарат ВВИГ в концентрациях: 12 мг/мл, 6 мг/мл, 1,5 мг/мл и 0,375 мг/мл. К части клеток была добавлена полная культуральная среда без препарата для определения гибели клеток трофобласта линии JEG-3 в присутствии мононуклеаров. Также в каждом эксперименте оценивали базовую гибель клеток линии JEG-3.
Анализ гибели клеток-мишеней после контактного взаимодействия с NK-клетками
После приготовления смеси клеток планшеты центрифугировали при 100 g в течение 3 мин, после чего планшеты помещали во влажную атмосферу (5% СО2, 37°С) и инкубировали в течение 4 ч. После инкубации клетки обрабатывали раствором пропидия иодида в концентрации 2 мкг/мл при 4°С в течение 10 мин. Анализ флуоресценции проводили на цитофлуориметре FACSCantoII (BD, США). Гибель клеток оценивали по наличию метки пропидия йодида (PI+).
Статистический анализ
Использована программа GraphPad Prism 8 (GraphPad Software, California, USA). Применяли тест Д'Агостино–Пирсона (D'Agostino–Pearson) для оценки распределения данных. Также проводили оценку наличия аномальных значений (outliers), таковых выявлено не было. Для сравнения групп применяли тест Краскела–Уоллиса (Kruskal–Wallis test) с последующим тестом множественных сравнений Данна (Dunn's post test). Данные представлены в виде боксовых диаграмм, построенных по значению медианы, верхнего и нижнего квартиля, минимальные и максимальные значения показаны отрезками выше и ниже бокса. Различия считали значимыми при р<0,05.
Результаты
Минимальная токсическая доза препарата ВВИГ в отношении клеток линий NK-92 и K-562 и JEG-3
Количество PI+ клеток линии NK-92 и клеток-мишеней линии К-562 в присутствии препарата ВВИГ в концентрации 25 мг/мл было выше, чем без препарата ВВИГ (рис. 1 А, Б). В более низких концентрациях, начиная с 12 мг/мл, гибель клеток NK-92 и К-562 не отличалась от базовой. На основании полученных результатов для экспериментов по оценке влияния препарата ВВИГ в кокультуре клеток линии NK-92 и клеток-мишеней линии К-562 использовали концентрации ВВИГ 12 мг/мл, 6 мг/мл, 3 мг/мл, 1,5 мг/мл, 0,8 мг/мл, 0,4 мг/мл и 0,2 мг/мл, так как они были меньше токсических.
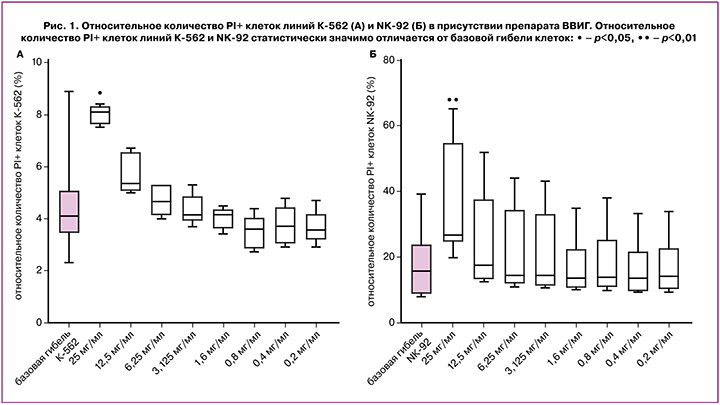
Оценивали также количество PI+ клеток линии JEG-3 в присутствии препарата ВВИГ в концентрациях 12 мг/мл, 6 мг/мл, 1,5 мг/мл и 0,375 мг/мл. В присутствии всех этих концентраций гибель клеток линии JEG-3 не отличалась от базовой.
Цитотоксичность клеток линии NK-92 к клеткам линии К-562 в присутствии препарата ВВИГ
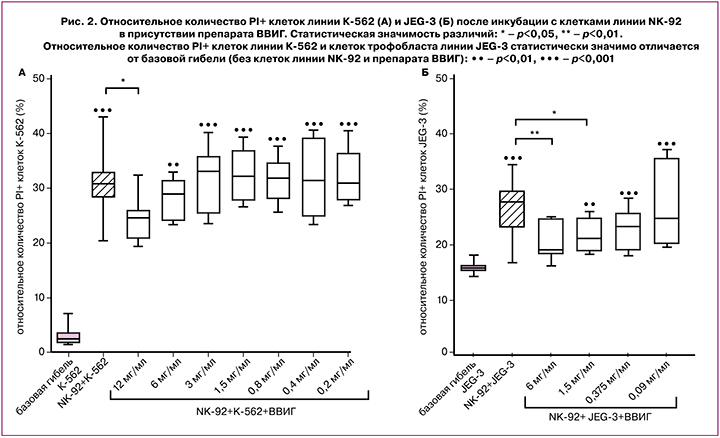
В присутствии NK-клеток относительное количество PI+ клеток линии К-562 было выше, чем в их отсутствие. В присутствии NK-клеток и препарата ВВИГ в концентрации 12 мг/мл относительное количество PI+ клеток линии К-562 было ниже, чем в случае инкубации с NK-клетками, но без добавления препарата, и не отличалось от значений базовой гибели клеток-мишеней (рис. 2А). В присутствии NK-клеток и препарата ВВИГ в меньших концентрациях относительное количество PI+ клеток линии К-562 было выше базовой гибели клеток (рис. 2А).
Цитотоксичность клеток линии NK-92 к клеткам линии JEG-3 в присутствии препарата ВВИГ
Относительное количество PI+ клеток линии JEG-3 в присутствии клеток линии NK-92 было выше, чем в их отсутствие. Установлено, что в присутствии клеток линии NK-92 и препарата ВВИГ в концентрациях 6 мг/мл и 1,5 мг/мл относительное количество PI+ клеток трофобласта линии JEG-3 было ниже, чем без препарата (рис. 2Б). В присутствии препарата ВВИГ в концентрациях 1,5 мг/мл, 0,375 мг/мл и 0,09 мг/мл количество PI+ клеток линии JEG-3 было выше, чем без NK-клеток и препарата. Так как в присутствии NK-клеток и препарата ВВИГ в концентрации 6 мг/мл количество PI+ клеток линии JEG-3 не отличалось от такового в отсутствие NK-клеток, эффект ВВИГ в концентрации 12 мг/мл не оценивали.
Цитотоксичность NK-клеток периферической крови фракции мононуклеаров к клеткам линии JEG-3 в присутствии препарата ВВИГ
Без добавления ВВИГ относительное количество PI+ клеток трофобласта линии JEG-3 в присутствии мононуклеаров периферической крови женщин группы 1 и группы 2 было выше, чем без ВВИГ и мононуклеаров (рис. 3 А, Б).
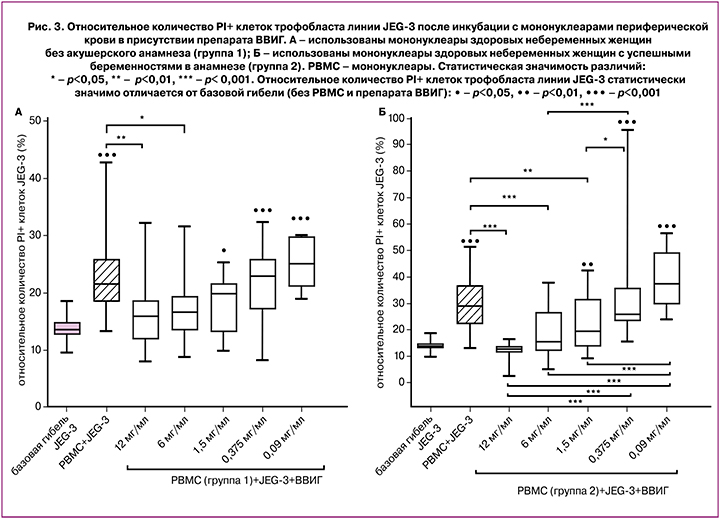
Установлено сниженное количество PI+ клеток трофобласта линии JEG-3, проинкубированных с мононуклеарами группы 1 и ВВИГ (12 мг/мл и 6 мг/мл), по сравнению с количеством PI+ клеток трофобласта, проинкубированных без ВВИГ с мононуклеарами (рис. 3А). В присутствии ВВИГ в концентрации 1,5 мг/мл, 0,375 мг/мл и 0,09 мг/мл и мононуклеаров группы 1 количество PI+ клеток трофобласта было выше, чем после инкубации без мононуклеаров и ВВИГ (рис. 3А).
Показано, что относительное количество PI+ клеток трофобласта линии JEG-3 снижено в присутствии мононуклеаров группы 2 и ВВИГ в концентрациях 12 мг/мл, 6 мг/мл и 1,5 мг/мл по сравнению с PI+ клетками трофобласта, проинкубированными с мононуклеарами, но без ВВИГ (рис. 3Б). В присутствии мононуклеаров группы 2 и препарата ВВИГ в концентрации 1,5 мг/мл, 0,375 мг/мл и 0,093 мг/мл относительное количество PI+ клеток трофобласта линии JEG-3 было выше, чем после инкубации в отсутствие ВВИГ и мононуклеаров группы 2 (рис. 3Б). Различий по эффектам препарата ВВИГ в концентрации 12 мг/мл, 6 мг/мл и 1,5 мг/мл на гибель клеток трофобласта в присутствии мононуклеаров не выявлено, в тоже время при использовании концентрации 0,375 мг/мл гибель клеток трофобласта была выше, чем при использовании концентрации 1,5 мг/мл, 6 мг/мл и 12 мг/мл. Кроме того, гибель клеток трофобласта в присутствии мононуклеаров и препарата ВВИГ в концентрации 0,09 мг/мл была повышена по сравнению с гибелью клеток в присутствии ВВИГ в концентрациях 1,5 мг/мл, 6 мг/мл и 12 мг/мл.
Обсуждение
При оценке непосредственного влияния препарата ВВИГ на клетки-мишени установлено, что, начиная с концентрации 12,5 мг/мл и ниже, препарат не оказывал токсического действия на клетки линии К-562. Кроме того, начиная с концентрации 12,5 мг/мл, препарат также не оказывал токсического действия на клетки-эффекторы линии NK-92. При оценке влияния этой концентрации на клетки линии JEG-3 токсических эффектов также не выявлено. На основании полученных данных нами были выбраны концентрации для дальнейшей оценки цитотоксичности клеток линии NK-92 в отношении клеток линии К-562 в присутствии ВВИГ. Установлено, что в присутствии NK-клеток и ВВИГ в концентрации 12 мг/мл клетки линии К-562 погибали в меньшей степени, чем без препарата.
Клетки трофобласта линии JEG-3 экспрессируют на поверхностной мембране молекулы локуса HLA-G, которые являются лигандами для ингибирующего рецептора NK-клеток KIR2DL4 [20]. Результатом этого взаимодействия является снижение цитотоксичности NK-клеток к клеткам трофобласта, а также секреция NK-клетками IFNγ [21], который способствует ремоделированию спиральных артерий и формированию плаценты [22]. Нами установлено, что in vitro в присутствии ВВИГ в концентрациях 6 мг/мл и 1,5 мг/мл снижена гибель клеток линии JEG-3 в случае инкубации с клетками линии NK-92. Таким образом, в присутствии препарата ВВИГ цитотоксичность NK-клеток была снижена как к стандартным клеткам-мишеням, так и к клеткам линии JEG-3, воспроизводящим основные свойства клеток экстравиллезного трофобласта. Использование модели контактного взаимодействия NK-клеток и трофобласта позволяет приблизиться к событиям в маточно-плацентарном комплексе, происходящим in vivo. Механизм влияния ВВИГ на клетки в настоящее время не определен. Ранее показано, что препараты ВВИГ у женщин с носительством антифосфолипидных антител оказывают цитопротективный эффект в отношении клеток эндотелия. Предполагают, что этот эффект обусловлен адсорбированием иммуноглобулинов на поверхностной мембране за счет образования ковалентных связей. Кроме того, возможно последующее проникновение ВВИГ в клетку, что вызывает изменение фенотипа эндотелиоцитов, а также ингибирование их прокоагулянтной активности и ингибирование активации системы комплемента [23]. Предполагаемым механизмом, обусловливающим цитопротективный эффект, является экранирование отрицательно заряженных мембранных фосфолипидов, так называемое «зонтичное» прикрытие [23]. Возможно, установленное нами снижение цитопатического влияния NK-клеток на клетки трофобласта также обусловлено формированием «зонтичного» барьера.
Следующим этапом исследования стала модель, в которой в качестве эффекторов использовали NK-клетки периферической крови в составе фракции мононуклеаров. Нами установлены результаты, схожие с полученными при использовании клеток линии NK-92: цитотоксичность NK-клеток снижена в присутствии ВВИГ (концентрации 12 мг/мл, 6 мг/мл и 1,5 мг/мл). Установленные нами результаты согласуются с данными литературы о снижении цитотоксической активности NK-клеток у пациенток с ПНБ после терапии ВВИГ [5, 11]. Выявленные изменения также могут быть связаны с «зонтичным прикрытием» клеток-мишеней, что предотвращает формирование иммунного синапса между NK-клеткой и клеткой-мишенью.
Кроме того, применение ВВИГ увеличивает экспрессию ингибирующих рецепторов CD94 NK-клетками периферической крови, что в свою очередь приводит к снижению цитотоксической активности NK-клеток периферической крови при ПНБ [13]. ВВИГ также могут влиять на экспрессию NK-клетками других белков. Показано, что NK-клетки экспрессируют ингибирующий корецептор Tim-3, который является маркером функционального истощения эффекторных Т-клеток [24]. Есть данные об участии Tim-3 в подавлении функциональной активности NK-клеток [25]. В присутствии ВВИГ экспрессия Tim-3 NK-клетками повышена по сравнению с его уровнем в отсутствие препарата [26].
Возможно, что ВВИГ также регулирует фенотип клеток-мишеней. Так, предполагают влияние ВВИГ на экспрессию белка суперсемейства иммуноглобулинов CD200 (OX-2) [27], который взаимодействует с рецептором CD200R и вызывает синтез миелоидными клетками индоламин-2,3-диоксигеназы. Это приводит к снижению пролиферации Т- и NK-клеток, а также стимуляции Т-регуляторных лимфоцитов [29]. Возможно, ВВИГ осуществляют опосредованное влияние на NK-клетки, способствуя таким образом поддержанию иммунологической толерантности и сохранению беременности [30]. Требуются дополнительные исследования изменений рецепторного профиля NK-клеток и клеток трофобласта под влиянием ВВИГ.
ВВИГ применяют для преодоления бесплодия, связанного с иммунными факторами [11]. Ранее установлена высокая эффективность терапии ВВИГ у пациенток с неудачами ЭКО, повышенным количеством и высокой цитотоксичностью NK-клеток в периферической крови, а также высокой экспрессией CD56 и HLA-DR NK-клетками и T-лимфоцитами. Так, у женщин, получивших ВВИГ, успешная имплантация наступала в два раза чаще, а показатели живорождения были в три раза выше по сравнению с таковыми у пациенток контрольной группы, не получавших ВВИГ [12]. Применение ВВИГ у пациенток с повторными неудачами имплантации c пониженным содержанием NK-клеток периферической крови вызывало улучшение показателей имплантации и живорождения в сравнении с аналогичной группой пациенток, не получавших ВВИГ [11, 12]. Полученные нами результаты позволяют предполагать непосредственное влияние ВВИГ на клеточные взаимодействия в децидуальной оболочке матки.
Заключение
Таким образом, цитотоксичность NK-клеток в отношении клеток трофобласта в присутствии препарата ВВИГ при контактном взаимодействии снижена. Требуются дальнейшие исследования возможности прогнозирования эффективности терапии ВВИГ пациенток с различными формами репродуктивной патологии.



