Эндометриоз является одним из наиболее распространенных гинекологических заболеваний, поражающих примерно 10% женщин репродуктивного возраста. Гистологически эндометриоз характеризуется наличием эндометриальных желез и стромы, морфологически сходных, но не идентичных эндометрию, за его пределами [1]. Это заболевание характеризуется наличием хронической тазовой боли, дисменореи, диспареунии, бесплодием и дисфункцией тазовых органов, что серьезно ухудшает качество жизни пациенток, оказывая негативное влияние на социальную и семейную сферу жизни [2]. Несмотря на многочисленные исследования, этиология и патогенез данного заболевания остаются не до конца изученными. К факторам, обеспечивающим выживание, имплантацию и пролиферацию клеток эндометрия, относят гормоны, факторы роста, цитокины и простагландины, клетки иммунной системы, стромальные клетки и эндотелиальные клетки сосудов [3]. Снижение активности цитотоксических Т-клеток и NK-клеток, изменение секреции цитокинов Т-хелперами и продукция аутоантител B-лимфоцитами играют существенную роль в развитии и прогрессировании заболевания [4]. Уточнение роли различных клеток иммунной системы при эндометриозе позволит разработать таргетную терапию для модулирования специфических функций иммунных клеток.
К молекулам межклеточных взаимодействий, которые могут играть важную роль в патогенезе данного заболевания, относят интерфероны (IFN) [5]. Среди интерферонов выделяют две группы: тип I (α и β) и тип II (γ). Основными функциями IFN являются модуляция функции клеток иммунной системы, регуляция апоптоза и ангиогенеза [6]. Описанные биологические эффекты интерферона являются многообещающими в поиске новых подходов в лечении эндометриоза, так как IFN оказывает иммуномодулирующее действие на различные компоненты иммунной системы, которые вовлечены в патогенез данного заболевания [7].
Ранее установлена эффективность человеческого IFN-α в лечении экспериментального эндометриоза у крыс, а также изучено его влияние в различных концентрациях на рост линий клеток эндометриомы in vitro [8–11]. Однако только в нескольких клинических исследованиях была исследована потенциальная роль IFN-α2b в терапии женщин с эндометриозом, и полученные результаты носили противоречивый характер [12, 13]. После интраоперационного введения в брюшную полость IFN-α2b больным с эндометриозом во время лапароскопии отмечалось уменьшение симптомов и степени распространенности заболевания, а также увеличивалась частота наступления беременности [12]. В другом исследовании внутрибрюшинное использование IFN-α2b способствовало рецидиву эндометриоза [13].
Таким образом, использование препаратов интерферонов в комплексной терапии эндометриоза представляется актуальным и требует дальнейшего изучения.
Целью исследования явились изучение изменений в клетках лимфоидной линии у пациенток с наружным генитальным эндометриозом (НГЭ), а также оценка эффективности применения IFN-α2b в комплексной терапии заболевания по сравнению со стандартной схемой лечения.
Материалы и методы
В исследование включены 46 пациенток с лапароскопически и гистологически подтвержденным диагнозом НГЭ I–II ст. Для оценки степени распространенности НГЭ была использована пересмотренная классификация Американского общества фертильности R-AFS. Всем пациенткам после операции назначали агонисты гонадотропин-рилизинг-гормона (аГнРГ) (Бусерелина ацетат, «Фарм-синтез» АО (Россия)) в течение 6 месяцев (1 инъекция в 28 дней). В дальнейшем больные были разделены на две группы. Первую группу (основную) составили 21 пациентка с НГЭ, которым одновременно с 1-й инъекций аГнРГ назначали рекомбинантный α2b-интерферон в свечах (Виферон, «Ферон» ООО (Россия)) 3 млн Ед ректально 2 раза в день в течение 10 дней; затем после 10-дневного перерыва проводили повторный курс иммуномодулирующей терапии. Вторую группу (группу сравнения) составили 25 больных НГЭ, получивших после оперативного лечения только терапию аГнРГ. Кроме того, была выделена контрольная группа (20 женщин), которым была произведена диагностическая лапароскопия в связи с бесплодием в рамках подготовки к протоколу экстракорпорального оплодотворения (ЭКО). У данной группы пациенток интраоперационно не было обнаружено ни НГЭ, ни прочих доброкачественных новообразований, ни острых или хронических воспалительных заболеваний органов малого таза.
Перед проведением оперативного вмешательства и через 6 месяцев после начала лечения в периферической крови (ПК) оценивали субпопуляционный состав лимфоцитов, содержание и активность NK-клеток. Эти показатели определяли на проточном цитофлуориметре FacsCanto II (Beckton Dickenson (BD), США). Исследование методом проточной цитометрии производили стандартным методом в общей фракции мононуклеарных клеток. Поверхностный фенотип клеток определяли с помощью моноклональных антител (МАТ), конъюгированных с флуорохромами: анти-CD3-FITC, анти-CD16-PE, анти-CD56-PE, анти-CD45-PerCP-Cy5.5, анти-CD4-PE-Cy7, анти-CD19-APC, анти-CD8-APC-Cy7, анти-CD16+56-PE, анти-CD3-PE-Сy7, анти-CD107a-Alexa Fluor®700 (BD, США). С помощью стандартных наборов (BD, США) определяли абсолютное и относительное содержание лимфоцитов с фенотипом CD3+ (Т-лимфоцитов), CD3+CD4+ (Т-хелперов), CD3+CD8+ (цитотоксических Т-лимфоцитов), CD19+ (В-лимфоцитов), CD16+CD56+ (NK-клеток). NK-клетки выделяли по фенотипу CD3-CD16+CD56+, NКТ-клетки – по фенотипу CD3+CD16+CD56+. Для анализа активности NK-клеток мононуклеары периферической крови выделяли на градиенте плотности фиколл-верографин (Sigma, США) стандартным методом. Затем мононуклеары инкубировали в пробирке 3 ч в культуральной среде RPMI-1640 (Sigma, США), 10% ЭТС (Sigma, США), 1% стрептомицина и пенициллина (Sigma, США), 1% глютамина (Sigma, США) во влажной атмосфере при 37°С и 5% CO2 в концентрации 1 млн кл/мл. Для оценки дегрануляции клеток использовали метод, предложенный G. Alter et al. [15]. Часть клеток от каждой пациентки инкубировали в присутствии антител к CD 107a (BD, США) и 8 мкг/мл монензина (BD, США). Вторую часть клеток от тех же пациенток инкубировали в присутствии антител к CD 107a, 8 мкг/мл монензина и стандартного реагента для активации лейкоцитов. Затем оценивали количество NK-клеток периферической крови, экспрессирующих CD107a-гликопротеин, ассоциированный с лизосомальными мембранами, отражающий степень активации NK-клеток в случае экспрессии их на поверхности клеточной мембраны. Активированные NK-клетки были разделены на спонтанно активированные (NKA-), то есть которые экспрессировали CD107a без воздействия реагента для активации, и индуцированно активированные (NKA+), которые, соответственно, экспрессировали этот антиген после добавления стандартного активатора. Экспрессия CD107a характеризует процесс активации NK-клеток, сопровождающийся дегрануляцией лизосом с последующим экспонированием на поверхности клеток LAMP-белка (Lysosomal assotiated membrane protein).
Статистическую обработку данных проводили с использованием методов непараметрического анализа. Накопление, корректировка, систематизация исходной информации и визуализация полученных результатов осуществлялись в электронных таблицах Microsoft Office Excel 2016. Статистический анализ проводился с использованием программы STATISTICA 13.3 (StatSoft, Россия). При проверке статистических гипотез уровень значимости принимался равным 0,05 (5%). Количественные показатели оценивали на предмет соответствия нормальному распределению, для этого использовали критерий Шапиро–Уилка (при числе исследуемых менее 50). Совокупности количественных показателей, распределение которых не отличалось от нормального, описывали при помощи среднего и доверительного интервала (ДИ) 95%, а в случае не нормального распределения – значений медианы (Me), нижнего и верхнего квартилей (Q1;Q3). Для сравнения независимых совокупностей использовали t-test и U-критерий Манна–Уитни. Для исследования динамики изменения показателей внутри групп использовали W-критерий Уилкоксона для зависимых выборок.
Результаты
Клинико-демографическая характеристика групп
Средний возраст пациенток в группе контроля составил 25,5±1,1 года (минимальный – 21,2 года, максимальный – 33 года). Регулярный менструальный цикл отмечался у 98% пациенток. Жалобы на боли в течение всего менструального цикла не предъявляла ни одна из пациенток. Основной причиной обращения явилось наличие первичного или вторичного бесплодия. У всех супружеских пар был установлен мужской фактор бесплодия.
В группу пациенток с НГЭ вошли 46 женщин в возрасте от 26 до 43 лет (средний возраст 31,3±1,4 года). У 29 (63%) пациенток, согласно пересмотренной классификации R-AFS, был установлен диагноз НГЭ I степени, у 17 (37%) больных – НГЭ II степени распространенности. Регулярный менструальный цикл отмечали у большинства (83%) пациенток. Основным симптомом, из-за которого женщина обращалась к гинекологу, являлась альгодисменорея, отмечавшаяся у всех пациенток. Вторым важнейшим клиническим симптомом эндометриоза являлось бесплодие, которое встречалось у 78% больных; при этом первичное бесплодие наблюдалось у 68% пациенток, доля вторичного бесплодия составила 32%.
У пациенток с НГЭ была оценена боль в области малого таза и выраженность диспареунии до лечения и через 6 месяцев после проведенной терапии. Учитывая, что подробная оценка динамики выраженности болевого синдрома у пациенток данных групп после терапии была проведена нами ранее [14], в настоящей статье будут представлены обобщенные результаты. Анализируя динамику тазовых болей и выраженность диспареунии у пациенток с НГЭ в обеих группах, обнаружено, что применение рекомбинантного IFN-α2b в комплексной терапии НГЭ сопровождалось более эффективным снижением выраженности болевого синдрома в области малого таза – на 90,5% по сравнению с группой сравнения – 76% соответственно (p<0,001). Боли, связанные с половым актом, также значительно уменьшились в группе больных НГЭ, получавших комбинированную терапию аГнРГ в сочетании с Вифероном, по сравнению с группой сравнения (85,7% и 80% соответственно, p=0,04).
Оценка субпопуляционного состава лимфоцитов, содержания NK-клеток и активности NK-клеток периферической крови
При анализе субпопуляционного состава лимфоцитов в ПК пациенток с НГЭ до начала лечения отмечено повышение уровня NKT-клеток с фенотипом CD3+CD16+CD56+ в 2,3 раза при сравнении относительных величин и в 2,4 раза – при сравнении абсолютных величин относительно группы контроля. При этом различий между уровнем СD3, CD19, CD4, CD8, а также NK-клеток с фенотипом CD3-CD16+CD56+ в обеих группах обнаружено не было. Содержание NK-клеток, экспрессирующих 107А, как спонтанно активированных (NKA), так и индуцированно активированных (NKA+), также не различалось в группах (рис. 1).
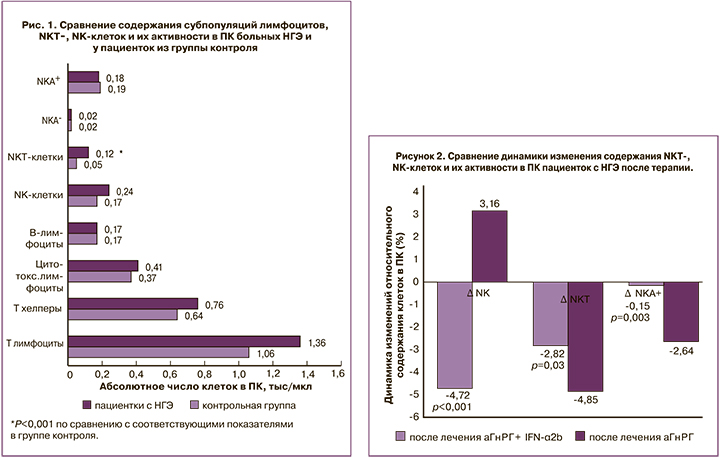
Была проведена проверка двух сравниваемых групп пациенток с НГЭ до начала лечения на однородность с использованием W-критерия Уилкоксона. Было установлено, что группы пациенток с НГЭ до начала терапии не различались ни по одному из исследуемых показателей. После комбинированной терапии НГЭ аГнРГ в сочетании с IFN-α2b отмечено статистически значимое увеличение в ПК абсолютного числа клеток с фенотипами CD3+, CD3+СD4+, CD3+CD8+, в 1,1, 1,1 и 1,2 раза соответственно, а также относительного количества клеток с фенотипом CD3+, CD19+ в 1,1 и 1,1 раза соответственно по сравнению с этими показателями до оперативного лечения. Нами также установлено снижение относительного количества NK- и NKT-клеток после лечения в 1,3 раза и 1,9 раза соответственно и снижения абсолютного числа NKT-клеток в 1,8 раза после терапии (таблица).
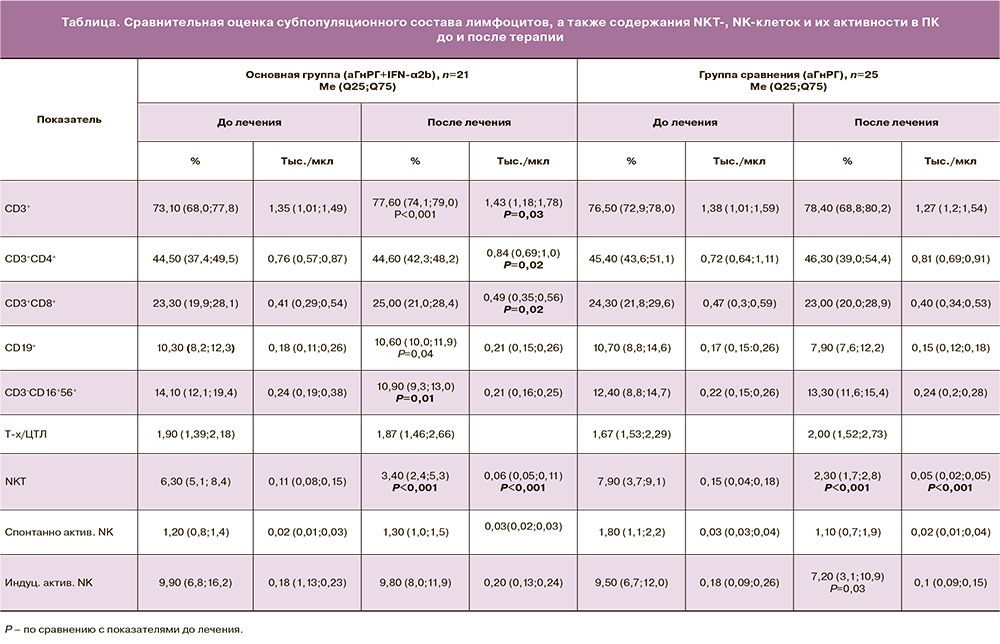
У пациенток, получавших монотерапию аГнРГ, было отмечено снижение абсолютного и относительного числа NKT-клеток в 3 и 3,4 раза соответственно, а также обнаружено снижение абсолютного количества NKА+ в 1,3 раза по сравнению с его содержанием до терапии. Не обнаружено различий в содержании в ПК клеток с фенотипами CD3+, CD3+СD4+, CD3+CD8+, СD19+ и NK-клеток до и после применения монотерапии гормональным препаратом (таблица).
При сравнении динамики изменения исследуемых показателей после лечения в обеих группах нами были получены следующие данные: ΔNK-клеток (относительное содержание) в ПК пациенток после комбинированной терапии аГнРГ совместно с IFN-α2b составило -4,72 (95% ДИ -7,36;-2,07), а в группе с монотерапией аГнРГ – ΔNK-клеток – 3,16 (95% ДИ -0,68;7,01). ΔNKT-клеток (относительное содержание) в обеих группах после лечения имелоотрицательную динамику, но в большей степени – в группе сравнения, и составило -4,85 (95% ДИ -7,15;-2,56). В основной группе ΔNKT-клеток равнялось -2,82 (95% ДИ -4,37;-1,27). ΔNKA+ (относительное содержание) также имело отрицательную динамику как при применении аГнРГ совместно с интерферонсодержащим препаратом, так и при монотерапии аГнРГ: -0,15 (95% ДИ -0,42;0,1) и -2,64 (95% ДИ -4,38;-1,23) (рис. 2).
Обсуждение
Эндометриоз – это хроническое заболевание, ассоциированное с болевым синдромом и снижением фертильности [15]. Основным механизмом, приводящим к возникновению болевого синдрома, является персистирующая воспалительная реакция, характеризующаяся нарушениями в различных звеньях иммунитета и в дисбалансе между содержанием про- и противовоспалительных цитокинов [16].
На системном уровне основными клетками, играющими роль в распознавании и последующей элиминации эндометриоидных гетеротопий, являются NK-клетки и эффекторные лимфоидные клетки, непосредственно обеспечивающие иммунный ответ: Т-хелперы, цитотоксические Т-лимфоциты, В-лимфоциты [3].
Согласно полученным нами данным, у пациенток с НГЭ до начала лечения отмечено повышение уровня NKT-клеток по сравнению с количеством этих клеток у пациенток из группы контроля. NKT-клетки являются минорной субпопуляцией Т-лимфоцитов, экспрессирующей как маркеры NK-клеток (CD16, CD56), так и Т-клеточные антигены (CD3), играющей ключевую роль в регуляции иммунного ответа при поражении организма патогенами, при аутоиммунных реакциях и опухолевых заболеваниях [17]. NKT-клетки обеспечивают быстрый эффект в индукции цитотоксического клеточноопосредованного ответа с помощью секреции IFN-γ, который вызывает активацию неспецифической цитотоксичности других клеток врожденного иммунитета: NK-клеток и макрофагов. Кроме того, IFN-γ способствует индукции Тh1-зависимого адаптивного иммунного ответа с образованием эффекторных цитотоксических лимфоцитов, индуцирующих апоптоз чужеродных клеток [18]. Согласно результатам нашего исследования, число NKT-клеток у пациенток с эндометриозом было повышено относительно пациенток контрольной группы, однако количество NK-клеток, их активность (NKA и NKA+), а также содержание цитотоксических лимфоцитов не различались по сравнению с группой контроля. Это может свидетельствовать в пользу недостаточной стимуляции NKT-клетками цитотоксических лимфоцитов и активности NK-клеток, следствием чего является отсутствие своевременного распознавания и элиминации эндометриоидных гетеротопий.
IFN-α, являясь одним из основных факторов врожденного иммунитета, участвует в первую очередь в неспецифическом иммунном ответе, формируя защитный барьер на пути проникновения вирусов и бактерий, а также останавливает пролиферацию опухолевых клеток намного раньше специфических защитных реакций иммунитета [19]. Установлено, что IFN I типа способствуют синтезу IL-15 макрофагами для последующей пролиферации и дифференцировки NК-клеток. Интерферон-α усиливает таксис NК- и CD8-лимфоцитов в очаг инфекции, повышает в них экспрессию перфориновой мРНК и стимулирует их литическую активность в отношении опухолевых клеток [20]. Также интерфероны I типа являются активными участниками специфического иммунного ответа. При вирусных инфекциях и онкологических заболеваниях IFN-α/β прежде всего контролируют развитие иммунного ответа по пути Тh1 [20, 21]. По данным литературы, IFN I типа играет важную роль в дифференцировке и активации CD4+, CD8+ лимфоцитов [22]. Установленное нами повышение общего количества Т-лимфоцитов (CD3+), а также Т-хелперов (CD3+CD4+), цитотоксических (CD3+CD8+) и В-лимфоцитов (СD19+) на фоне комбинированной терапии с применением IFN-α2b-содержащего препарата и отсутствие изменения этих показателей у пациенток после монотерапии аГнРГ не противоречит представленным выше данным о влиянии IFN 1 типа на специфический иммунный ответ. В совокупности с данными, полученными нами ранее, о влиянии IFN-α2b-содержащего препарата в составе комбинированной терапии НГЭ на выраженность болевого синдрома [14], изменения субпопуляционного состава лимфоцитов свидетельствуют в пользу реализации адекватного иммунного ответа в отношении клеток эндометриоидных гетеротопий.
NK-клетки представляют собой лимфоциты врожденной иммунной системы, которые способны убивать клетки-мишени без предварительной иммунизации и секретировать цитокины, которые участвуют в формировании адаптивного иммунного ответа и восстановлении тканей. До настоящего момента ученые не пришли к консенсусу в отношении количественного содержания NK-клеток как в перитонеальной жидкости, так и в ПК при НГЭ [23]. Однако было доказано, что пациентки с НГЭ имеют сниженную цитотоксическую активность естественных киллеров как в перитонеальной жидкости, так и в ПК, причем это снижение коррелирует со стадиями заболевания [24]. Сниженная активность NK-клеток является важным фактором, который способствует имплантации, выживанию и пролиферации эмигрировавших в брюшную полость эндометриальных клеток [25]. В нашем исследовании установлено снижение содержания NK-клеток у пациенток, получавших генно-инженерный IFN, что может свидетельствовать о более благоприятном перераспределении эффекторных клеток из периферической циркуляции к патологическому очагу в области малого таза. Сохранение цитотоксической активности (NKA+) естественных киллеров у пациенток основной группы, по сравнению со снижением числа NKA+ у женщин, получавших монотерапию аГнРГ, свидетельствует о том, что меньшее число NK-клеток обладает большей цитотоксической активностью, что в совокупности с клиническими данными, полученными нами ранее [14], свидетельствует в пользу адекватного противоопухолевого иммунного ответа. Это может быть одной из причин снижения частоты рецидивов заболевания в дальнейшем. Представленные результаты противоречат более ранним данным литературы о влиянии терапии аГнРГ на NK-клетки, согласно которым лечение препаратом данной группы увеличило число и активность естественных киллерных клеток в ПК пациенток с НГЭ. Однако в этом же исследовании показано, что низкая активность NK-клеток во время лечения аГнРГ и через 6 месяцев после терапии была связана с высокой частотой возникновения рецидивов заболевания [4]. Кроме того, в литературе описано снижение цитотоксической активности NK-клеток при воздействии аГнРГ in vitro [26]. IFN-α2b обладает иммуномодулирующей функцией, а именно повышает активность NK-, NKT-клеток, цитотоксических лимфоцитов. Это находит отражение в полученных нами данных в отношении NKT-клеток. Так, снижение количества NKT-клеток в ПК после терапии в основной группе менее выражено, чем в группе сравнения (р=0,03). Это говорит о возможной реализации IFN своих биологических свойств.
Заключение
Таким образом, в нашем исследовании еще раз продемонстрировано, что иммунная система играет ключевую роль в развитии эндометриоза за счет нарушения в функционировании NKT-клеток и, как следствие, отсутствия своевременного распознавания и элиминации эндометриоидных гетеротопий. Повышение количества общего числа Т-лимфоцитов, Т-хелперов, цитотоксических и В-лимфоцитов, а также снижение числа NK-клеток при сохранении их активности на фоне комбинированной терапии с применением IFN-содержащего препарата свидетельствуют в пользу реализации адекватного иммунного ответа в отношении клеток эндометриоидных гетеротопий, а также о возможном протективном действии IFN в отношении возникновения рецидивов заболевания. В связи с этим включение в комплексную терапию иммуномодулирующего IFN-α2b-содержащего препарата является патогенетически обоснованным.



