Преэклампсия (ПЭ) встречается в 2–8% всех случаев беременности и до сих пор остается одной из ведущих причин смертности и постнатальной заболеваемости как матери, так и плода [1–4]. Причины и механизмы патологии на сегодняшний день недостаточно изучены, однако все больший интерес исследователей вызывает изучение нарушения функционирования цитотрофобласта, а именно важнейших органелл клетки – митохондрий. Митохондрии – это двумембранные полуавтономные органеллы клетки, отвечающие за клеточное дыхание, в результате которого осуществляется синтез главной энергетической валюты клетки – аденозинтрифосфата (АТФ). Митохондрии обладают собственным геномом, представляющим собой кольцевую двуспиральную молекулу, кодирующую 37 генов и наследуемую по материнской линии. На внутренней мембране митохондрий располагаются комплексы электрон-транспортной цепи, которые в ходе окисления органических соединений, поступающих в клетку, перекачивают протоны в межмембранное пространство, генерируя трансмембранный потенциал. На завершающих этапах дыхания протоны по градиенту концентрации проходят в митохондриальный матрикс через комплексный белок АТФ-синтазу, который фосфорилирует аденозиндифосфат с образованием АТФ. Весь процесс носит название окислительного фосфорилирования, в результате которого происходит синтез АТФ и восстановление одной молекулы кислорода до двух молекул воды [5]. В ходе нормального метаболизма кислорода в митохондриях происходит образование так называемых активных форм кислорода (АФК), обладающих в большинстве случаев на внешнем электронном уровне неспаренным электроном. Контроль над продукцией АФК или их инактивацией осуществляют специальные белки антиоксидантной защиты. Баланс в количестве АФК и активность антиоксидантных агентов определяет наличие или отсутствие окислительного стресса клетки и органа. Роль АФК двойственна – существуют примеры, где наличие АФК необходимо: иммунный ответ, индукция апоптоза для элиминирования трансформированной клетки [6, 7]. Однако АФК могут нанести серьезный урон всем внутриклеточным системам: вызвать повреждения в структуре ДНК, белков, полиненасыщенных жирных кислот, инактивировать ферменты [8, 9]. Ученые сходятся во мнении, что плацента при ПЭ подвержена окислительному стрессу. Ввиду этого исследования структуры и функциональной активности митохондриального аппарата плаценты становятся как никогда актуальными.
Первые предположения о связи митохондрий с патологией ПЭ были выдвинуты еще в 80-х годах прошлого столетия [10]. С тех пор предложенные гипотезы получили десятки экспериментальных подтверждений. В одной из первых статей, посвященных системному анализу ультраструктуры клеток, Shanklin и соавт. отметили, что в клетках плацентарных биопсий при ПЭ наблюдается повышенное число разрывов митохондриальной мембраны в центральной области органеллы по сравнению с клетками плаценты при нормальной беременности [11].
В работе Saldago и соавт. сравнивалось 10 плацент от женщин с ПЭ и 10 плацент после нормальных родов, и было показано, что клетки цитотрофобласта при ПЭ обладали сильно вакуолизованными митохондриями без крист [12].
Что касается анализа состояния окислительного стресса, то заслуживает внимания одна из первых работ, проведенных по данной тематике исследователями Wang и Walsh [13]. При сравнении 8 плацент из группы ПЭ с 8 контрольными плацентарными биопсиями они отмечали значимое увеличение уровня малонового диальдегида (МДА), маркера перекисного окисления полиненасыщенных жирных кислот. При стимуляции важнейшего белка антиоксидантной системы – супероксид дисмутазы – не было замечено различий в уровне ее активности в сравниваемых группах. Схожие результаты получили Can и соавт.: в их работе проводилось сравнение 32 плацент от женщин с ПЭ и 31 плаценты после нормальных родов [14]. Авторы наблюдали значимое увеличение уровня МДА в группе с ПЭ. При анализе общего антиоксидантного статуса путем добавления в пробу раствора перекиси они не обнаружили различий между группами. Те же эффекты относительно уровня МДА, но в плазме крови получили D’Souza и соавт. [15]. В своем исследовании они анализировали различные маркеры окислительного стресса как в крови, так и в плаценте у 148 женщин с нормальной беременностью и 63 с ПЭ. Было показано, что уровень экспрессии гена глутатион пероксидазы, белка, отвечающего за восстановление окисленных липидов и перекиси водорода, в плацентах из группы с ПЭ был достоверно ниже, чем в норме. Следовательно, наличие окислительного стресса в плаценте при ПЭ является признанным фактом, что подтверждается в многочисленных литературных обзорах [16–20] (рисунок).
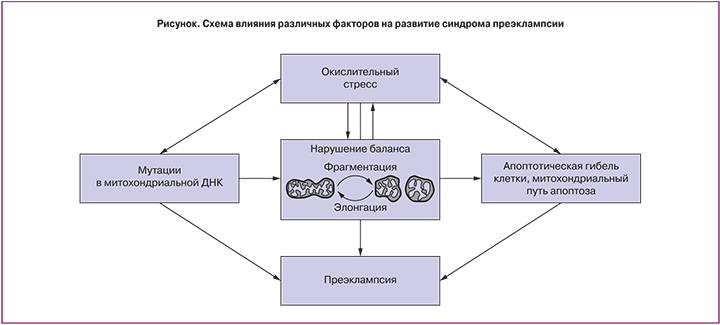
Вместе с тем, до сих пор нет однозначного мнения о роли мутаций в митохондриальной ДНК (мтДНК) в развитии ПЭ. Ding и соавт. провели секвенирование мтДНК из ткани плаценты у 30 пациенток с ПЭ и 38 женщин с нормально протекающей беременностью и показали, что уровень несинонимичных замен (приводящих к замене аминокислоты) в белок-кодирующих генах мтДНК выше в группе с ПЭ, особенно в гене пятой субъединицы первого комплекса дыхательной цепи NADH-дегидрогеназы (MT-ND5) [21]. В работе середины 90-х годов прошлого века Folgero и соавт. показали, что мутация в гене транспортной РНК (тРНК) лейцина ассоциирована с ПЭ [22]. Laat и соавт. подтвердили данный результат, они проанализировали осложнения беременности и исходы у женщин с мутацией в гене тРНК лейцина (m.3243A>G), данная мутация часто ассоциирована с синдромом MELAS (Mitochondrial encephalomyopathy, lactic acidosis, and stroke-like episodes). У 12% пациенток наблюдалась ПЭ, у 25,3% произошли преждевременные роды [23]. Негативное влияние мутаций в мтДНК на функциональную активность дыхательной цепи не вызывает сомнений, особенно в таком важном для реоксигенации органе, как плацента. Однако, несмотря на приведенные примеры, список работ по данной тематике сильно ограничен, и, безусловно, этот вопрос требует дальнейшей проработки.
Митохондрии, помимо своей основной функции, также участвуют в реализации сложноорганизованного процесса регулируемой клеточной гибели – апоптоза. Апоптоз является АТФ-зависимым событием. Клетки плаценты подвергаются апоптозу в течение всего периода нормально протекающей беременности, что позволяет контролировать дифференцировку трофобласта и обмен веществ в системе мать-плод. Сигнальный каскад, реализуемый с помощью митохондрий и приводящий к смерти клетки, называют митохондриальным путем апоптоза. Исследования свидетельствуют о существенной роли апоптоза клеток трофобласта при ПЭ [17, 24].
Can и соавт. в своей работе наблюдали повышение экспрессии проапоптотического белка APAF-1 в образцах плаценты при ПЭ [14]. Tomas и соавт. в своем исследовании не наблюдали значимых различий в экспрессии белков Bax и Bcl-2, участвующих в образовании митохондриальной поры для последующего высвобождения проапоптотических факторов, однако общий уровень апоптоза в образцах группы ПЭ был значимо выше, чем в контроле [25].
Стоит отметить, что в литературе существуют разногласия и противоречия в данных не только касательно уровня апоптоза в плаценте, но и в целом экспрессии генов. Это может быть связано с разницей в методе сбора материала исследователями. Существуют две точки зрения относительно этого вопроса. В ключевой статье Sood и соавт. приведены данные о разнице в профилях экспрессии большой панели генов в зависимости от участка взятия плацентарной биопсии [26]. Для одной группы исследователей эта публикация послужила поводом для объединения фрагментов ткани из разных участков (pooling) в один с целью получения информации об экспрессии интересующего гена в целом. Для другой группы ученых, занимающихся исследованием плаценты, – причиной взятия пробы исключительно из одного и того же места с целью снижения погрешности. Авторы данного обзора придерживаются последней точки зрения.
Всестороннее изучение плаценты и ее митохондриального аппарата, а не только связанного с ним окислительного стресса, поможет по-новому взглянуть на проблему ПЭ.
В последние годы интерес ученых представляет изучение динамики структуры митохондрий (их фрагментации и элонгации), системы контроля качества и селекции при различных заболеваниях. Участие белков, ответственных за митохондриальное слияние, в патологии ПЭ было показано Yu и соавт. [27], а также авторами данного обзора [28]. Динамичность митохондриома цитотрофобласта позволяет реализовать адекватный ответ на изменения состояния плаценты – уровень кровоснабжения, состояние гипоксии, окислительного стресса. Данная тематика касательно динамичности митохондриального ретикулума представляет особый интерес еще и ввиду того, что многие белки-участники слияния и фрагментации митохондрий также задействованы и в других процессах, происходящих в клетке. Яркий тому пример – это белок митохондриальный мембраны OPA1, участвующий в регуляции элонгации митохондрий, апоптозе, поддержании кальциевого гомеостаза, селекции мтДНК [29–32]. Может случиться, что через десятки лет станет возможно использовать таргетную терапию для лечения ПЭ путем модулирования работы белков, участвующих в слиянии и фрагментации митохондрий.
Заключение
В настоящее время одной из ведущих причин в развитии ПЭ, являющейся мультисистемной патологией, становится нарушение в системе антиоксидантной защиты, приводящее к выраженному окислительному стрессу. Причиной окислительного стресса, в частности, может быть нарушение работы митохондрий, обеспечивающих ключевые звенья энергетических и дыхательных процессов в клетках. Тщательное изучение структурно-функциональных изменений данных органелл в плаценте при ПЭ приблизит нас к пониманию механизмов возникновения и развития изучаемой патологии.



