Эндометриоз выявляется у 5–15% женщин репродуктивного возраста. Одна из наиболее частых причин обращения больных эндометриозом за врачебной помощью – бесплодие, которым страдают от 25 до 50% пациенток с данным заболеванием. Эндометриоз выявляется у 58% женщин, подвергшихся лапароскопии как конечному этапу обследования по поводу бесплодия. Точная патофизиология бесплодия при эндометриозе не установлена, предполагается многофакторное воздействие генетически и морфологически измененной эндометриоидной ткани на органы репродуктивной системы [1, 2].
Среди разнообразных факторов, определяющих бесплодие или субфертильность у женщин, наиболее важным является истощение пула остаточных фолликулов яичника. Недавние исследования подтверждают снижение овариального резерва у пациенток с генитальным эндометриозом, независимо от локализации эндометриоидных гетеротопий [3, 4]. Механизм снижения овариального резерва при глубоком инфильтративном эндометриозе до настоящего времени не установлен.
В последние годы широко обсуждаются общие свойства эндометриоза, особенно его инфильтративных форм, с раком: неконтролируемый рост и многоочаговость эндометриоидных имплантов, сниженный апоптоз, метастазирование в лимфатические узлы и распространение внутри и за пределы брюшной полости, проникновение в окружающие ткани, стимулирование неоангиогенеза, хронический воспалительный процесс и оксидативный стресс [5–8].
В эндометриоидных имплантах выявляются генетические и эпигенетические мутации, участвующие в онкогенной трансформации. Усиленный ангиогенез, а также снижение способности к апоптозу, необходимые для роста клеток, являются важнейшими признаками злокачественной опухоли, которые также обнаруживаются и в тканях глубокого инфильтративного эндометриоза [9, 10].
Нарушение регуляции апоптоза при эндометриозе в последние годы рассматривают, как одну из причин снижения овариального резерва при данном заболевании вследствие преждевременной активации примордиальных фолликулов и раннего их истощения [11].
Цель исследования: изучить молекулярно-генетические предикторы и состояние овариального резерва у пациенток с инфильтративной формой наружного генитального эндометриоза.
Материалы и методы
Проведено исследование «случай-контроль», включавшее 120 пациенток репродуктивного возраста, проходивших лечение на базе гинекологического отделения ФГБУ «Уральский научно-исследовательский институт охраны материнства и младенчества» Минздрава России в период с 2019 по 2021 гг. с соотношением числа контролей к случаю 1:1,4. Основную группу составили 70 пациенток репродуктивного возраста, прооперированных по поводу глубокого инфильтративного эндометриоза. У всех пациенток, вошедших в основную группу, диагноз был верифицирован гистологически. В группу сравнения вошли 50 фертильных пациенток репродуктивного возраста без наружного генитального эндометриоза, которым были выполнены пластические операции на матке. Критериями сопоставления групп были пол, возраст, антропометрические данные, социальный статус пациентов, а также предстоящее органосохраняющее оперативное лечение на органах малого таза без вмешательства на придатках.
Протокол исследования был утвержден на заседании локального этического комитета (протокол №5 от 08.10.2019 г.). Все пациентки подписали письменное информированное согласие на участие в настоящем исследовании и публикацию результатов исследования.
Проведен анализ соматического и гинекологического анамнеза, менструальной и репродуктивной функций, а также особенностей клинической картины заболевания у пациенток обеих групп.
С целью оценки состояния овариального резерва у пациенток обеих групп на 2–5-й дни менструального цикла проводилось определение уровня антимюллерова гормона (АМГ), фолликулостимулирующего гормона (ФСГ) и эстрадиола в крови методом иммуноферментного анализа на иммунохимическом анализаторе Access 2 (Beckman Coulter, США) с использованием реагентов того же производителя в соответствии с инструкцией, а также подсчет количества антральных фолликулов в яичниках при трансвагинальном ультразвуковом исследовании (УЗИ), выполненном в раннюю фолликулярную фазу на аппарате Voluson 8 (General Electric, США).
Критериями сниженного овариального резерва, согласно Болонским рекомендациям Европейского общества репродукции человека и эмбриологии (ESHRE), являлись: количество антральных фолликулов менее 5–7 в одном ультразвуковом срезе и концентрация сывороточного АМГ менее 0,5–1,1 нг/мл [12].
Для формирования прогностической модели заболевания всем пациенткам после включения в исследование проводили молекулярно-генетическое типирование полиморфных вариантов генов, кодирующих белки, участвующие в регуляции апоптоза (C-KIT: 2600 G>A, KITLG: 80441 C>T, TP53: Ex4+119 G>C (Arg72Pro) и ангиогенеза (VEGF-A: +12143 C>А, VEGF-A: -2578 C>A, VEGF-A: -634 G>C, VEGF-A: +936 C>T) с использованием комплекта реагентов ООО «ТестГен», Россия. ДНК выделяли из 0,5 мл венозной крови, взятой в пробирку с этилендиаминтетраацетатом (ЭДТА) в качестве антикоагулянта; использовали реагенты «Проба ГС-Генетика» (ООО «НПО ДНК-Технология», Россия). Для оценки количества выделенной геномной ДНК применяли набор реагентов контроля взятия материала для метода полимеразной цепной реакции (ПЦР) (ООО «НПО ДНК-Технология», Россия). Для исследования брали не менее 1,0 нг геномной ДНК на реакцию. Генотипирование образцов по аллельным вариантам исследуемых генов проводили методом аллель-специфичной ПЦР в режиме реального времени со снятием кривых плавления продуктов амплификации. Анализ результатов ПЦР проводили в автоматическом режиме программного обеспечения детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия).
Статистический анализ
Статистическую обработку данных производили с использованием статистического пакета программ Microsoft Excel (2010), SPSS Statistics версия 22.0 (IBM Microsoft, США), Multifactor Dimensionality Reduction 2.0 beta 8. Расчет размера выборки проводили с использованием калькулятора мощности на основании данных о количестве больных глубоким инфильтративным эндометриозом, имеющим носительство полиморфизмов генов-регуляторов апоптоза и ангиогенеза [13]. При принятии уровня значимости р<0,05, доверительном интервале 95% и мощности исследования 80%, общий размер выборки составляет 120 пациентов. В случае подчинения распределения признака закону нормального распределения и равенства дисперсий в сравниваемых группах данные представляли в виде среднего арифметического (М) и стандартного отклонения (SD). Проверку статистических гипотез об отсутствии межгрупповых различий количественных признаков в независимых группах осуществляли с использованием процедуры однофакторного дисперсионного анализа (ANOVA). При отклонении распределения признака от закона нормального распределения, данные представляли в виде медианы (Ме) и нижнего и верхнего квартилей: 25-го и 75-го процентилей (Q1;Q3). Определение достоверности различий между подгруппами пациенток по частотам генотипов и аллелей проводили с помощью критерия χ2. Силу ассоциаций оценивали в значениях показателя отношения шансов (OШ) с 95% доверительным интервалом (ДИ). Тест на соответствие распределения генотипов закону Харди–Вайнберга в обеих выборках проводили с помощью критерия χ2 с использованием программы Hardy–Weinberg equilibrium.
Для учета влияния полиморфных генетических маркеров использовалось несколько моделей риска. Общая (аддитивная) модель предполагает, что пенетрантность (ожидаемое значение признака) у гетерозигот лежит между значениями пенетрантности для обеих гомозигот. При анализе с использованием общей модели по отдельности оцениваются частоты «дикого» гомозиготного, гетерозиготного и полиморфного генотипов. Мультипликативная модель предполагает, что пенетрантность зависит от количества копий предрасполагающего аллеля, в исследуемых группах оценивается частота по отдельности каждого вариантного аллеля («дикого» или полиморфного). Доминантная модель предполагает, что полиморфный аллель является доминантным, и его значение проявляется при гетеро- и гомозиготном носительстве – оценивается суммарная частота гетерозигот и полиморфных гомозигот. Рецессивная модель предполагает, что полиморфный аллель является рецессивным, и что влияние на пенетрантность проявляется только для полиморфных гомозигот, в исследуемых группах сравниваются частота полиморфных гомозигот и суммарная частота гетерозигот и «диких» гомозигот [14, 15].
Межгенные взаимодействия оценивали с использованием биоинформатического метода сокращения многофакторной размерности (MDR), позволяющим оценивать все двухфакторные, трехфакторные и четырехфакторные модели комбинаций SNP, выбирая наилучшие модели, характеризующиеся наименьшей ошибкой предсказания и наивысшей воспроизводимостью. Окончательный уровень значимости р для наилучшей n-локусной модели оценивался процедурой Монте–Карло (1000 симуляций). Статистически значимым считали различия при р<0,05.
Результаты и обсуждение
Средний возраст женщин в группах был сопоставим и составил 33 (5,16) года в основной группе и 33 (3,44) года в группе сравнения, р>0,05. При исследовании антропометрических данных женщин в группах наблюдения статистически значимых отличий не выявлено, средний индекс массы тела пациенток основной группы составил 22,54 (3,57) кг/м2, группы сравнения – 23,40 (3,91) кг/м2, р>0,05.
Большинство пациенток основной группы (56/70, 80%) и группы контроля (36/50, 72%), р>0,05 имели высшее образование. Клинико-демографические характеристики пациенток исследуемых групп представлены в таблице 1.

При оценке характера сопутствующей соматической патологии выявлено, что 7/70 (10%) пациенток с глубоким инфильтративным эндометриозом страдали анемией, тогда как у пациенток группы сравнения при обследовании анемии выявлено не было, р=0,022. Частота курения среди женщин составила 7/70 (10,0%) в основной группе и 5/50 (10%) в группе сравнения, р>0,05.
Возраст менархе, продолжительность менструального цикла и продолжительность менструального кровотечения были сопоставимы в группах, р>0,05. Болезненный характер менструаций наблюдался более, чем у половины пациенток основной группы (39/70, 55,7%), что было значимо выше, чем у пациенток группы сравнения (14/50, 28,0%), р=0,003.
Средний возраст начала половой жизни был также сопоставим в группах, р>0,05. Не было статистически значимых различий по частоте использования комбинированных оральных контрацептивов в группах наблюдения, р>0,05.
Хотя бы одна беременность в анамнезе наблюдалась у 37/70 (52,9%) пациенток основной группы, при этом у 29/70 (41,4%) она закончилась родами, тогда как 50/50 (100%) женщин группы сравнения имели роды в анамнезе (р<0,001). Частота медицинских абортов в анамнезе была значимо ниже у пациенток с глубоким инфильтративным эндометриозом (7/70, 10,0%), чем у пациенток группы сравнения (17/50, 34,0%), p=0,011. Не было статистически значимых различий по частоте встречаемости самопроизвольных выкидышей, неразвивающихся и эктопических беременностей у пациенток обеих групп, р>0,05.
Половина пациенток с глубоким инфильтративным эндометриозом (34/70, 48,6%) страдали бесплодием, тогда как в группе сравнения данный показатель составил 7/50 (14,0%), р<0,001. При этом отмечается преобладание первичного эндометриоз-ассоциированного бесплодия (24/34, 70,6%) над вторичным (10/34, 29,4%).
При оценке гинекологического анамнеза было выявлено, что эктопия шейки матки отмечалась у 12/70 (17,1%) пациенток основной группы против 2/50 (4,0%) в группе сравнения, р=0,028. У 6/70 (8,6%) пациенток глубокий инфильтративный эндометриоз сочетался с врожденными пороками развития внутренних половых органов, у пациенток группы сравнения врожденных пороков развития половых органов не отмечалось (р=0,034). Миома матки также встречалась чаще в основной группе (21/70, 30%), чем в группе сравнения (5/50, 10%), р=0,009. Не было статистически значимых различий по частоте встречаемости других гинекологических заболеваний в двух группах.
Не выявлено статистически значимых различий в частоте хирургических вмешательств на яичниках в анамнезе у пациенток двух групп (21/70 (30,0%) в основной группе против 8/50 (16,0%) в группе сравнения), р>0,05. 17/70 (24,3%) пациенток основной группы перенесли хирургическое лечение эндометриом яичников в анамнезе, в среднем 5,6 (0,51) года назад. Хирургическое иссечение очагов глубокого инфильтративного эндометриоза в анамнезе перенесли 7/70 (10%) пациенток основной группы в среднем 3,0 (0,36) года назад. Гистероскопические операции в анамнезе статистически значимо чаще наблюдались в основной группе (20/70, 28,6%), чем в группе сравнения (6/50, 12,0%), p=0,03. При оценке анамнеза других гинекологических операций значимых различий в двух группах выявлено не было.
Пациентки с наличием глубокого инфильтративного эндометриоза закономерно чаще страдали хронической тазовой болью (60/70, 85,7%), чем пациентки группы сравнения (6/50, 12,0%), р<0,001. Также пациентки основной группы испытывали диспареунию значимо чаще (14/70, 20%), чем пациентки группы сравнения (2/50, 4%), р=0,012. Дисхезия и дизурия встречались у 4/70 (5,7%) и 2/70 (2,8%) пациенток основной группы соответственно, у пациенток группы сравнения данных симптомов не наблюдалось.
При оценке состояния овариального резерва было выявлено, что уровень АМГ на дооперационном этапе был ниже у пациенток с инфильтративной формой наружного генитального эндометриоза, чем у пациенток группы сравнения в среднем на 1,3 нг/мл (2,4 (2,0) нг/мл в основной группе, 3,8 (3,2) нг/мл в группе сравнения), р=0,02.
Средний уровень ФСГ статистически значимо не различался у пациенток в группах наблюдения, составив 8,1 (8,7) мМЕ/мл в основной группе и 7,2 (8,7) мМЕ/мл в группе сравнения, р>0,05. Также не было статистически значимых различий в среднем уровне эстрадиола в сыворотке крови между основной группой (150,3 (123,7) пг/мл) и группой сравнения (168,4 (112,5) пг/мл), р>0,05.
Количество антральных фолликулов по данным трансвагинального УЗИ было статистически значимо ниже в основной группе – 8,3 (4,5), чем в группе сравнения – 11,8 (4,1), р<0,001. Данные, отражающие состояние овариального резерва у пациенток двух групп, представлены в таблице 2.

Полученные данные свидетельствуют о снижении овариального резерва у пациенток репродуктивного возраста с инфильтративной формой наружного генитального эндометриоза. Механизм снижения овариального резерва при глубоком инфильтративном эндометриозе до конца не изучен.
Результаты молекулярно-генетического типирования полиморфных вариантов генов, кодирующих белки-регуляторы апоптоза (C-KIT: 2600 G>A, KITLG: 80441 C>T, TP53: Ex4+119 G>C (Arg72Pro) и ангиогенеза (VEGF-A: +12143 C>А, VEGF-A: -2578 C>A, VEGF-A: -634 G>C, VEGF-A: +936 C>T), свидетельствуют, что характер распределения аллелей и генотипов по полиморфным вариантам исследуемых генов в обеих группах соответствует равновесию Харди–Вайнберга (табл. 3).
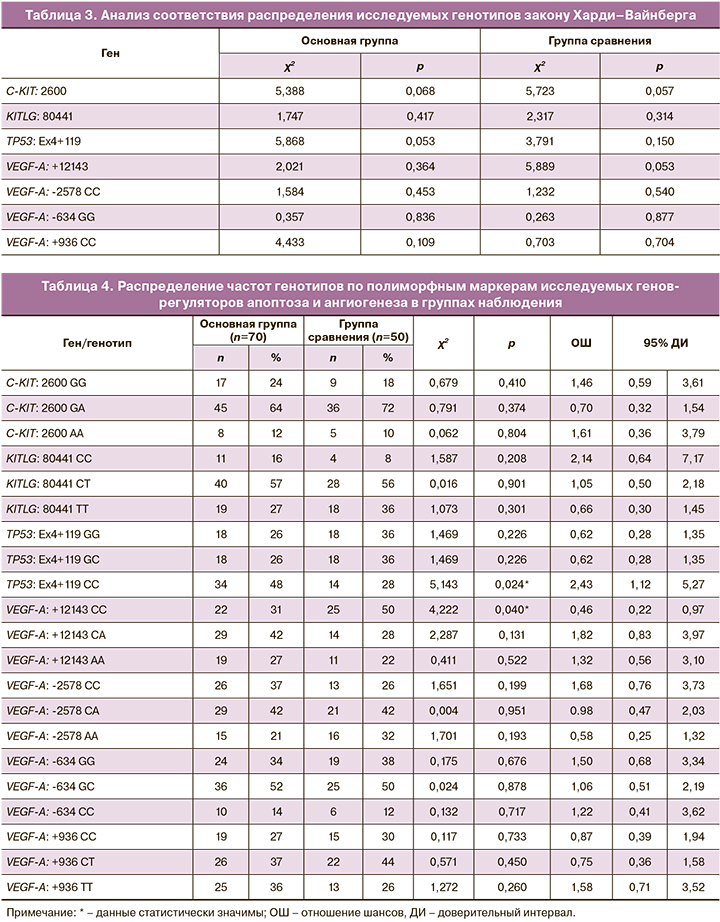
При анализе распределения генотипов по полиморфным маркерам исследуемых генов выявлено, что вариант гена регулятора апоптоза TP53: Ex4+119 CC регистрировался значимо чаще у пациенток с глубоким инфильтративным эндометриозом, чем у пациенток группы сравнения (ОШ=2,43 (95% ДИ 1,12; 5,27); p<0,05) (табл. 4).
Распределение частот аллелей по полиморфным локусам исследуемых генов (табл. 5) показало статистически значимые различия в частоте полиморфного аллеля Ex4+119 G>C гена TP53 (Arg72Pro). У женщин основной группы вариантный аллель Ex4+119 C гена TP53 регистрировали статистически значимо чаще, чем у пациенток группы сравнения (ОШ=1,87 (95% ДИ 1,1; 3,15); p=0,018). Статистически значимых различий в частоте аллелей по полиморфным маркерам других исследуемых генов в исследуемых группах не выявлено.
Для оценки возможного влияния генотипа на риск развития глубокого инфильтративного эндометриоза были использованы рецессивная и доминантная модели распределения частот генотипов по исследуемым полиморфным маркерам изучаемых генов у пациенток основной группы и группы сравнения.
При анализе рецессивной модели распределения частот генотипов (табл. 6) у женщин основной группы выявлена статистически значимо большая, чем у женщин группы сравнения, частота полиморфного маркера Ex4+119 G>C гена TP53. Генотип Ex4+119 CC гена TP53 можно расценивать, как генотип «риска» развития глубокого инфильтративного эндометриоза, так как его носительство увеличивает риск развития данного заболевания (ОШ=2,43 (95% ДИ 1,12–5,27); p<0,03). Напротив, присутствие в генотипе вариантного аллеля Ex4+119 G в гомо- или гетерозиготном состоянии снижает шанс развития глубокого инфильтративного эндометриоза (ОШ=0,41 (95% ДИ 0,19–0,89); p<0,03).
Одним из ключевых генов-супрессоров опухолевого роста является ген ТР53, функция которого направлена на ограничение вероятности возникновения генетически нестабильных клеток. Белок р53 осуществляет регуляцию широкого спектра клеточных процессов, устраняющих потенциально опасные в плане злокачественной трансформации клетки. TP53 является транскрипционным фактором свыше 300 генов, отвечающих за активацию таких жизненно важных процессов, как репликация, репарация ДНК, апоптоз, антиоксидантная защита и др. В человеческих популяциях активность белка р53 в значительной степени модифицирована генетическим полиморфизмом, наиболее значимой является точечная замена гуанина на цитозин в 72-м кодоне 4-го экзона (Ex4+119 G>C, Arg72Pro, rs 1042522), при этом G- и С-аллели кодируют различающиеся по биохимическим и физиологическим свойствам белки, обладающие разной эффективностью в поддержании генетического гомеостаза клетки в условиях влияния генотоксических факторов [16].
Многочисленные исследования подтверждают ассоциацию полиморфизма Arg72Pro гена TP53 с риском развития рака молочной железы, а также рака эндометрия [17].
Широко исследована ассоциация между полиморфизмом TP53 Arg72Pro и риском развития рака яичников, однако полученные результаты противоречивы. В связи с чем Zhang A. et al. (2017) провели метаанализ, включивший 24 опубликованных исследований с общим количеством пациенток 10113. Объединенные результаты показали отсутствие значимой ассоциации между полиморфизмом Arg72Pro гена TP53 и риском развития рака яичников [18].
Исследования полиморфизмов гена TP53 нашли свое широкое применение в области онкологии, и взаимосвязь между полиморфизмами данного гена и риском развития эндометриоза на сегодняшний день остается спорной [19].
Li J. et al. (2015) в проведенном метаанализе, включившем 14 исследований из 8 стран, выявили положительную связь полиморфизма TP53 Arg72Pro (rs1042522) с риском развития эндометриоза, особенно среди азиатской популяции (в доминантной модели ОШ=0,746 (95% ДИ 0,585–0,952), в рецессивной модели ОШ=0,650 (95% ДИ 0,510–0,829); при аллельном анализе ОШ=0,762 (95% ДИ 0,654–0,888)) [20].
Yan Y. et al. (2015) в метаанализе, включившем 15 исследований «случай-контроль», также подтвердили, что носительство полиморфизма Arg72Pro гена TP53 повышает риск развития эндометриоза [19].
Vagnini L.D. et al. (2015) в исследовании на 605 пациентках репродуктивного возраста с бесплодием установили, что носительство полиморфизма rs4648551 A>G гена TP73, кодирующего изоформу p73 белка p53, ассоциировано со снижением овариального резерва в виде уменьшения уровня АМГ в крови, а также количества антральных фолликулов по данным УЗИ [21].
Помимо снижения способности к апоптозу, общим в патогенезе эндометриоза и злокачественных новообразований является активация неоангиогенеза. Поэтому в последние годы активно изучается роль сосудистого эндотелиального фактора роста (VEGF), как ключевого регулятора ангиогенеза, в развитии эндометриоза.
Результаты проведенного анализа доминантной модели распределения частот генотипов (табл. 7) выявили значимость полиморфного маркера VEGF-A: +12143 C>А в риске развития глубокого инфильтративного эндометриоза: присутствие в генотипе вариантного аллеля +12143 A в гомо- или гетерозиготном состоянии повышает риск развития данной патологии (ОШ=2,18 (95% ДИ 1,03–4,61); p<0,05). Генотип VEGF-A: +12143 CС, наоборот, дает протективный эффект в отношении развития глубокого инфильтративного эндометриоза (ОШ=0,46 (95% ДИ 0,22–0,97); p<0,05).
Исследования последних лет демонстрируют повышенное содержание VEGF в перитонеальной жидкости больных эндометриозом, а также рецепторов к нему (VEGFR1) в эктопическом эндометрии [22–24]. Более того, уровень экспрессии VEGF у пациенток с эндометриозом напрямую коррелирует со стадией заболевания [25, 26]. При этом исследования полиморфных вариантов гена VEGF имеют противоречивые результаты [27].
Cardoso J.V. et al. (2017) в исследовании с участием 293 пациенток с эндометриозом и 223 контрольных пациенток продемонстрировали положительную корреляцию между однонуклеотидными заменами -2578 C>A и -1154 G>A гена VEGF и риском развития эндометриоза. При этом полиморфизмы VEGF: +405 G>C и VEGFR2: 1192 C>T были ассоциированы со снижением риска развития заболевания. Комбинированный анализ генотипов VEGF-VEGFR2 выявил роль межгенных взаимодействий в предрасположенности к эндометриозу [28].
В свою очередь, Rashidi B.H. et al. (2019) в исследовании, включившем 100 пациенток с эндометриозом и 200 пациенток контрольной группы, не выявили ассоциации полиморфизмов -2578 A/C и +936 C/T гена VEGF с риском развития эндометриоза. Также авторы не обнаружили связи между экспрессией микро-РНК VEGF и риском развития данного заболевания [29].
Позже Pergialiotis V. et al. (2020) в метаанализе, основанном на 20 исследованиях, также не выявили влияния однонуклеотидных полиморфизмов -460 C/T, +405 G/C, +936 C/T, -2578 A/C и -1154 G/A гена VEGF на риск развития и тяжесть течения эндометриоза [30].
В своем исследовании Liu P. et al. (2020) продемонстрировали, что пациентки на ранних стадиях преждевременной недостаточности яичников имеют измененный цитокиновый профиль, характеризующийся повышением хемокинов и факторов роста, в том числе VEGF [31].
Противоречивость данных, полученных разными авторами, диктует необходимость дальнейшего изучения роли полиморфизмов гена VEGF в развитии эндометриоза, а также их влияния на овариальный резерв при данном заболевании.
В последние годы считается, что отдельные генетические варианты вносят достаточно низкий вклад в формирование патологического фенотипа, поэтому для понимания ключевых звеньев патогенеза заболевания следует анализировать межгенные и генно-средовые взаимодействия, играющие роль в формировании клинического фенотипа заболевания.
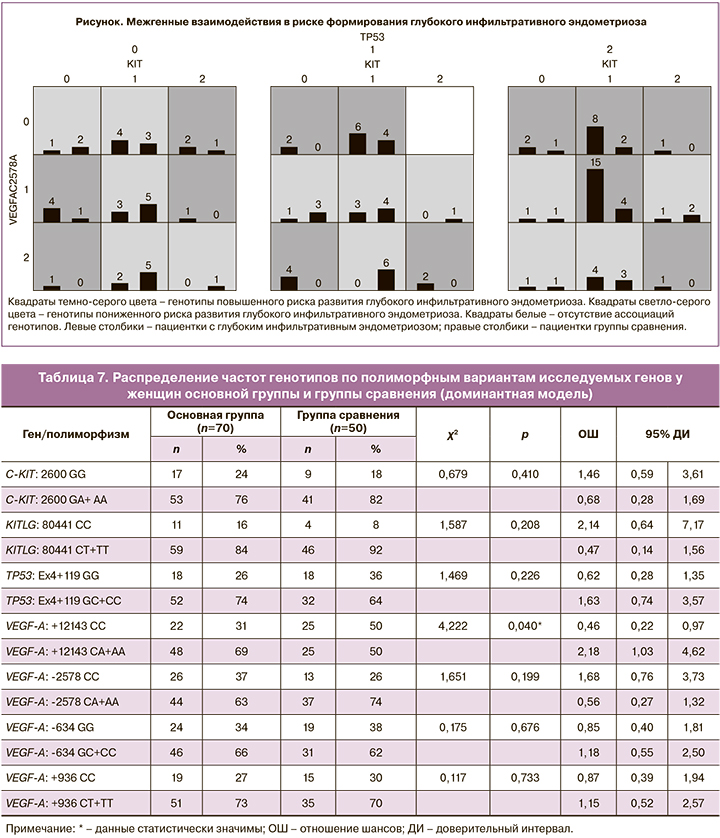
Современным подходом для моделирования межгенных взаимодействий является биоинформатический метод сокращения многофакторной размерности (MDR). По данным многофакторного анализа была сформирована трехлокусная модель C-KIT (2600 G/A)×VEGFA (-2578 C/А)×TP53 (Ex4+119 G/C), характеризовавшаяся чувствительностью 70% и специфичностью 74% (табл. 8).

В результате исследования нами выявлено 13 генотипов повышенного риска и 12 генотипов пониженного риска развития глубокого инфильтративного эндометриоза (рисунок).
Согласно данной прогностической модели, в патогенезе глубокого инфильтративного эндометриоза играет роль сочетание однонуклеотидных полиморфизмов генов, регулирующих апоптоз (C-KIT: 2600 G>A, TP53: Ex4+119 G>C) и ангиогенез (VEGF-A: -2578 C>A). Чувствительность метода составляет 93%, специфичность – 91%. Для прогнозирования наличия глубокого инфильтративного эндометриоза у пациенток с клиническими проявлениями заболевания в виде синдрома тазовой боли, диспареунии или бесплодия проводят молекулярно-генетическое исследование с определением однонуклеотидных полиморфизмов генов C-KIT, TP53, регулирующих апоптоз, и гена VEGF-A, регулирующего ангиогенез. Наличие сочетания однонуклеотидных полиморфизмов генов C-KIT: 2600 G>A, TP53: Ex4+119 G>C, VEGF-A: -2578 C>A свидетельствует о высоком риске развития у пациентки глубокого инфильтративного эндометриоза, ассоциированного со снижением овариального резерва.
C-KIT кодирует рецептор тирозинкиназы c-kit, участвующей в активации антиапоптотического сигнального пути PI3K/AKT/mTOR. Это один из универсальных внутриклеточных сигнальных путей, отвечающий за подавление апоптоза, рост и пролиферацию клеток. Данный сигнальный путь играет значимую роль в прогрессировании эндометриоза, активируя пролиферацию и подавляя апоптоз эндометриоидных клеток [32].
Сигнальный путь фосфатидилинозитол-3-киназы играет важную роль в активации примордиальных фолликулов, что подчеркивается в исследованиях на трансгенных животных [33].
Результаты анализа рецессивной и доминантной моделей распределения частот генотипов по полиморфным вариантам генов, активирующих сигнальный путь PI3K/AKT/mTOR (C-KIT: 2600 G>A, KITLG: 80441 C>T) не выявили значимости данных маркеров в риске развития глубокого инфильтративного эндометриоза (табл. 4, 5). Однако сочетание полиморфизма 2600 G>A гена C-KIT с полиморфизмами Ex4+119 G>C гена TP53 и -2578 C>A гена VEGF-A согласно анализу межгенных взаимодействий играет значимую роль в развитии данного заболевания. Полученные данные демонстрируют некоторые молекулярно-генетические механизмы сочетанной дизрегуляции апоптоза и ангиогенеза, лежащие в основе снижения овариального резерва при глубоком инфильтративном эндометриозе у пациенток репродуктивного возраста.
Заключение
Наличие глубокого инфильтративного эндометриоза без видимого поражения яичников может быть ассоциировано со значительным снижением овариального резерва у пациенток репродуктивного возраста.
Установлена ассоциация полиморфных аллелей генов, регулирующих апоптоз (TP53: Ex4+119 G>C (Arg72Pro) и ангиогенез (VEGF-A: +12143 C>А), определяющая повышенный риск развития глубокого инфильтративного эндометриоза у женщин репродуктивного возраста, ассоциированный со снижением овариального резерва.
Анализ межгенных взаимодействий позволил установить разновидности генотипов, ассоциированных с высоким и низким риском формирования глубокого инфильтративного эндометриоза, и получить трехлокусную модель, позволяющую с чувствительностью 93% и специфичностью 91% определить генетическую предрасположенность к данной патологии.
Дисрегуляция процессов апоптоза и ангиогенеза при глубоком инфильтративном эндометриозе может являться одним из важных механизмов снижения овариального резерва вследствие преждевременной активации примордиальных фолликулов и раннего их истощения.



