Современные подходы к органосохраняющему хирургическому лечению миомы матки, частота которой у женщин репродуктивного возраста составляет 20–40% [1–7], с использованием лапароскопического доступа, требуют развития кровесберегающих технологий. Учитывая особенности кровоснабжения матки, интерес представляют методики, использующие временную окклюзию питающих сосудов: временное клипирование внутренних подвздошных [8] или маточных артерий (ВКМА) [9], временную компрессию маточных сосудов путем наложения петлевой лигатуры Roeder на шейку матки [10]. Хорошо известно, что кровоснабжение матки в основном осуществляется за счет маточных артерий. Arteria uterina, ветвь переднего ствола внутренней подвздошной артерии, располагаясь в основании широкой связки, направляется к матке, анастомозируя с маточной ветвью яичниковой артерии, являющейся дополнительным питающим источником [11]. Яичники в большинстве случаев получают кровь по одноименным яичниковым артериям, однако при их гипоплазии, с незначительным кровотоком, приоритетным становится кровоснабжение через яичниковые и трубные ветви маточной артерии [12]. Учитывая особенности кровоснабжения, клипирование маточных артерий может привести к временной ишемии яичников. В то же время в случае наличия маточно-яичниковых артериальных коммуникаций, которые встречаются по данным разных авторов в 9–50% случаев [13], либо при непосредственном кровоснабжении миоматозного узла или его части из яичниковой артерии [12, 14], может возникнуть необходимость в дополнительном временном клипировании яичниковых артерий. Насколько существенно такая блокировка снижает объем интраоперационной кровопотери остается неясным. В своем исследовании С.Г. Магакян с соавт. (2014) [15] показали четырехкратное снижение конечной диастолической скорости кровотока в маточных артериях и двукратное – в яичниковых ветвях маточных артерий после проведения комбинированной блокады сосудов: маточные артерии и вены пережимали с помощью проведенного в бессосудистых зонах плоского полимерного «ремешка», на воронко-тазовые связки накладывали клипсы. По данным G. Farrer-Brown и соавт. (1978) при изолированной двусторонней окклюзии маточных артерий кровоток в матке снижается примерно на 42% [16]. Дискутируется степень повреждения ткани миометрия и яичников в условиях временной ишемии и реперфузии. Например, при изучении узлов миомы, удаленных через 6 месяцев после лечения, в случаях с применением эмболизации маточных артерий определялся некроз, а при лапароскопической окклюзии – апоптоз [17]. Эти данные позволяют полагать, что степень повреждения зависит от длительности окклюзии и уровня блокады кровотока. Соответственно, в случае с временным клипированием средней длительностью 30 минут, сохранением коллатерального кровотока, степень ишемии, будет минимальной. Модель перекрута яичников на крысах позволила понять, что воспалительная инфильтрация, кровоизлияния и дегенеративные изменения в клетках фолликулов отмечаются уже через 3 часа после экспериментальной ишемии, в то время как некроз развивается лишь при ишемии более 10 часов [18]. Qu и соавт. в проспективном когортном исследовании при сравнительном анализе уровней ФСГ, ЛГ и ингибина В (через 1, 3, 6 месяцев после операции) у пациенток, которым проводилась миомэктомия с клипированием маточных артерий и без него, не получили статистически значимых различий [19]. Неожиданные результаты получила группа исследователей во главе с H.Y. Wang [20]: снижение уровня антимюллерова гормона на 2-е послеоперационные сутки при миомэктомии без окклюзии маточных артерий, с возвращением к норме через 3 месяца. Несмотря на то, что операция ВКМА давно известна и тщательно разработана [21], метод не внедрен в рутинную клиническую практику, поскольку является трудоемким и требует современной лапароскопической хирургической техники и слаженной работы хирургической бригады.
В настоящее время проводятся исследования, цель которых – ответить на вопрос, какой же метод кровосбережения при миомэктомии наиболее эффективен с точки зрения «безопасность/польза/стоимость». Относительно ВКМА опубликованы противоречивые результаты. Например, E.J. Kongnyuy и соавт. (2014) в обзоре рандомизированных клинических исследований по данной проблеме, отмечают, что нет убедительных работ, доказывающих эффективность использования ВКМА с целью снижения кровопотери при миомэктомии [9].
В то время как Y.S. Kwon и соавт. (2013) считают, что использование ВКМА способствует проведению миомэктомии минимально инвазивно и снижает кровопотерю без увеличения количества других осложнений [22]. Согласно анализу литературы, даже клиники высшего уровня не применяют данный метод рутинно, поскольку он требует специальной подготовки и навыков работы в забрюшинном пространстве. Он может выполняться хирургами с большим опытом как открытых, так и лапароскопических операций, поскольку малейшая ошибка при выделении основных структур может привести к грозным осложнениям: ранению мочеточников, подвздошных сосудов, кишечника, неконтролируемому кровотечению.
В ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России в основном используются две кровесберегающие технологии: временное клипирование питающих артерий (ВКПА) матки и интраоперационная реинфузия аутоэритроцитов (ИРА). Данная статья содержит результаты сравнения эффективности применения этих методов.
Цель исследования: оценить эффективность использования ВКПА (маточных артерий, сосудов воронко-тазовых и круглых связок матки) при миомэктомии лапароскопическим доступом.
Материал и методы исследования
В пилотное исследование случай-контроль было включено 26 пациенток в возрасте от 18 до 45 лет, имеющих «симптомную» миому матки и настаивающих на органосохраняющем оперативном лечении. Пациентки были разделены на две группы: I – основная, в которой проводилось ВКПА, II – сравнения, где применяли ИРА. Перед включением в исследование у каждой пациентки было получено информированное согласие на участие. Оперативное лечение проводилось в I фазу нормального менструального цикла (6–10-й день) лапароскопическим доступом. Окончательное решение о необходимости и возможности проведения клипирования принималось интраоперационно, у пациенток с предполагаемым высоким риском большой кровопотери. Учитывались общие размеры матки, размеры (более 7 см) и расположение (интерстициальные, интерстициально-субсерозные узлы в дне, теле матки) миоматозных узлов, множественная миома матки (3 и более узлов), исходная анемия у больной. Пациентки, получавшие гормональное лечение миомы матки в течение 2 предоперационных лет, имеющие или имевшие эндокринную патологию, нарушения менструального цикла, бесплодие эндокринного генеза, в исследование не включались.
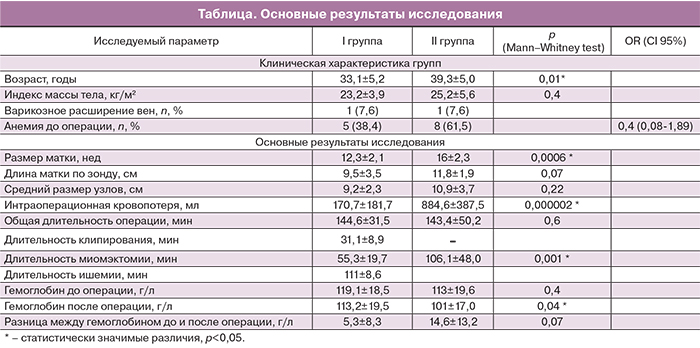
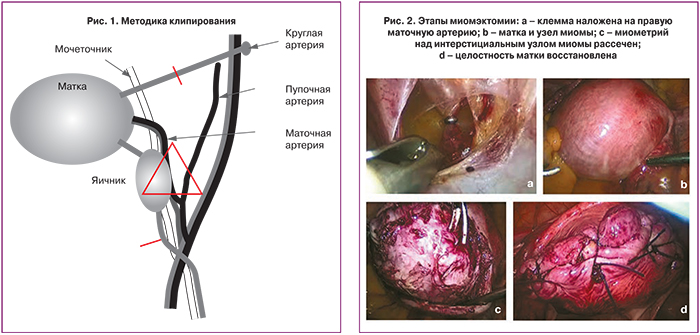
Был проведен анализ анамнеза, сопутствующих заболеваний, сравнение длительности общего времени операции, времени клипирования (время от вскрытия ретроперитонеального пространства до наложения клемм на маточные артерии, сосуды воронко-тазовых и круглых связок матки), времени ишемии (время между наложением первой и удалением последней клеммы), времени миомэктомии (время от рассечения миометрия над первым удаляемым узлом миомы до зашивания ложа последнего), объема кровопотери, количества и размеров удаленных узлов, стоимости использованных методов кровесбережения. Для выделения маточной артерии мы использовали «posterior approach» [23]. Троакары расставляли: 1 – по средней линии над пупком, 2, 3 – медиальнее и на уровне верхних передних остей подвздошных костей, 4 – центральный, по средней линии на 8 см проксимальнее лобковой кости, при этом учитывались размеры матки. При необходимости использования 10 мм клипатора, устанавливался 10 мм центральный дополнительный троакар. Для диссекции ретроперитонеального пространства использовались тупоконечные ножницы, диссектор, биполярный коагулятор типа RoBi (Karl Shtorz), для собственно окклюзии сосудов – 5 (10) мм клипаторы, клипсы 8 мм, для миомэктомии в ряде случаев гармонический скальпель. Визуализировалась проекция пупочной артерии: без выделения прослеживался ее ход до яичниковой ямки, придатки фиксировались в положении выше и латеральнее яичниковой ямки, визуализировался мочеточник. В углу, образованном проекцией пересечения мочеточника и пупочной артерии, тупоконечными ножницами рассекалась брюшина и диссектировалось забрюшинное пространство. Это место – проекция отхождения ствола маточной артерии. Выделялась маточная артерия, с помощью клипатора (5 или 10 мм) накладывалась клипса. Операция повторялась с противоположной стороны. Далее клипировались сосуды воронко-тазовых связок у их основания и сосуды круглых связок матки ближе к стенке таза. Методика клипирования представлена на рис. 1 и 2. Во всех случаях применялся метод количественной оценки интраоперационной кровопотери, как измерение объема эвакуированной из брюшной полости крови при помощи аквапуратора.
Статистическая обработка данных проводилась с помощью свободно распространяемого программного продукта Winpepi версии 9.7 (Abramson, J.H. Winpepi (PEPI-for-Windows): computer programs for epidemiologists. Epidemiologic Perspectives & Innovations 2004, 1: 6), Statsoft Statistica 8.0.725, IBM SPSS Statistics 19.0 for Windows. После проведения теста на нормальность распределения данных, для определения статистической значимости различий средних применялись U-тест Манна–Уитни для несвязанных совокупностей. Для определения связи (корреляции) между переменными рассчитывался ранговый коэффициент корреляции по Спирмену. При оценке достоверности выявленных различий между средними значениями выборок рассчитывалась вероятность ошибки р. По общепринятой терминологии в биомедицинской аналитической статистике утверждения, имеющие вероятность ошибки р≤0,05, оценивались как значимые. Отношение шансов (OR) приведено с 95% доверительным интервалом (CI).
Результаты исследования
Средний возраст пациенток был достоверно больше во второй группе (I – 33,1±5,2; II – 39,3±5,0; p=0,01). Избыточный вес имели 30,7% пациенток первой группы, ожирение I степени в 23,1% и II степени – в 7,7% встречалось только во II группе (степень установлена в соответствии с классификацией ВОЗ 1997г). Тяжелой сопутствующей патологии, не связанной с основным заболеванием зафиксировано не было. Анемия перед операцией встречалась статистически незначимо чаще во II группе (38,4 и 61,5%, соответственно по группам), с преобладанием легкой и средней степени по структуре в обеих группах. Существенная разница была обнаружена при сравнении размеров матки при бимануальном исследовании (I – 12,3±2,1; II – 16±2,3 недель; p=0,0006) и интраоперационной кровопотери (I – 170,7±181,7 мл; II – 884,6±387,5 мл; p=0,000002) в двух группах. Количество удаленных миоматозных узлов не превышало 6 в обеих группах и составило в среднем 2,0±1,8 и 1,7±1,3 в I и II группах соответственно. Не было зафиксировано различий в общей длительности операции (I – 144,6±31,5 мин; II – 143,4±50,2 мин), длительность клипирования составила 31,1±8,9 мин, однако длительность миомэктомии при временном клипировании была в два раза короче и составила 55,3±19,7 мин. Проведенный корреляционный анализ выявил сильную положительную связь между длительностью миомэктомии, размером матки (p=0,72), объемом кровопотери (p=0,83), а также среднюю связь между средним размером узлов, кровопотерей (p=0,56), длительностью операции (p=0,63). ИРА использовалась в 100% случаев при миомэктомии во II группе. В среднем объем реинфузии составил 463,8±218,0 мл с гематокритом 56,9±6,3%. Также потребность в ИРА (объем реинфузии 270 мл с гематокритом 60%) возникла в одном случае в I группе, несмотря на предварительное клипирование сосудов. При исследовании уровня гемоглобина на 3 сутки послеоперационного периода более значимое снижение отмечалось во второй группе (I – 5,3±8,3 г/л; II – 14,6±13,2 г/л; p=0,07). Интраоперационных и ранних послеоперационных осложнений, в том числе ранения мочеточников, подвздошных сосудов, кишечника, зафиксировано не было. Течение послеоперационного периода в двух группах не различалось. Основные результаты анализа представлены в таблице. В отношении отдаленных исходов, проведенный нами опрос (через 1 и 2 года после операции) показал, что 73% пациенток не планируют беременность, у 1 (3,7%) были две нерезультативные попытки ЭКО, в двух случаях не удалось установить связь. К сожалению, информация об уровне антимюллерового гормона и количестве фолликулов при ультразвуковом исследовании после операции была недоступна.
Обсуждение результатов
Проведенное пилотное исследование, несмотря на ограничения, накладываемые дизайном (ретроспективное исследование, случай-контроль) и объемом выборки (26 пациенток), позволило продемонстрировать преимущества ВКПА как метода уменьшения интраоперационной кровопотери. По результатам ясно, что применение ВКПА не укорачивает, но и не удлиняет общее время операции (144,6±31,5 мин; 143,4±50,2 мин, в I и II группе соответственно), однако в два раза сокращая время непосредственно миомэктомии. По литературным данным, среднее время миомэктомии лапароскопическим доступом без ВКПА составляет 77 мин, по нашим данным обсуждаемый параметр в условиях ИРА составил 106,1 мин. Уменьшение времени миомэктомии с использованием ВКПА обусловлено «комфортом» проведения операции, учитывая улучшение визуализации, уменьшение необходимости применения коагуляции миометрия для остановки кровотечения, сокращение времени восстановления целостности матки [24, 25]. По результатам нашего исследования имеет место сокращение объема интраоперационной кровопотери и связанное с ним уменьшение снижения гемоглобина на 3-и сутки после операции, то есть уменьшение степени и частоты постгеморрагической анемии. Конечно, в данной работе такая разница может быть обусловлена не только эффектом ВКПА, но и особенностями исследования, поскольку контрольная группа подбиралась произвольно, без стратификации по размеру матки и количеству миоматозных узлов. Среднее время клипирования маточных артерий (32 мин) согласуется с данными, представленными другими авторами (среднее время 15 минут, пределы колебаний от 6 до 40 минут [22, 26]), но приближается к верхней границе указанных диапазонов, что может быть связано с особенностями анатомического строения матки (размер, наличие низко расположенных, крупных узлов), малого таза (плоский, андроидный, кососмещенный), артериального русла пациенток, включенных в исследование, а также с опытом применения данного вида операции. Необходимо отметить, что при лапароскопических операциях работа может затрудняться наличием у пациентки избыточного веса и ожирения, которые в нашем исследовании были отмечены у трети пациенток обеих групп. В результатах корреляционного анализа, установившего наличие связи между объемом кровопотери, размером матки, средним размером удаленных узлов, нет ничего неожиданного, поскольку подобные сведения докладывают многие авторы [27]. Внимание привлекает случай в группе с ВКПА, где понадобилось дополнительное применение ИРА. Детальный анализ показал, что имелись особенности расположения и размера миоматозных узлов (матка на 15 недель, расположение 4 узлов по передней, задней стенкам и по ребрам матки, размеры – 14, 5, 4 и 1 см). К сожалению, ретроспективный характер исследования не позволяет установить особенности кровоснабжения миоматозных узлов, что могло бы объяснить неэффективность ВКПА.
В ряде случаев большие размеры, ограниченная подвижность матки, связанные с расположением и размером миоматозных узлов (при узлах миомы больше 6 см, расположенных по задней стенке матки, ограничивающих ее подвижность), ВКПА не проводилось. По нашему мнению, в такой ситуации методом выбора может быть клипирование внутренней подвздошной артерии. Однако этот метод менее безопасен, чем применяемое нами ВКПА, поскольку выше риск повреждения магистральных сосудов таза, заднего ствола внутренней подвздошной артерии, а также клипируемых структур, что связано с наложением более жестких клемм большего размера.
Заключение
Проведенное исследование показало, что ВКМА, сосудов воронко-тазовых и круглых связок матки является методом, расширяющим возможности миомэктомии лапароскопическим доступом, эффективно снижающим интраоперационную кровопотерю. Его безусловное преимущество – уменьшение потребности в коагуляции миометрия с целью остановки кровотечения. Это уменьшает площадь коагуляционного некроза, перифокального воспаления и в дальнейшем способствует формированию более полноценного рубца, что особенно важно при миомэктомии у пациенток фертильного возраста, планирующих беременность. Кроме того, метод экономически более оправдан, по сравнению с распространенной в клинике ИРА. Ограниченное его применение связано со сложностью выполнения ВКПА, требующей от хирурга не только знания анатомии забрюшинного пространства малого таза, но и современной лапароскопической техники, а также с отсутствием однозначного ответа на вопрос: как временная ишемия влияет на функцию и структуру яичниковой ткани.



