1) ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им академика. В.И. Кулакова» Минздрава России, Москва;
2) ФГБУН «Институт биологии развития им. Н.К. Кольцова» РАН, Москва
Цель. Изучить профиль метилирования ДНК в плаценте при задержке роста плода.
Материалы и методы. В ходе исследования было изучено 38 образцов плацент, полученных от пациенток после самопроизвольных и оперативных родов. Женщины были разделены на 2 группы: 1-ю группу составили 18 пациенток с подтвержденным диагнозом задержки роста плода, 2-ю группу – 20 пациенток с физиологическим течением беременности. Выделение ДНК из тканей проводилось с использованием колонок «К-сорб» («Синтол», Россия). Далее проводились бисульфитная конверсия и полимеразная цепная реакция с праймерами к фрагменту островка метилирования изучаемых генов. Уровень метилирования определяли с помощью анализа кривых плавления с высоким разрешением (methylation-specific high resolution melts, MSHRM) с использованием программного обеспечения Precision Melt Analysis Software (BioRad, США).
Результаты. Выявлено, что относительный уровень метилирования гена TLR2 в плацентах с задержкой роста плода достоверно ниже по сравнению с группой с физиологическим течением беременности (р=0,01). Изучение метилирования импринтинг-контролирующей области (ICR) IGF2/H19 также показало достоверное снижение относительного уровня метилирования в плацентах с задержкой роста плода по сравнению с группой сравнения (p<0,001).
Заключение. Полученные результаты указывают на роль метилирования гена TLR2 и импринтинг-контролирующей области (ICR) IGF2/H19 в формировании задержки роста плода и перспективность дальнейшего изучения уровня метилирования данных генов в других биологических субстратах с целью разработки новых методов диагностики.
задержка роста плода
эпигенетика
метилирование ДНК
плацента
В настоящее время большое значение приобретает изучение концепции фетального программирования, определяющего сформированную еще во внутриутробном периоде восприимчивость организма к заболеваниям [1–3]. Гипотеза, впервые выдвинутая D. Barker, предполагает, что неблагоприятные факторы окружающей среды вызывают морфологические и физиологические изменения у плода, адаптационный характер которых направлен на поддержание его гомеостаза [4]. В течение последних 30 лет в мировой литературе появилось множество работ о взаимосвязи между дефицитом массы тела при рождении и риском развития метаболических, сердечно-сосудистых и неврологических заболеваний [5–7]. Несмотря на понимание важности механизмов, лежащих в основе внутриутробного программирования, они остаются малоизученными [8, 9]. Согласно последним исследованиям, предположительную роль играют эпигенетические изменения некоторых генов, возникающие в ответ на негативные факторы пренатального периода [10–13]. Плацента – уникальный орган, позволяющий изучить взаимодействие генетических факторов и факторов окружающей среды, а также их вклад в развитие заболеваний [14, 15]. Изучение эпигенетических изменений ДНК плаценты представляет большой интерес в связи с перспективностью разработки новых диагностических тестов на основании определения эпигенетических меток в других биологических субстратах. Полученные знания об эпигенетической регуляции позволят в будущем внедрить их в развитие новых терапевтических методов. Одним из наиболее изученных эпигенетических механизмов, осуществляющих контроль генной экспрессии, является метилирование в области CpG динуклеотидов в промоторных регионах ДНК [16, 17].
Целью исследования было изучение профиля метилирования ДНК в плаценте при задержке роста плода (ЗРП).
Материалы и методы
Было изучено 38 образцов плацент от пациенток, которые поступили и были родоразрешены в ФБГУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России. Женщины были разделены на 2 группы: 1-ю группу составили 18 пациенток c подтвержденным диагнозом ЗРП, 2-ю группу – 20 женщин с физиологическим течением данной беременности. Данное исследование было одобрено локальным этическим комитетом ФБГУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России, всеми пациентками было подписано информированное согласие на участие. Критериями включения в исследование послужили: спонтанная одноплодная беременность, отсутствие острых инфекционных заболеваний, тяжелых экстрагенитальных патологий и миомы матки больших размеров у матери, отсутствие хромосомных и генетических аномалий и пороков развития у плода.
Забор плацентарной ткани производили сразу после родов. Образцы плацент были обработаны и отмыты от материнской крови в физиологическом растворе при температуре –4 °С. В исследовании были использованы ворсины хориона в месте прикрепления пуповины. Образцы тканей хранили при температуре –80° С. ДНК из ткани выделялась с использованием колонок «К-сорб» («Синтол», Россия) согласно протоколу изготовителя. Далее ДНК подвергалась бисульфитной конверсии с использованием набора Epijet (Thermo Scientific, США), в результате которой все неметилированные цитозины конвертировались в урацилы, а метилированные – не изменялись. После этого проводили полимеразную цепную реакцию (ПЦР) с праймерами к фрагменту островка метилирования генов-кандидатов, в результате которого урацилы заменялись на тимины. Отбор праймеров производили по критерию отсутствия динуклеотидов CpG. Уровень метилирования исследуемого фрагмента определяли с помощью анализа кривых плавления с высоким разрешением (methylation-specific high resolution melts, MSHRM) с использованием программного обеспечения Precision Melt Analysis Software, версия 3 (BioRad, США) [18]. Для количественной оценки метилирования использовали относительные единицы интенсивности флуоресценции (RFU) при температуре максимального расхождения кривых согласно методике, описанной ранее Красным А.М. и соавт. [19]. ПЦР и анализ кривых плавления с высоким разрешением проводили с использованием амплификатора CFX-96.
На основании данных литературы, с целью исследования уровня метилирования были отобраны гены с потенциальной ролью в патогенезе ЗРП – CDO1, MMP2, CEBPA, LEP, HLAG, VEGF, MEST, CDH1, GNA12, TLR2, BMP6, DAPK3, DFNA5, импринтинг-контролирующей области IGF2/H19.
Для статистического анализа и построения графиков использовали пакеты статистических программ Statistica 10 и OriginPro 8.5 (США). Для проверки гипотезы о нормальном распределении использовался критерий Шапиро–Уилка, для проверки равенства дисперсий – критерий Левина. Статистический анализ проводили с помощью параметрического t-критерия Стьюдента при соблюдении нормального распределения и непараметрического критерия Манна–Уитни – при несоблюдении условий нормального распределения. Сравнение групп по качественным признакам проводили с помощью точного критерия Фишера. Количественные данные представлены в виде медианы, верхней и нижней квартили Me (Q1;Q3). Различия между статистическими величинами считали статистически значимыми при уровне достоверности p<0,05.
Результаты и обсуждение
 Между исследуемыми группами не были получены статистически значимые различия по возрасту и антропометрическим данным между исследуемыми группами беременных (p>0,05). Гестационный срок при родоразрешении в группе с ЗРП составил 35,4 (33,7; 37,5) недели, что было обусловлено наличием показаний для экстренного досрочного родоразрешения путем операции кесарева сечения (КС). Клинико-анамнестические данные представлены в таблице.
Между исследуемыми группами не были получены статистически значимые различия по возрасту и антропометрическим данным между исследуемыми группами беременных (p>0,05). Гестационный срок при родоразрешении в группе с ЗРП составил 35,4 (33,7; 37,5) недели, что было обусловлено наличием показаний для экстренного досрочного родоразрешения путем операции кесарева сечения (КС). Клинико-анамнестические данные представлены в таблице.
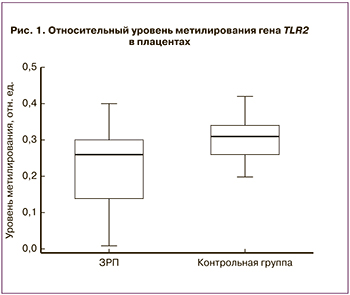
Изучение метилирования генов в плаценте показало, что относительный уровень метилирования гена толл-подобного рецептора 2 (TLR2) в группе ЗРП составил 0,26 (0,14;0,28), что было статистически ниже по сравнению с группой условно здоровых беременных (0,31 (0,26;0,34), р=0,01). Данные представлены на рис. 1.
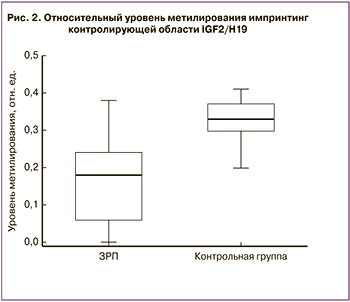
Исследование уровня метилирования импринтинг-контролирующей области инсулиноподобного фактора роста 2 (IGF2) и H19 также показало статистически значимое снижение относительного уровня метилирования в плацентах с ЗРП (0,18 (0,06;0,21)) по сравнению с контрольной группой (0,33 (0,29;0,36), p<0,001). Данные представлены на рис. 2.
 Как известно, TLR2 является мембранным белком из класса толл-подобных рецепторов, играющим ключевую роль во врожденном иммунитете, и обнаруживается в плаценте с ранних сроков беременности, увеличиваясь в присутствии инфекционных агентов [20, 21]. Кроме того, TLR2 участвует в регуляции апоптоза клеток цитотрофобласта с I триместра беременности путем усиления его активности [22–24]. Таким образом, снижение уровня метилирования гена TLR2 может приводить к усилению экспрессии TLR2 и, как следствие, повышенному апоптозу в плаценте, играющему важную роль в патогенезе ЗРП.
Как известно, TLR2 является мембранным белком из класса толл-подобных рецепторов, играющим ключевую роль во врожденном иммунитете, и обнаруживается в плаценте с ранних сроков беременности, увеличиваясь в присутствии инфекционных агентов [20, 21]. Кроме того, TLR2 участвует в регуляции апоптоза клеток цитотрофобласта с I триместра беременности путем усиления его активности [22–24]. Таким образом, снижение уровня метилирования гена TLR2 может приводить к усилению экспрессии TLR2 и, как следствие, повышенному апоптозу в плаценте, играющему важную роль в патогенезе ЗРП.
Также в плаценте наблюдается повышенная экспрессия импринтированных генов, которые важны для ее правильного развития [25–27]. В настоящее время большой интерес вызывает изучение импринтинг-контролирующей области генов IGF2 и H19 на хромосоме 11 отцовского происхождения в связи с данными о зависимости метилирования данной области с развитием ЗРП [28]. Метилирование данного региона определяет экспрессию импринтированных генов IGF2 и H19; в случае метилирования повышается экспрессия IGF2 [29]. В исследовании Koukoura O. и соавт. [30] также было продемонстрировано снижение метилирования данной области и повышение экспрессии гена H19 в плацентах при ЗРП. Большой интерес представляет изучение IGF2 в связи с его участием в регуляции процессов пролиферации, дифференцировки и транспорта питательных веществ в плаценте [31]. Xiao X. и соавт. провели исследование уровня метилирования IGF2 в плаценте путем бисульфитного пиросеквенирования и обнаружили его снижение при ЗРП [32]. В подобном исследовании St-Pierre J. и соавт. была обнаружена отрицательная корреляция между уровнем метилирования IGF2 и массой новорожденных [33]. Таким образом, полученные нами данные согласуются с мировыми и подтверждают роль IGF2 в формировании ЗРП.
Заключение
Анализ уровня метилирования исследованных генов показал статистически значимое снижение уровня метилирования гена TLR2 и импринтинг-контролирующей области IGF2/H19 в плацентах женщин с ЗРП. Полученные результаты указывают на роль метилирования гена TLR2 и импринтинг- контролирующей области IGF2/H19 в формировании задержки роста плода и перспективность дальнейшего изучения уровня метилирования данных генов в других биологических субстратах с целью внедрения новых методов диагностики.
- Barker D.J.P., Osmond C. Infant mortality, childhood nutrition, and ischaemic heart disease in England and Wales. Lancet. 1986; 10, 1(8489): 1077–81. doi: 10.1016/s0140-6736(86)91340-1
- Kwon E.J., Kim Y.J. What is fetal programming: a lifetime health is under the control of in utero health. Obstet Gynecol Sci. 2017; 60(6): 506–19. doi: 10.5468/ogs.2017.60.6.506
- Hales C.N., Barker D.J.P. Type 2 (non-insulin-dependent) diabetes mellitus: the thrifty phenotype hypothesis. Int J Epidemiol. 2013; 42(5): 1215–22 doi: 10.1093/ije/dyt133
Дегтярева Е.И., Григорян О.Р., Волеводз Н.Н., Андреева Е.Н., Клименченко Н.И., Мельниченко Г.А., Дедов И.И., Сухих Г.Т. Роль импринтинга генов при внутриутробной задержке роста плода. Акушерство и гинекология. 2015; 12: 5–10.
- Marciniak A., Patro-Małysza J., Kimber-Trojnar Ż., Marciniak B., Oleszczuk J., Leszczyńska-Gorzelak B. Fetal programming of the metabolic syndrome. Taiwan J Obstet Gynecol. 2017; 56(2):133–8. doi: 10.1016/j.tjog.2017.01.001
- Menendez-Castro C., Rascher W., Hartner A. Intrauterine growth restriction - impact on cardiovascular diseases later in life. Mol Cell Pediatr. 2018; 5(1): 4. doi: 10.1186/s40348-018-0082-5
- Faa G., Manchia M., Pintus R., Gerosa C., Marcialis M.A.,Fanos V. Fetal programming of neuropsychiatric disorders.Birth Defects Res C Embryo Today. 2016; 108(3): 207–223. doi: 10.1002/bdrc.21139
- Feil R., Fraga M.F. Epigenetics and the environment: emerging patterns and implications. Nat Rev Genet. 2012;13(2): 97–109. doi: 10.1038/nrg3142.
- Manolio T. A., Collins F.S., Cox N.J., Goldstein D.B., Hindorff L.A., Hunter D.J. et al. Finding the missing heritability of complex diseases.Nature. 2009; 461(7265): 747–53. doi: 10.1038/nature08494
- Salam R.A., Das J.K., Bhutta Z.A. Impact of intrauterine growth restriction on long-term health. Curr Opin Clin Nutr Metab Care. 2014;17(3): 249–54. doi: 10.1097/MCO.0000000000000051
- Chen P.Y., Ganguly A., Rubbi L., Orozco L.D., Morselli M., Ashraf D., et al. Intrauterine calorie restriction affects placental DNA methylation and gene expression. Physiol Genomics. 2013; 45(14): 565–76. doi: 10.1152/physiolgenomics.00034.2013
- Banister C.E., Koestler D.C., Maccani M.A., Padbury J.F., Houseman E.A., Marsit C.J. Infant growth restriction is associated with distinct patterns of DNA methylation in human placentas. Epigenetics. 2011; 6(7): 920–7. doi: 10.4161/epi.6.7.16079
- Vaiman D. Genes, epigenetics and miRNA regulation in the placenta. Placenta. 2017; 52:127–33. doi: 10.1016/j.placenta.2016.12.026
- Marsit C.J. Placental epigenetics in children’s environmental health. Semin Reprod Med. 2016; 34(1): 36–41. doi:10.1055/s-0035-1570028
- Lillycrop K.A., Burdge G.C. Environmental challenge, epigenetic plasticity and the induction of altered phenotypes in mammals. Epigenomics. 2014; 6(6): 623–36. doi: 10.2217/epi.14.51
- Nelissen E.C.M., van Montfoort A.P., Dumoulin J.C., Evers J.L. Epigenetics and the placenta. Hum Reprod Update. 2011;17(3): 397–417. doi: 10.1093/humupd/dmq052
- Moore L.D., Le T., Fan G. DNA methylation and its basic function. Neuropsychopharmacology. 2013; 38(1): 23–38. doi: 10.1038/npp.2012.112
- Wojdacz T.K., Dobrovic A., Hansen L.L. Methylation-sensitive high-resolution melting. Nat Protoc. 2008 3(12):1903–8. doi: 10.1093/nar/gkm013
Красный А.М., Садекова А.А., Волгина Н.Е., Машаева Р.И., Кометова В.В., Хабас Г.Н., Голицына Ю.С., Носова Ю.В., Оводенко Д.Л. Исследование уровня метилирования гена RASSF1 в плазме и опухоли при раке эндометрия. Бюллетень экспериментальной биологии и медицины. 2019; 2: 223–7.
- Ma Y., Krikun G., Abrahams V.M., Mor G., Guller S. Cell type-specific expression and function of toll-like receptors 2 and 4 in human placenta: implications in fetal infection. Placenta. 2007; 28(10): 1024–31. doi: 10.1016/j.placenta.2007.05.003
- Erboga M., Kanter M. Trophoblast cell proliferation and apoptosis in placental development during early gestation period in rats. Anal Quant Cytopathol Histpathol. 2015; 37(5): 286–94.
- Koga K., Aldo P.B., Mor G. Toll‐like receptors and pregnancy: trophoblast as modulators of the immune response. J Obstet Gynaecol Res. 2009; 35(2): 191–202. doi: 10.1111/j.1447-0756.2008.00963.x
- Abrahams V.M., Bole-Aldo P., Kim Y.M., Straszewski-Chavez S.L., Chaiworapongsa T., Romero R., et al. Divergent trophoblast responses to bacterial products mediated by TLRs. J Immunol. 2004; 173(7): 4286–96. doi: 10.4049/jimmunol.173.7.4286
- Silva J.F., Ocarino N.M., Serakides R. Spatiotemporal expression profile of proteases and immunological, angiogenic, hormonal and apoptotic mediators in rat placenta before and during intrauterine trophoblast migration. Reprod Fertil Dev. 2017; 29(9): 1774–86. doi:10.1071/RD16280
- Tycko B. Imprinted genes in placental growth and obstetric disorders. Cytogenet Genome Res. 2006; 113(1–4): 271–8. doi: 10.1159/000090842
- John R.M. Imprinted genes and the regulation of placental endocrine function: Pregnancy and beyond. Placenta. 2017; 56: 86–90. doi: 10.1016/j.placenta.2017.01.099
- Christians J.K., Leavey K., Cox B.J. Associations between imprinted gene expression in the placenta, human fetal growth and preeclampsia. Biol Lett. 2017;13(11): pii: 20170643.doi: 10.1098/rsbl.2017.0643
- Bartholdi D., Krajewska-Walasek M., Ounap K., Gaspar H., Chrzanowska K.H., Ilyana H. et al. Epigenetic mutations of the imprinted IGF2-H19 domain in Silver–Russell syndrome (SRS): results from a large cohort of patients with SRS and SRS-like phenotypes. J Med Genet. 2009; 46(3): 192–7. doi: 10.1136/jmg.2008.061820
- Du M., Zhou W., Beatty L.G., Weksberg R., Sadowski P.D., et al. The KCNQ1OT1 promoter, a key regulator of genomic imprinting in human chromosome 11p15. 5. Genomics. 2004; 84(2): 288–300. DOI: 10.1016/j.ygeno.2004.03.008
- Koukoura O., Sifakis S., Soufla G., Zaravinos A., Apostolidou S., Jones A., et al. Loss of imprinting and aberrant methylation of IGF2 in placentas from pregnancies complicated with fetal growth restriction. Int J Mol Med. 2011; 28(4): 481–7. doi: 10.3892/ijmm.2011.754.
- Tabano S., Colapietro P., Cetin I., Grati F.R., Zanutto S., Mandò C., Antonazzo P. et al. Epigenetic modulation of the IGF2/H19 imprinted domain in human embryonic and extra-embryonic compartments and its possible role in fetal growth restriction. Epigenetics. 2010; 5(4): 313–24. DOI: 10.4161/epi.5.4.11637
- Xiao X., Zhao Y., Jin R., Chen J., Wang X., et al. Fetal growth restriction and methylation of growth-related genes in the placenta. Epigenomics. 2016; 8(1): 33–42. doi: 10.2217/epi.15.101.
- St-Pierre J., Hivert M.F., Perron P., Poirier P., Guay S.P., Brisson D., et al. IGF2 DNA methylation is a modulator of newborn’s fetal growth and development. Epigenetics. 2012; 7(10): 1125–32. doi: 10.4161/epi.21855.
Поступила 20.06.2019
Принята в печать 21.06.2019
Хачатрян Зарине Варужановна, аспирант ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии
им. академика В.И. Кулакова» Минздрава России. Тел.: +7 (909)656-2456. E-mail:
z.v.khachatryan@gmail.com
Адрес:117997 Россия, Москва ул. Академика Опарина, д. 4.
Кан Наталья Енкыновна, д.м.н., профессор ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии
им. академика В.И. Кулакова» Минздрава России. Тел.: +7 (926)220-86-55. E-mail:
kan-med@mail.ru. Researcher ID B-2370-2015. ORCID ID 0000-0001-5087-5946
Адрес: 117997 Россия, Москва ул. Академика Опарина, д. 4.
Красный Алексей Михайлович, к.б.н., заведующий лабораторией цитологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России. Адрес: 117997, г. Москва, ул. Академика Опарина, д. 4; старший научный сотрудник лаборатории эволюционной биологии развития ФГБУН «Институт биологии развития им. Н.К. Кольцова» РАН. Тел.: +7 (495)438-22-72. E-mail:
alexred@list.ru.
Адрес: 119334 Россия, Москва, ул. Вавилова, д. 26.
Садекова Алсу Амировна, к.б.н., научный сотрудник лаборатории цитологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России. Тел.: +7 (495)438-22-72. E-mail:
a_sadekova@oparina4.ru.
Адрес: 117997, Москва, ул. Академика Опарина, д. 4.
Куревлев Сергей Владимирович, младший научный сотрудник лаборатории цитологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России. Тел.: +7 (985)693-66-33. E-mail:
s_kurevlev@oparina4.ru
Адрес: 117997 Россия, Москва, ул. Академика Опарина, д. 4.
Тютюнник Виктор Леонидович, д.м.н., профессор ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии
им. академика В.И. Кулакова» Минздрава России. Тел.: +7 (903)969-50-41. E-mail:
tioutiounnik@mail.ru. Researcher ID B-2364-2015.ORCID ID 0000-0002-5830-5099.
117997 Россия, Москва, ул. Академика Опарина, д. 4.
Для цитирования: Хачатрян З.В., Кан Н.Е., Красный А.М., Садекова А.А., Куревлев С.В., Тютюнник В.Л. Метилирование генов в плаценте при задержке роста плода.
Акушерство и гинекология. 2019; 12:54-8.
https://dx.doi.org/10.18565/aig.2019.12.54-58
 Между исследуемыми группами не были получены статистически значимые различия по возрасту и антропометрическим данным между исследуемыми группами беременных (p>0,05). Гестационный срок при родоразрешении в группе с ЗРП составил 35,4 (33,7; 37,5) недели, что было обусловлено наличием показаний для экстренного досрочного родоразрешения путем операции кесарева сечения (КС). Клинико-анамнестические данные представлены в таблице.
Между исследуемыми группами не были получены статистически значимые различия по возрасту и антропометрическим данным между исследуемыми группами беременных (p>0,05). Гестационный срок при родоразрешении в группе с ЗРП составил 35,4 (33,7; 37,5) недели, что было обусловлено наличием показаний для экстренного досрочного родоразрешения путем операции кесарева сечения (КС). Клинико-анамнестические данные представлены в таблице. Как известно, TLR2 является мембранным белком из класса толл-подобных рецепторов, играющим ключевую роль во врожденном иммунитете, и обнаруживается в плаценте с ранних сроков беременности, увеличиваясь в присутствии инфекционных агентов [20, 21]. Кроме того, TLR2 участвует в регуляции апоптоза клеток цитотрофобласта с I триместра беременности путем усиления его активности [22–24]. Таким образом, снижение уровня метилирования гена TLR2 может приводить к усилению экспрессии TLR2 и, как следствие, повышенному апоптозу в плаценте, играющему важную роль в патогенезе ЗРП.
Как известно, TLR2 является мембранным белком из класса толл-подобных рецепторов, играющим ключевую роль во врожденном иммунитете, и обнаруживается в плаценте с ранних сроков беременности, увеличиваясь в присутствии инфекционных агентов [20, 21]. Кроме того, TLR2 участвует в регуляции апоптоза клеток цитотрофобласта с I триместра беременности путем усиления его активности [22–24]. Таким образом, снижение уровня метилирования гена TLR2 может приводить к усилению экспрессии TLR2 и, как следствие, повышенному апоптозу в плаценте, играющему важную роль в патогенезе ЗРП.



