На протяжении долгого времени рак молочной железы (РМЖ) остается наиболее встречающимся злокачественным образованием у женщин с наибольшим уровнем летальности среди других онкологических заболеваний. В Российской Федерации частота РМЖ выше, чем в среднем в мире, и растет с каждым годом [1]. Хирургия до настоящего времени остается ведущим методом в лечении больных РМЖ. Причем последние десятилетия ознаменовались уменьшением объема хирургического вмешательства как на молочной железе – от классической мастэктомии к органосохранным операциям, так и на органах регионарного метастазирования – от полной лимфодиссекции к биопсии сигнального лимфоузла. Биопсия сигнального лимфоузла значительно сократила число как ранних, так и поздних послеоперационных осложнений. Тем не менее частота осложнений после биопсии сигнального лимфоузла остается довольно высокой (до четверти случаев) [2]. Предлагается полный отказ от биопсии сигнального лимфоузла, если на этапе предоперационной диагностики не получено данных о метастатическом процессе.
Стандартным методом предоперационной оценки подмышечных лимфоузлов у пациенток РМЖ является ультразвуковое исследование. Чувствительность и специфичность ультразвукового исследования в обнаружении метастазов в региональных лимфоузлах при РМЖ составляют в среднем 85% и 90% соответственно и определяются уровнем приборной базы и компетентностью оператора [3]. Попытки улучшить эти показатели с использованием магнитно-резонансной и позитронно-эмиссионной томографии не были успешны. Чувствительность и специфичность диагностики с использованием магнитно-резонансной томографии в среднем составляет 88% и 90%, но она противопоказана пациентам с аллергией, кардиостимуляторами, почечной недостаточностью. Также точность анализа сильно зависит от случайно возникающих артефактов изображения, из-за чего чувствительность может падать до 60% [4]. К недостаткам позитронно-эмиссионной томографии относятся низкая чувствительность при диагностике метастазов в подмышечные узлы [5]. Остается актуальным поиск биомаркеров метастазов в регионарных лимфоузлах на основе клинических, инструментальных, молекулярных данных, в частности: возраст женщины, размер и гистологический подтип первичной опухоли, лимфоваскулярная инвазия, HER2-статус и другие [6, 7].
Наиболее распространенным подходом к поиску молекулярных маркеров злокачественного процесса является масс-спектрометрический и ядерно-магнитно-резонансный анализ метаболома и протеома опухолевой ткани и плазмы крови. Липиды являются биологически активными соединениями, регулирующими ряд важных клеточных процессов: пролиферацию, апоптоз и ангиогенез [8]. Различия в липидном профиле позволяют идентифицировать патологические процессы в ткани [9]. Высокоэффективная жидкостная хроматография с масс-спектрометрией (ВЭЖХ-МС) служит наиболее информативным методом анализа липидов [10].
Целью данного исследования было изучение возможности хромато-масс-спектрометрического анализа первичной опухоли и окружающих тканей в диагностике метастазирования в регионарные лимфоузлы при РМЖ.
Материалы и методы
В исследование были включены 44 пациентки с РМЖ в ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» Минздрава России. Критериями исключения стали неоадъювантная терапия и наличие злокачественных новообразований другой локализации до постановки диагноза РМЖ. Исследование получило одобрение этического комитета ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» Минздрава России, все пациентки подписали информированное согласие.
Более половины пациенток (55%) имели метастазы хотя бы в один лимфатический узел. У пациенток с метастазами в региональные лимфоузлы стадия pT1N1M0 была диагностирована в 5 (21%) случаях, стадии pT2N1-3M0 – в 18 (75%), стадия pT3N3M0 – у 1 (4%) пациентки. В группе пациенток без метастазов в регионарные лимфоузлы половина имели стадию pT1N0M0, вторая – pT2N0M0.
У каждой пациентки были получены по 2 образца ткани молочной железы: опухолевый участок и участок нормальной ткани вдали от опухоли. Гистологическая верификация была проведена для каждого образца. Анализ липидного состава ткани проводили методом ВЭЖХ-МС по разработанному ранее протоколу для определения липидного состава ткани [9, 11–14]. В частности, высушенный экстракт липидов перерастворяли в смеси ацетонитрил/изопропанол (1/1) и разделяли на хроматографе Dionex UltiMate 3000 (Thermo Scientific, Германия) с детекцией на масс-спектрометре Maxis Impact qTOF (Bruker Daltonics, Германия) в режиме положительных и отрицательных ионов, образующихся в электроспрее. Для уточнения идентификации веществ дополнительно проводилась тандемная масс-спектрометрия с окном сканирования 5 Да.
Полученные .d-файлы преобразовывали в ms2-файлы, содержащие информацию о спектрах фрагментации ионов в каждый момент времени (преобразованию подвергались те .d-файлы, что содержали информацию о тандемной масс-спектрометрии) и MzXml, содержащие информацию о масс-спектре молекулярных ионов в каждый момент времени хроматографического анализа. Для этого использовали свободно распространяемые программы msConvert (Proteowizard, 3.0.9987). MxXml затем обрабатывались в MzMine, выделяя пики ионов с нормированием их на полный ионный ток. Ms2-файлы использовались для идентификации липидов посредством скриптов LipidMatch, соотносящих времена и массы ионов из сформированной MzMine таблицы с информацией о спектре фрагментации заданного иона в заданный момент времени в ms2-файле. Для оценки соответствия спектра фрагментации иона спектру фрагментации липидов использовалась библиотека характерных фрагментов, входящих в состав пакета [15]. Номенклатура липидов соответствует LipidMaps [16].
Статистический анализ
Статистический анализ проводился с использованием скриптов на языке R (3.3.3) в среде RStudio (1.383 GNU) [17, 18]. Клинические данные пациенток и гистологические характеристики тканей, относящиеся к численным характеристикам, были проверены на нормальность с помощью теста Шапиро–Уилка (p>0,05). Наличие статистически значимых различий для нормально распределенных переменных определялось с помощью t-критерия Стьюдента с принятым критическим значением p<0,05. Величины, не отвечающие нормальному распределению, были протестированы непараметрическим тестом Манна–Уитни на наличие статистически значимых различий с принятым критическим значением p<0,05. Для оценки различий в факторных гистологических характеристиках тканей у пациентов с метастазированием и без использовался критерий согласия хи-квадрат Пирсона с принятым критическим значением p<0,05. Идентифицированные липиды проверялись на наличие значимых различий в уровне при наличии и отсутствии метастазов отдельно для опухолевых тканей и для тканей нормальной молочной железы непараметрическим тестом Манна–Уитни с принятым критическим значением p<0,05.
Категориальные данные описывались с использованием абсолютного числа (N) и процентных долей от общего числа пациенток в группе (P) в виде N (P%). Количественные нормально распределенные данные описывались с использованием среднего арифметического (М) и стандартного отклонения (SD) в виде М (SD). Количественные данные с распределением, отличающимся от нормального, представляли в виде медианы (Me) и квартилей Q1 и Q3 в формате Me (Q1;Q3).
Липиды, уровень которых статистически достоверно изменялся в группе, использовались для создания диагностической модели на основе логистической регрессии, оптимизация которой происходила поэтапным добавлением переменных и проверкой информационного критерия Акаике [19]. В качестве переменных использовались уровни липидов в ткани, в качестве переменных отклика – диагноз наличия/отсутствия метастазов. Для оценки качества потенциальной диагностической модели на основе логистической регрессии строилось N логистических регрессий на основе N различных выборок, содержащих (N–1) объект с последующим тестом на не участвующем в построении регрессии объекте, где N – число всех объектов в паре клинических групп. Чувствительность и специфичность оценивались как число истинно-положительных результатов/общее количество пациентов с метастазами и число истинно-отрицательных результатов/общее количество пациентов без метастазов соответственно. Прогностическая ценность положительного и отрицательного результатов оценивались как число истинно-положительных результатов/число положительных результатов и истинно-отрицательных результатов/число отрицательных результатов.
Результаты
Группы пациенток с метастазами и без метастазов в подмышечные лимфоузлы не различались статистически значимо по возрасту, размерам и локализации опухолевого очага, HER2-статусу (табл. 1). В группе без метастазов статистически чаще (p<0,046) регистрировались неспецифический тип (30,0%) и особые гистологические варианты опухоли (35,0%). В группе с метастазами наиболее частым гистологическим вариантом был смешанный вариант (41,7%). В группе пациенток без метастазов в регионарные лимфоузлы часто регистрировались мультифокальные опухоли с высокой степенью злокачественности (G3=55%) и пролиферативной активностью (средний уровень Ki67=30,35%).

Анализ выявил в нормальной ткани молочной железы 6 соединений в режиме положительных ионов и 12 соединений в режиме отрицательных ионов, наиболее существенных для потенциальной диагностики метастазов в регионарные лимфоузлы, а также 4 соединения в режиме положительных и 5 соединений в режиме отрицательных ионов в опухолевой ткани, обладающих теми же предсказывающими свойствами.
Наилучшее качество диагностики демонстрировали модели, полученные в режиме положительных ионов для нормальных тканей – уравнение регрессии (1)* с чувствительностью 81% и специфичностью 78%, и в режиме отрицательных ионов для опухолевых тканей – уравнение регрессии (2)** с чувствительностью 79% и специфичностью 81% (рис. 1, табл. 2, 3). Равное единице отношение шансов по отношению ко всем исследуемым предикторам во всех логистических регрессиях следует из-за того, что в принятой системе единиц единичное изменение уровня липидов является слишком незначительным при используемой нами точности.

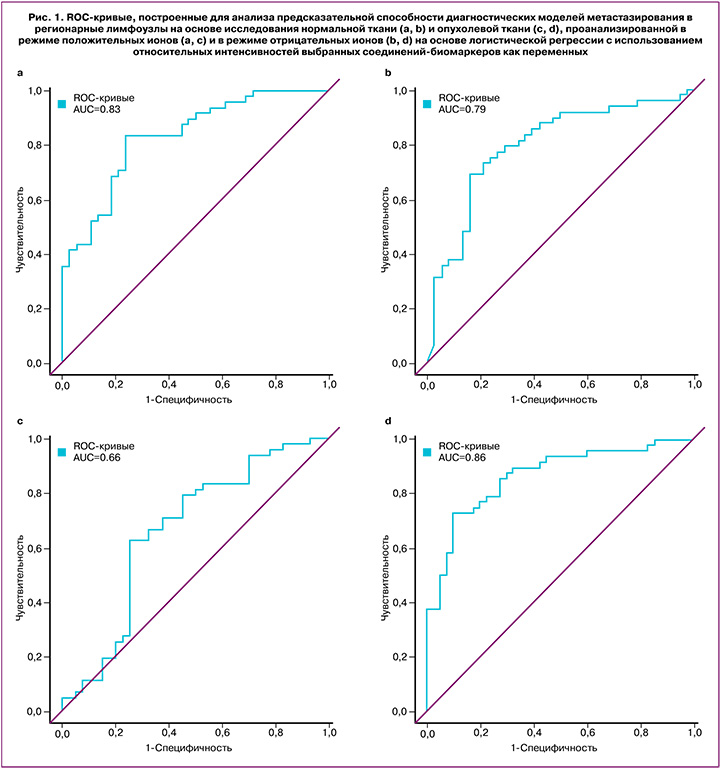
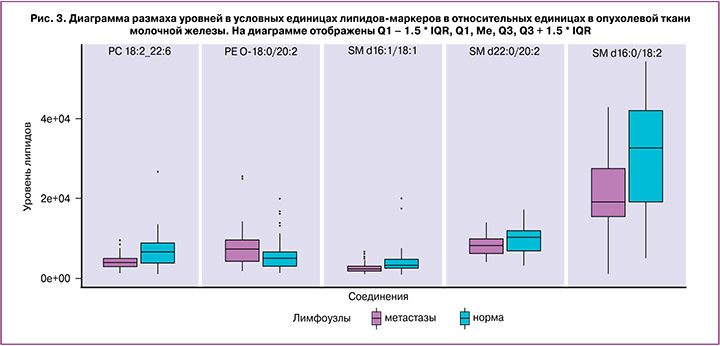
Липиды, определенные как диагностические маркеры метастазирования в лимфоузлы, относятся к классам фосфатидилхолинов (PC 14:0_20:4, PC 18:2_22:6, PC P-16:0/20:4, plasmanyl-PC O-18:0/20:2), фосфатидилэтаноламинов (PE 18:1_20:1, PE P-16:0/22:4), эфирных липидов (PC P-16:0/20:4, PE P-16:0/22:4, PC O-18:0/20:2) и сфингомиелинов (SM d18:1/18:0, SM d18:1/22:0, SM d18:1/22:0, SM d22:0/20:2, SM d16:0/18:2) (рис. 2, 3).
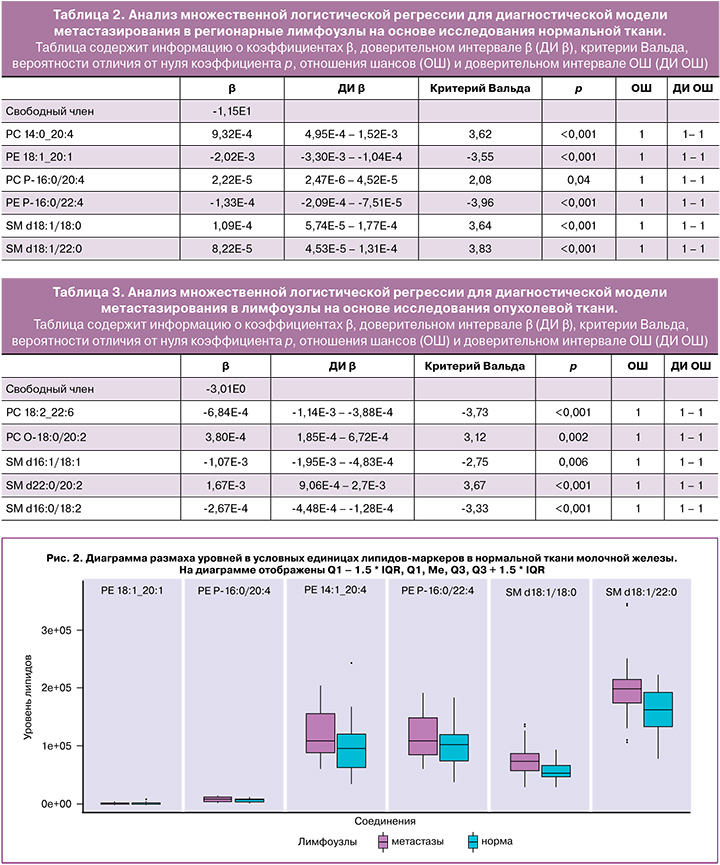
Из приведенных диаграмм размаха видно, что для сфингомиелинов в нормальной и в опухолевой ткани направления изменения уровня при наличии метастазов противоположны (растет в нормальной ткани и падает в опухолевой), а уровень эфирных липидов повышается при наличии метастазов в обоих типах тканей.
Обсуждение
Сфингомиелины являются участниками реакций, запускающих процессы апоптоза при участии сфингомиелаз, расщепляющих сфинголипиды до церамидов, индуцирующих активацию протеина фосфолипазы, ответственной за подавление клеточного роста и деления клетки [20, 21]. При этом уровень гена SMPD3, ответственного за экспрессию нейтральной сфингомиелазы, повышен в опухолевых тканях по сравнению с нормальными тканями молочной железы [20]. Кроме того, у мышей с деактивированным геном кислой сфингомиелазы, которым вводились клетки меланомы, метастазирование было значительно меньше выражено, по сравнению с мышами с нормальным геномом [22]. Roy et al. сообщают о более низком уровне сфингомиелинов в метастатических клетках рака кости по сравнению с первичными неопластическими клетками рака кости [23]. Также Peng в статье, посвященной сравнению метаболомного профиля двух типов линий клеток рака толстой кишки, пишет о значимо более высоком уровне сфингомиелинов в линии клеток рака, менее склонной к метастазированию [24].
Эфирные фосфолипиды являются одними из липидных маркеров неопластического поражения ткани [25]. Для клеточных линий с высоким метастатическим потенциалом зафиксировано более высокое содержание фосфатидилхолинов и фосфатидилэтаноламинов с эфирной связью, по сравнению с клеточными линиями с низким метастатическим потенциалом [26].
Заключение
Метастатическое поражение регионарных лимфоузлов сопряжено с изменениями липидного состава опухолевых и нормальных тканей молочной железы. Причем изменение уровня сфингомиелина различается для нормальной и опухолевой ткани, что может свидетельствовать о нарушении в метаболических путях, связанных с апоптозом. Таким образом, существует потенциальная возможность использования липидного профиля нормальных и опухолевых тканей молочной железы для прогнозирования метастатического поражения регионарных лимфоузлов у больных РМЖ.



