Результаты научных исследований последних десятилетий значительно улучшили наше понимание механизмов патогенеза преэклампсии; однако до сих пор нет четких представлений об этиологии данного осложнения беременности и основных триггерных факторах его развития. До настоящего времени не удалось объяснить такие особенности преэклампсии, как появление клинических симптомов только во второй половине беременности (в перинатальном периоде – после 22 недель гестации, когда возможно выживание плода вне матки), ее развитие только у человека [1]. По‑прежнему отсутствует эффективная превентивная стратегия, а единственным методом лечения остается родоразрешение.
В связи с многогранностью и широкой вариабельностью преэклампсии в плане материнской генетической предрасположенности, ассоциации с рядом заболеваний (сахарный диабет, хроническая артериальная гипертензия, метаболический синдром и др.), разнообразием клинических проявлений, идеальным инструментом в изучении ее молекулярных механизмов являются омиксные технологии, которые позволяют получить и обработать колоссальный объем данных («Big Data») [2].
Омиксные технологии включают в себя высокопроизводительный качественный и количественный анализ генов (геномика), РНК (транскриптомика), белков (протеомика) и метаболитов (метаболомика) с использованием таких методов, как жидкостная хроматография в сочетании с масс‑спектроскопией (LC–MS), секвенирование нового поколения (NGS) и массивы чипов [3].
В последние десятилетия значительно усовершенствованы методы протеомики для идентификации и количественной оценки белков в различных биологических жидкостях и тканях, а также анализа их посттрансляционных модификаций. Современные платформы LC–MS позволяют проводить анализ тысяч белков всего за 1–2 ч [3]. Источником биологического материала могут быть сыворотка/плазма крови, моча, плацента, спинномозговая жидкость и другие [4].
Количественный протеомный анализ плазмы или сыворотки крови с целью поиска биомаркеров, ассоциированных с преэклампсией, уже давно является одной из важных задач омиксных исследований [5]. С одной стороны, кровь – это легко доступный источник биологического материала, с другой – наиболее репрезентативная среда, поскольку содержит белки, секретируемые всеми тканями, включая плацентарную и децидуальную. В то же время протеом плазмы/сыворотки крови отличается сложностью и большим динамическим диапазоном. 99% всех белков плазмы составляют 20 наиболее распространенных белков (альбумин, антитела, аполипопротеины, белки комплемента и другие), которые затрудняют выявление и количественное определение менее распространенных белков [6].
Исследования показали, что протеомный профиль материнской крови может отражать процессы роста и развития плода, состояние иммунной системы, функционирование систем обеспечения гестационного процесса, прогнозировать осложнения (в частности, преэклампсию) и исходы беременности [7–9].
Несмотря на то что протеом материнской крови практически не изучен в динамике развития даже здоровой беременности, сравнительный протеомный анализ плазмы крови беременных в норме и при преэклампсии может оказаться полезным для выявления белковых факторов и биологических процессов, изменение которых сопряжено с осложненным течением беременности и нарушением развития плода [10].
Кроме того, в России практически отсутствуют исследования, посвященные анализу протеома биологических жидкостей и тканей у беременных в целом и при преэклампсии в частности. В отечественной литературе имеются единичные публикации по данной проблеме [11, 12].
В связи с вышеизложенным, целью настоящего исследования явилось изучение молекулярно‑биологических особенностей развития преэклампсии на основании сравнительного протеомного анализа плазмы крови здоровых беременных и беременных с преэклампсией с использованием масс‑спектрометрии сверхвысокого разрешения и проведением кластерного анализа дифференциально отличающихся при преэклампсии белков.
Материалы и методы
Обследованы 27 беременных женщин: 15 здоровых пациенток с физиологическим течением беременности (контрольная группа, сроки гестации в среднем 39,5 (39,5; 40,0) недели) и 12 пациенток с тяжелой преэклампсией (основная группа, сроки гестации в среднем 32,1 (29; 35) недели). Выявление инфекций и воспалительных процессов любой локализации, а также пороков развития плода, хромосомных и генетических аномалий служило критерием исключения пациенток из исследования. Всем женщинам основной и контрольной групп проведены общеклинические, лабораторные и инструментальные методы исследования (ультразвуковое исследование плода и плаценты, допплерометрия, кардиотокография), а также у них определен протеомный профиль плазмы крови с использованием хромато‑масс‑спектрометрии сверхвысокого разрешения.
Забор крови для оценки протеома производился при поступлении пациенток в родильный дом, до начала терапевтических мероприятий, в объеме 3–4 мл при помощи вакуумной пробирки с ЭДТА. Далее кровь центрифугировали 10–12 минут при скорости вращения 3000 об/мин, собранную плазму помещали в 2 пробирки типа Эппендорф, маркировали, замораживали и хранили при температуре ‑20°С.
Хромато-масс-спектрометрический анализ
Образцы загружали на изготовленную в лаборатории предколонку 50×0,1 мм, упакованную сорбентом Inertsil ODS3 3 μm (GL Sciences), в растворе, содержащем 2% ацетонитрила, 98% H2O, 0,1% ТФУ, при скорости потока 4 мкл/мин и разделяли при комнатной температуре на колонке из плавленого кварца 300×0,1 мм с эмиттером, изготовленной на приборе P2000 Laser Puller (Sutter, USA) и упакованной в лаборатории сорбентом Reprosil PUR C18AQ 1.9 (Dr. Maisch). Обращенно‑фазную хроматографию проводили на хроматографе Ultimate 3000 Nano LC System (Thermo Fisher Scientific), соединенном с масс‑спектрометром Q Exactive Plus Orbitrap mass spectrometer (Thermo Fisher Scientific) посредством наноэлектроспрейного источника (Thermo Fisher Scientific). Для хроматографического разделения пептидов использовали систему растворителей А (99,9% воды, 0,1% муравьиной кислоты) и Б (19,9% воды, 0,1% муравьиной кислоты, 80% ацетонитрила). Пептиды элюировали с колонки линейным градиентом: 3–35% Б за 105 минут; 35–55% Б за 18 минут, 55–99% Б за 0,1 минуты, 99% Б – в течение 10 минут, 99–3% Б за 0,1 минуты при скорости потока 500 нл/мин. После каждого анализа колонку уравновешивали при 3% раствора Б в течение 10 минут. Масс‑спектрометрический анализ проводили в режиме DDA (TopN=10) со следующими настройками прибора – MS1 сканирование: разрешение 70 000, диапазон сканирования 200–1600 m/z, максимальное время инжекции ионов – 35 мс, уровень AGC – 3×106, MS2 сканирование: разрешение 17 500, HCD фрагментация c энергией 30%, максимальное время инжекции ионов – 80 мс, уровень AGC – 1×105.
Для анализа белков, представленных в плазме в низких концентрациях, произведено их предварительное обогащение с использованием набора Proteominer small capacity kit (Bio‑Rad Laboratories; США), процедура выделения проводилась согласно рекомендациям производителя.
Статистический анализ
Для анализа результатов использовали статистические компьютерные программы SPSS (версия 10.0.7) и Statistica (версии 10.0, StatSoft Inc., США). for Windows.
Для каждой группы пациенток распределение количественных показателей было проверено на соответствие нормальному распределению с помощью критерия Шапиро–Уилка. При описании нормально распределенных показателей использовали форму представления характеристик в виде среднего арифметического значения и стандартного отклонения М (SD), при распределении признаков, отличающихся от нормального, использовали описание в виде медианы (Me) и интерквартильного интервала в формате Me (Q1; Q3). Качественные показатели представлены как в абсолютных (n), так и в относительных (%) величинах.
При сравнении качественных показателей были использованы критерии: двусторонний точный критерий Фишера для малых выборок и Z‑критерий с поправкой для концевых точек (в случае сравнения 0% или 100%), которые позволяли определить, насколько независимо было распределение показателей в группах. При сравнении групп по количественным признакам, имеющим нормальное распределение и равенство дисперсий (по критерию Ливиня), применялся параметрический метод – t‑критерий Стъюдента для двух независимых выборок. В противном случае – при невыполнении данных требований, использовался непараметрический U‑критерий Манна–Уитни.
Анализ полученных массивов хромато‑масс‑спектрометрических данных проводили с использованием компьютерных программ MaxQuant 2.0.3.1 (MQ) [https://www.maxquant.org] и Perseus 2.0.3.1. [https:// maxquant.net/perseus/]. Корреляцию тандемных масс‑спектров с базой данных белковых последовательностей человека проводили, используя базу Swiss‑Prot (www.uniprot.org). Для выявления статистически значимых отличий в содержании идентифицированных белков между группами использован t‑тест для независимых выборок. Значимыми, с учетом поправки метода Бенджамини–Хохберга, считались различия c уровнем ложноположительных идентификаций (FDR) <0,05. Белок считался дифференциально экспрессированным между группами с преэклампсией и контрольной при значении p<0,05 (t‑тест). Иерархический кластерный анализ белков, в котором мерой для определения расстояния между двумя точками на плоскости, образованной координатными осями х и у, принимали Евклидово расстояние (Euclidian Distance), проводился с использованием онлайн‑сервиса DAVID [https://david.ncifcrf.gov/].
Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Все полученные протеомные данные массспектрометрии были переданы в Консорциум ProteomeXchange через партнерский репозиторий PRIDE с идентификатором набора данных PXD009325 и 10.6019/PXD036175.
Результаты
Клиническая характеристика пациенток анализируемых групп и перинатальные исходы представлены в таблице 1. Основная и контрольная группы беременных были сопоставимы по возрасту, социальному положению, наличию вредных привычек, паритету беременностей и родов.
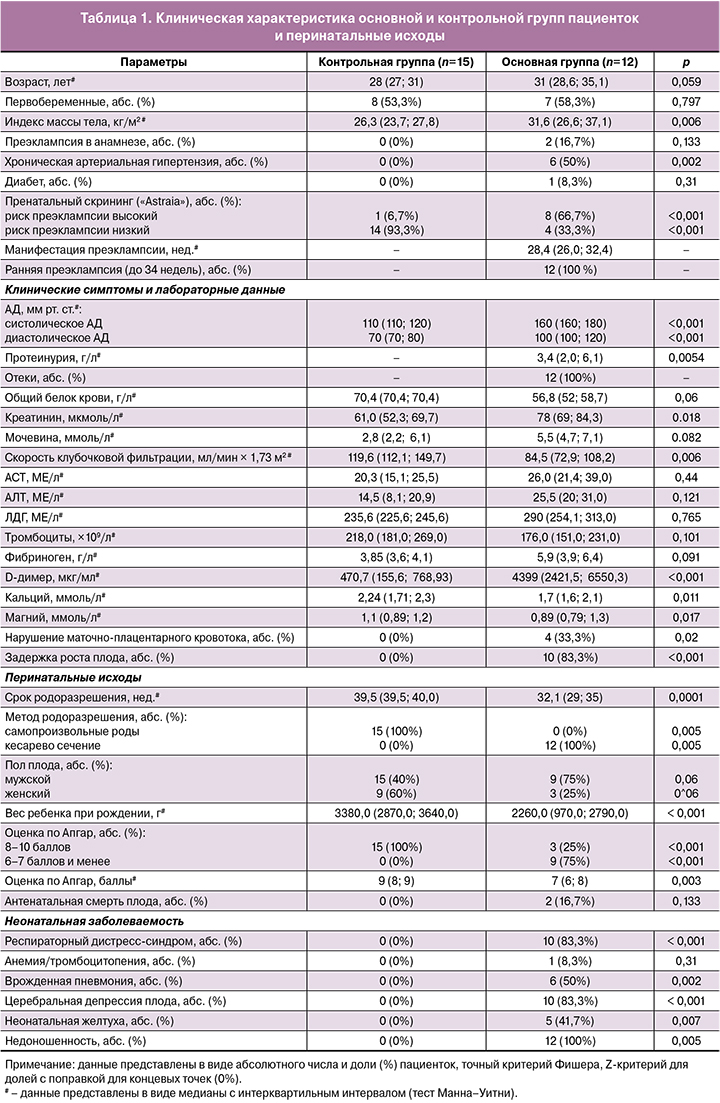
Протеомное исследование плазмы крови в обеих группах позволило идентифицировать около 1500 белков в каждом образце. Дальнейший анализ показал, что протеомный профиль плазмы беременных с преэклампсией имеет отчетливые отличия от контрольной группы в общей сложности по 317 белкам. Изменения 113 из этих белков в основной группе имели статистическую значимость: 70 белков – с повышенной экспрессией, 43 белка – со сниженной. Точечное распределение полученного массива данных масс‑спектрометрии представлено на графике Scatter Plot (рис. 1).
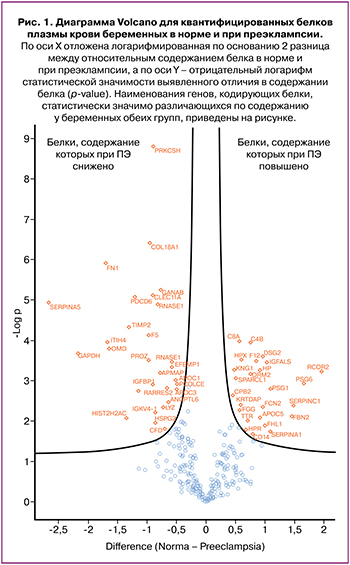
Наиболее важные дифференциально представленные при преэклампсии белки плазмы крови приведены в таблице 2.
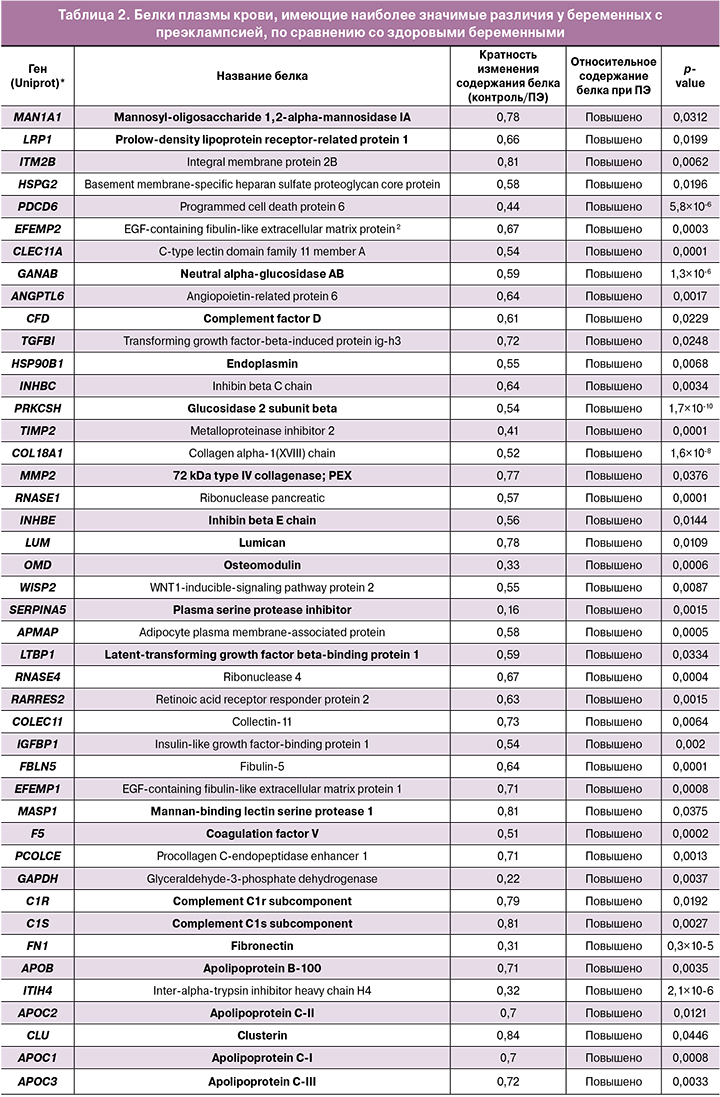
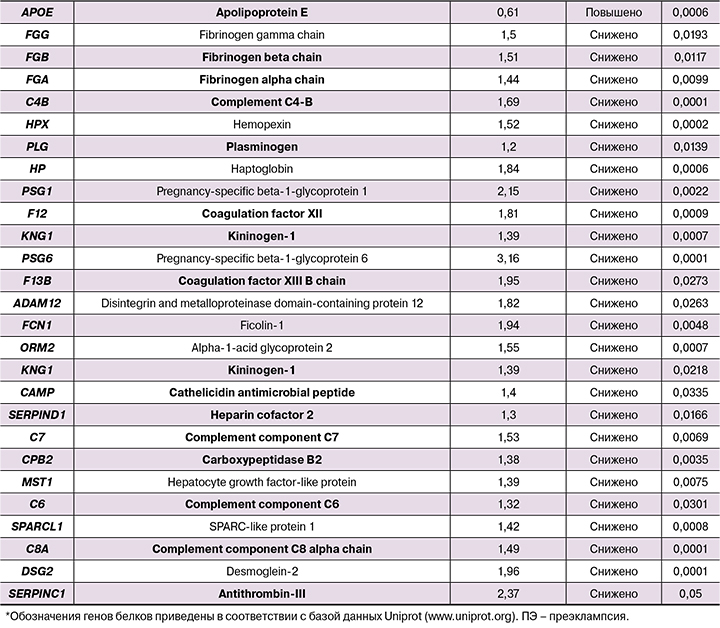
Проведен иерархический кластерный анализ списков идентифицированных белков с использованием онлайн‑ресурса DAVID, который является доступным и широко применяемым инструментом для кластерного анализа массивов идентифицированных белков и генов. DAVID использовался для выявления в списках белков, дифференциально представленных в плазме крови беременных при преэклампсии, основных биологических процессов, молекулярных функций, клеточных компонентов и взаимодействующих белков/генов.
Белки плазмы крови, значимо отличающиеся у беременных с преэклампсией, по сравнению со здоровыми беременными, были разделены на 2 группы – белки с повышенной и сниженной экспрессией. Далее списки идентификаторов каждого белка одной и другой группы были проанализированы при помощи онлайн‑ресурса DAVID с использованием баз данных Gene Ontology [http:// geneontology.org/] и KEGG (Kyoto Encyclopedia Genes and Genomes) [https://www.genome.jp/]. Дифференциально представленные в плазме крови беременных в норме и при преэклампсии белки были распределены на кластеры в зависимости от их молекулярных функций и участия в тех или иных биологических процессах. Результаты кластерного анализа белков плазмы свидетельствуют о крайне широком и многообразном спектре нарушений, определяющих патофизиологию преэклампсии: значимо нарушены более чем 60 биологических процессов, изменены почти 50 молекулярных функций. Наиболее важные биологические процессы, вовлеченные в развитие преэклампсии, представлены на рис. 2.
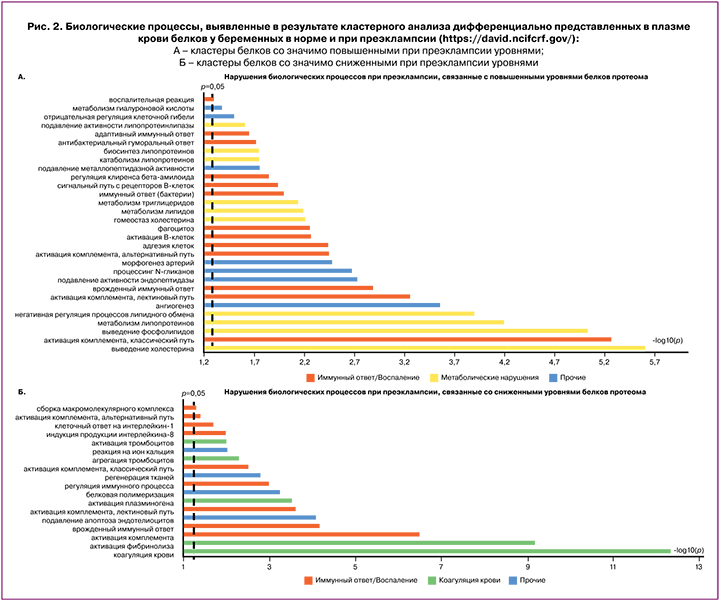
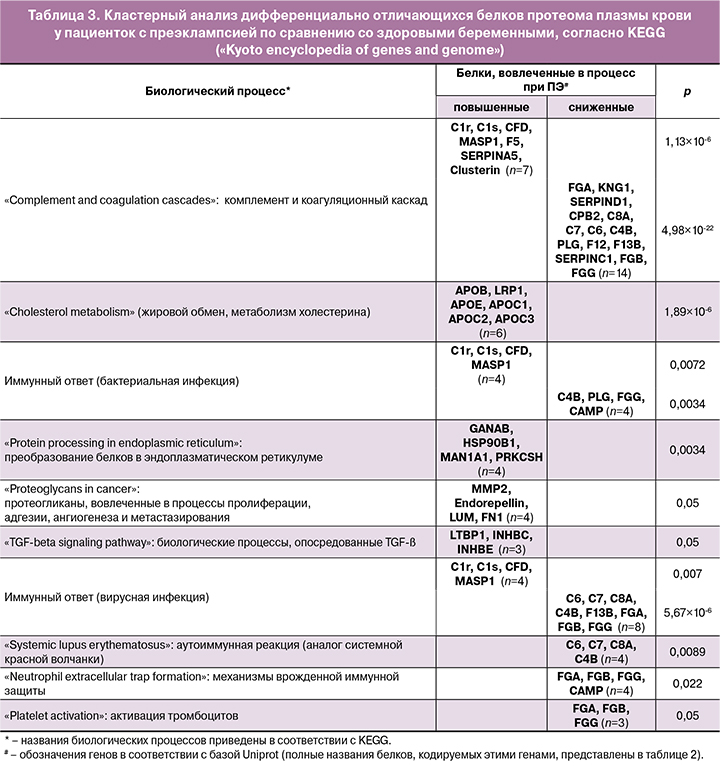
В таблице 3 представлены наиболее крупные и значимые кластеры белков, дифференцированно отличающиеся у пациенток с преэклампсией.
Обсуждение
Проведенное исследование позволило выявить особенности протеомного профиля материнской крови при преэклампсии, который значимо отличается от протеома крови при неосложненном течении беременности. Полученные результаты продемонстрировали изменения широкого спектра циркулирующих белков и связанных с ними патофизиологических нарушений при данном осложнении беременности.
Кластерный анализ белков протеома показал значимые иммунологические нарушения при тяжелой преэклампсии: активацию иммунного ответа (как врожденного, так и приобретенного), развитие аутоиммунных реакций. Преэклампсия долгое время рассматривалась как чрезмерная воспалительная реакция матери на беременность с развитием системного провоспалительного ответа; при этом наиболее выраженные повреждения определяются в материнском эндотелии. Однако, как показали исследования, существует тесная связь между воспалением и системой комплемента, а также каскадом свертывания крови; при этом система коагуляции влияет на активность воспаления, и наоборот [13].
Результаты анализа протеома плазмы крови у пациенток с преэклампсией также свидетельствуют о том, что наиболее выраженные изменения имеют место в системе комплемента и каскаде коагуляции. В целом в данный кластер включен 21 белок, вовлеченный в указанные биологические процессы: 7 белков – с повышенными уровнями, 14 – со сниженными. Кроме того, в группе женщин с преэклампсией отмечена значимая активация функции тромбоцитов.
Система комплемента была открыта более 100 лет назад Жюлем Борде и названа за ее способность «дополнять» роль антител в защите организма от бактерий [14]. С тех пор многочисленные исследования показали широчайший спектр биологических процессов с вовлечением факторов комплемента – от иммунопатологии до системы гемостаза и развития плода.
Как показали исследования, физиологическая беременность сопровождается умеренной активацией системы комплемента. Однако чрезмерная ее активация может быть одной из причин развития так называемых «больших акушерских синдромов» (в том числе преэклампсии) и неблагоприятных исходов беременности [15–19].
Три пути инициации внеклеточного каскада комплемента (классический, альтернативный и лектиновый) завершаются общим терминальным путем: сборкой мембранатакующего комплекса С5b‑9 (МАК) и лизисом клеток. Анализ протеомного профиля плазмы крови беременных с преэклампсией показал значимое повышение факторов комплемента C1r, C1s, CFD, MASP1 и снижение C4B, C6, C7 и C8A, что свидетельствует о вовлечении всех трех путей активации в развитие данного осложнения беременности. Уровни многих других белков каскада комплемента при преэклампсии, в том числе регуляторных, также отличались от контрольной группы; однако различия не были статистически значимы.
C1r и C1s – сериновые протеазы, которые активируются при связывании С1q с комплексом антиген‑антитело, запускающим классический путь комплемента. Рост их уровней – свидетельство активации данного пути активации комплемента. Одним из промежуточных компонентов каскада является образование С4В, снижение которого при преэклампсии, по‑видимому, можно объяснить значительным и/или длительным его потреблением в процессе постоянной активации комплемента. Та же причина приводит к снижению факторов C6, C7 и C8A, потребление которых в процессе образования МАК преобладает над их продукцией в ткани печени.
Повышение CFD (фактора комплемента D) – свидетельство вовлечения альтернативного пути активации комплемента при преэклампсии, уникальной особенностью которого является «автоактивация» путем гидролиза дисульфидной связи белка C3. Альтернативный путь запускается, когда белок C3b напрямую связывается с микроорганизмами, инородным материалом или поврежденными клетками. Далее С3 связывается и изменяет конформацию фактора B, который, в свою очередь, расщепляется CFD с образованием C3‑конвертазы альтернативного пути и терминального комплекса (МАК).
MASP1 – ключевое звено лектинового пути активации комплемента, который индуцируется при связывании маннозосвязывающего лектина (MBL) или фиколинов с моносахаридами на мембране‑мишени, после чего активируются MASP (MBL‑ассоциированные сериновые протеазы), расщепляют C4 и C2 с образованием C3‑конвертазы и сборкой МАК.
Чрезмерная активация системы комплемента при преэклампсии в конечном итоге приводит к истощению факторов каскада и «гипокомплементемии потребления» на фоне несостоятельности регуляторных систем контроля активации. В частности, нами выявлено снижение уровней карбоксипептидазы B2 (CPB2), ингибитора активации классического пути. Выявленное нами повышение кластерина (Clu), который в норме ингибирует комплекс С5b‑8, по‑видимому, носит компенсаторный, но явно недостаточный характер.
Полученные нами данные подтверждает недавнее проспективное исследование He Y.D. et al. [20]. Авторы изучали активацию комплемента при преэклампсии и показали, что нарушение регуляции классического и альтернативного путей имеет место уже с I триместра беременности и сохраняется на протяжении всего периода гестации. В этом отношении показательно исследование группы Karumanchi S.A., которое продемонстрировало значимую корреляцию между высокими уровнями плацентарной растворимой fms‑подобной тирозинкиназы‑1 при преэклампсии и активацией комплемента в плаценте у пациенток с преэклампсией, что способствует комплемент‑опосредованному повреждению плаценты [21].
В связи с вышеизложенным тяжелую преэклампсию необходимо рассматривать как комплемент‑ассоциированное осложнение беременности. При этом современные принципы прецизионной медицины диктуют необходимость проведения дальнейших исследований в отношении возможности таргетной терапевтической коррекции дисфункции комплемента (в частности, применение моноклональных антител к факторам С5, С3, фактору D, МASP‑2, селективных низкомолекулярных пептидов, связывающих аномальные факторы комплемента, блокада синтеза С5 в печени и др.) [22].
Результаты нашего исследования показали, что параллельно с активацией комплемента также инициируется коагуляция и активация тромбоцитов. У беременных с преэклампсией выявлены значимые разнонаправленные изменения 12 белков коагуляционного каскада – повышение коагуляционного фактора V (F5), плазменного ингибитора протеина С (SERPINA5), снижение фибриногена α‑цепи, фибриногена β‑цепи и фибриногена γ‑цепи (FGA, FGB, FGG), кининогена‑1 (KNG1), гепарин‑кофактора 2 (SERPIND1), плазминогена (PLG), коагуляционных факторов XII и XIII (F12, F13B), антитромбина‑III (SERPINC1).
Исследования последних лет свидетельствуют о довольно тесном взаимодействии системы комплемента и коагуляционного каскада, которое проявляется, как при физиологических, так и при патологических состояниях, таких как воспалительная реакция на тромбоз, тромбоз в очаге воспаления, тромботические осложнения при дисфункции комплемента [23]. Пути активации комплемента и системы коагуляции функционально и эволюционно связаны и имеют сходную организацию в виде каскада сериновых протеаз и их регуляторов.
Так, известно, что в месте коагуляции тромбин способен расщеплять фактор комплемента С5 с образованием C5aT (структурно и функционально подобного C5a) и C5bT, участвующего в последующей активации комплемента, приводя к образованию C5bT‑9, обладающего даже более высокой литической активностью, чем C5b‑9. С гораздо меньшей скоростью тромбин также может генерировать классические C5a и C5b [24]. Мощный анафилатоксин C5a, в свою очередь, активирует хемотаксис нейтрофилов и моноцитов к месту тромбоза и увеличивает экспрессию тканевого фактора на моноцитах и эндотелиоцитах, что дополнительно стимулирует коагуляцию [25].
Плазменный ингибитор протеина С (SERPINA5) является прокоагулянтом и провоспалительным фактором и вносит весомый вклад в развитие преэклампсии. Повышение SERPINA5 приводит к блокаде активированного антикоагулянтами протеина С, подавляя его связывание с комплексом тромбин/ тромбомодулин, а также к блокаде других ферментов свертывания крови, включая тромбин и фактор Ха [https://www.uniprot.org/uniprotkb/P05154/entry]. Коагуляционный фактор V (F5) – центральный регулятор гемостаза, является ключевым кофактором в реализации протромбиназной активности фактора Ха, что и приводит к преобразованию протромбина в тромбин. Однонаправленно высокие уровни F5 и SERPINA5 при преэклампсии поддерживают высокий коагуляционный потенциал свертывающей системы крови и являются звеньями диссеминированного внутрисосудистого свертывания.
Что касается других факторов коагуляционного каскада, дифференцированно отличающихся при преэклампсии, нами обнаружено преимущественное снижение их плазменных уровней.
Так, фибриноген‑α расщепляется тромбином до мономеров, которые вместе с фибриногеном‑β и фибриногеном‑γ (FGA, FGB, FGG) полимеризуются с образованием нерастворимого фибринового матрикса, одного из основных компонентов тромбов; γ‑цепь несет также основной сайт связывания с рецептором тромбоцитов.
Кининоген‑1 (KNG1) – белок‑предшественник высокомолекулярного кининогена (HMWK), низкомолекулярного кининогена (LMWK) и брадикинина. HMWK участвует в инициации свертывания крови, активации калликреин‑кининовой системы и образовании брадикинина. KNG1 активируется при повреждении эндотелия, свойственном преэклампсии, связываясь с субэндотелиальными белками и тем самым инициируя коагуляцию (внутренний путь свертывания крови). Описано также его связывание с интактными эндотелиоцитами или тромбоцитами. Снижение KNG1 приводит к уменьшению образования брадикинина, который является мощным эндотелий‑зависимым вазодилататором, а также мягким диуретиком, способствующим снижению артериального давления. Дисфункция калликреин‑кининовой системы, по‑видимому, является еще одним механизмом, поддерживающим артериальную гипертензию при преэклампсии.
Кофактор гепарина II (SERPIND1) представляет собой фактор свертывания крови, который ингибирует IIa и является кофактором для гепарина и дерматансульфата («минорный антитромбин»). Этот белок имеет гомологию с антитромбином III и другими членами семейства альфа‑1‑антитрипсинов. Как показали исследования, у беременных в норме определяются повышенные уровни кофактора гепарина II, который проявляет и более сильную способность ингибировать тромбин у беременных женщин, что защищает их от тромбоза [26]. Дефицит SERPIND1 приводит к увеличению образования тромбина, гиперкоагуляции и артериальным тромбозам [27].
Антитромбин III (АТ-III, SERPINC1) – небольшой гликопротеин, инактивирующий ряд ферментов системы свертывания крови. Физиологическими мишенями антитромбина‑III являются протеазы контактного (внутреннего) пути активации коагуляционного каскада, а именно активированные факторы X, IX, XI, XII и, в большей степени, фактор II (тромбин), а также активированная форма фактора VII внешнего пути тканевого фактора. Дефицит АТ-III потенциально опасен тяжелыми тромбоэмболическими осложнениями как у матери, так и у плода, а также может быть причиной неэффективности антикоагулянтной терапии гепарином и его низкомолекулярными аналогами [28]. Обнаруженное нами снижение уровня плазминогена (PLG) также способствует тромбообразованию, поскольку PLG – циркулирующий профермент, предшественник плазмина, играющий важную роль в фибринолизе.
Дефицит описанных выше факторов свертывающей системы крови у беременных с тяжелой преэклампсией можно объяснить тремя механизмами:
1) повышенная экскреция белков почками, обусловленная нефротическим синдромом и протеинурией;
2) снижение продукции белков на фоне нарушения функций печени;
3) длительное и ускоренное потребление на фоне постоянной активации каскада коагуляции (аналогично «гипокомплементемии» потребления).
Протеом плазмы крови при преэклампсии свидетельствует также об активации тромбоцитов, которые концентрируются в локусах повреждения эндотелия с образованием микротромбов и развитием микроангиопатии. Как показано, активированные тромбоциты, помимо их центральной роли в поддержании гемостаза, способствуют также воспалению, участвуют в процессе атерогенеза и регуляции иммунного ответа [29, 30].
Попытки терапевтического воздействия на перечисленные выше патофизиологические механизмы развития и прогрессирования преэклампсии низкомолекулярным гепарином и аспирином оказались малоэффективными, поскольку не влияют на этиологические факторы [15, 31].
Важным фактом явилось выявленное при преэклампсии значимое изменение кластера белков, свидетельствующее о нарушении молекулярных процессов в эндоплазматическом ретикулуме (ER), где происходят посттрансляционные модификации белков (гликозилирование, ацетилирование, формирование дисульфидных связей и др.). В ER белки сворачиваются с помощью люменальных шаперонов, «упаковываются» в транспортные везикулы и доставляются к комплексу Гольджи. Неправильно свернутые белки остаются в просвете ER в комплексе с молекулярными шаперонами и далее подвергаются деградации. Накопление неправильно свернутых белков вызывает стресс ER и активацию сигнальных путей по восстановлению его функции. Однако в тяжелых ситуациях защитных механизмов оказывается недостаточно, и такие клетки погибают в результате апоптоза [32].
Изучение протеома плазмы у беременных с преэклампсией показало значимое повышение, по‑видимому, компенсаторного характера, HSP90B1 – молекулярного шаперона эндоплазмина, MAN1A1 (mannosyl‑oligosaccharide 1,2‑alpha‑mannosidase IA), участвующей в гликозилировании белков, биосинтенезе гликанов и процессинге протеинов в ER, а также каталитической (GANAB) и регуляторной (PRKCSH) субъединиц глюкозидазы II, участвующей в метаболизме гликанов.
У беременных с преэклампсией выявлено также нарушение механизма «neutrophil extracellular trap (NET) formation» – способности нейтрофилов образовывать нейтрофильные внеклеточные ловушки (NET), тесно связанной с процессом «NETоза». Обнаружено значимое снижение белков данного кластера (FGA, FGB, FGG, CAMP). NETоз представляет собой регулируемую форму гибели нейтрофилов, которая способствует защите организма от чужеродных агентов и патогенов. В процессе NETоза нейтрофилы высвобождают нейтрофильные внеклеточные ловушки, которые могут захватывать и инактивировать бактерии, вирусы и другие чужеродные агенты [33]. Исследования показали, что связь между системами свертывания крови и комплемента очевидна и бесспорна, однако в последние годы в качестве третьего компонента этого взаимодействия рассматривают и NETоз. Нейтрофилы и NET обеспечивают еще одну связь между острым повреждением, тромбозом и воспалением. Кроме того, активно изучается роль NET в инициации аутоиммунных заболеваний, диабета, атеросклероза и системных васкулитов [34].
Эпидемиологические данные последних лет свидетельствуют о том, что преэклампсия связана с 2–4‑кратным увеличением риска сердечно‑сосудистых заболеваний, в частности, хронической гипертензии, ишемической болезни сердца, венозной тромбоэмболии и инсульта [35, 36]. Что касается метаболических осложнений перенесенной преэклампсии, доказательств не так много. В частности, систематический обзор и метаанализ показали, что преэклампсия связана с двукратным увеличением риска развития сахарного диабета II типа в течение 1–10 лет после родов [37, 38].
Изучение протеома женщин с преэклампсией позволило выявить у них значимые изменения кардиометаболического профиля. Особенно выраженные нарушения обнаружены в 23 биологических процессах, вовлеченных в жировой обмен (таких как метаболизм липопротеинов и холестерина, клиренс хиломикронов, выведение холестерина и фосфолипидов, транспорт липидов, биосинтез и сборка липопротеинов низкой и очень низкой плотности, клиренс липопротеинов высокой плотности, гомеостаз триглицеридов, процессы регуляции липидного обмена и др.). К примеру, выделенный нами наиболее крупный кластер «метаболизм холестерина» включал 6 белков c повышенными уровнями (Apolipoprotein B‑100, Apolipoprotein C‑I, Apolipoprotein C‑II, Apolipoprotein C‑III, Apolipoprotein E, Prolow‑density lipoprotein receptorrelated protein 1).
Помимо выраженных нарушений жирового обмена, у беременных с преэклампсией имеют место и другие метаболические и клеточные нарушения (патологическая направленность процессов ангиогенеза, апоптоза (в том числе эндотелиальных клеток), цитолиза, протеолиза, обмена протеогликанов, регенерации тканей, сигнальных путей TGF‑ß и инсулиноподобного фактора роста и др.).
По данным ряда авторов, у женщин с перенесенной во время беременности преэклампсией даже через 1 год после родов при анализе протеома крови сохраняются признаки дисрегуляции таких процессов, как воспаление, иммунный ответ, свертывание крови и обмен веществ, что подчеркивает необходимость долгосрочного мониторинга состояния их здоровья [37].
Таким образом, протеомный профиль плазмы крови у беременных с тяжелой преэклампсией отличается широкой вариабельностью изменений биологических процессов, определяющих особенности патогенеза и клинические проявления данного осложнения беременности. По сравнению со здоровыми беременными отмечаются значимые нарушения, связанные с системой гемостаза, воспалительными и иммунными реакциями, метаболическими, а также клеточными и внутриклеточными процессами.
Также остается открытым вопрос о предшествующем состоянии обнаруженных нами патологических процессов, что требует изучения протеомного профиля крови у таких женщин в динамике – до беременности, в первой ее половине, до появления симптомов преэклампсии. Кроме того, поскольку преэклампсия в настоящее время рассматривается как плацентарный синдром, ценную информацию может дать изучение корреляции между экспрессией белков в плаценте по сравнению с плазмой крови. Современные протеомные технологии имеют большой потенциал в изучении патофизиологии преэклампсии, но есть и некоторые ограничения. Анализ белков с использованием масс‑спектрометрии требует большого количества ресурсов, что ограничивает его практическое применение. По‑прежнему остаются сложности с обнаружением белков с низким содержанием, которые могут иметь диагностический и прогностический потенциал. Мы также признаем относительно небольшой размер выборки пациенток, включенных в исследование, несколько отличающиеся гестационные сроки в основной и контрольной группе (однако все в границах III триместра), что было продиктовано необходимостью одновременного изучения протеома плаценты. Оправдано также изучение протеома при разных фенотипах преэклампсии, что позволит разработать терапевтические, а возможно, и профилактические стратегии. Объединение результатов протеомики с другими разделами системной биологии, такими как метаболомика и геномика, также имеет важное значение для наиболее полного понимания молекулярных механизмов развития преэклампсии.
Заключение
Таким образом, протеомный профиль материнской крови при тяжелой преэклампсии значимо отличается от протеома крови при неосложненном течении беременности, характеризуется вариабельностью изменений, отражающих множественные и разнонаправленные нарушения биологических процессов и молекулярных функций в патогенезе преэклампсии.



