Железодефицитная анемия (ЖДА), или манифестный дефицит железа (МДЖ), является одним из наиболее распространенных осложнений при беременности и оказывает неблагоприятное влияние на состояние матери, плода и новорожденного и обусловлено снижением содержания железа в сыворотке крови и костном мозге и снижением его депонирования [1–3].
В мире насчитывается 60 млн беременных, имеющих МДЖ, и его частота в мире в среднем колеблется от 25 до 50%. В развивающихся странах распространенность МДЖ колеблется от 35 до 75%, а в развитых составляет 18–20%. В России частота ЖДА у беременных колеблется от 40 до 45%, а частота МДЖ у родильниц – от 25 до 28%. По некоторым данным, к концу беременности дефицит железа развивается в скрытой или в явной форме у всех без исключения беременных [1, 3].
Основными свойствами железодефицитных состояний являются их обратимость и возможность предупреждения, чем и объясняется их меньшая частота в развитых странах. Даже в самых ранних, латентных стадиях, дефицит железа имеет биохимические признаки, позволяющие его выявлять, и, следовательно, своевременно скорректировать [4, 5].
Развитие ЖДА при беременности является следствием нарушения равновесия между повышенным расходом железа и его поступлением в организм. Биологическая значимость железа определяется его участием в тканевом дыхании. В связи с этим для ЖДА беременных характерны тканевая гипоксия и связанные с этим осложнения.
У большинства женщин к 28–30-недельному сроку физиологически протекающей беременности развивается анемия, связанная с неравномерным увеличением объема циркулирующей плазмы крови и объема эритроцитов. В результате снижается показатель гематокрита, количество эритроцитов, концентрация гемоглобина [6, 7]. Подобные изменения картины красной крови, как правило, не отражаются на самочувствии беременной, истинная анемия беременных сопровождается типичной клинической картиной и оказывает влияние на течение беременности и родов. По сравнению с анемией, развившейся до беременности, анемия беременных протекает тяжелее [8].
Во время беременности расход железа резко увеличивается вследствие высокой потребности в нем плода и плаценты, кровопотери при родах, кормления грудью (лактация). Баланс железа в этот период находится на грани дефицита, и различные факторы, уменьшающие поступление или увеличивающие расход железа, могут приводить к развитию ЖДА [2, 9].
При ДЖ у беременных возникает прогрессирующая гемическая гипоксия с последующим развитием вторичных метаболических расстройств.
У беременных с тяжелой ЖДА развивается не только тканевая и гемическая гипоксия, но и циркуляторная, обусловленная развитием дистрофических изменений в миокарде, нарушением его сократительной способности, развитием гипокинетического типа кровообращения. Изменения при ЖДА, приводящие к обменным, волемическим, гормональным, иммунным нарушениям у беременных, способствуют развитию акушерских осложнений, частота которых находится в прямой зависимости от степени тяжести анемии [10, 11].
Клинические проявления железодефицитных состояний зависят от степени дефицита железа, скорости его развития и включают симптомы анемии и сидеропении.
Клиническая симптоматика появляется обычно при анемии средней тяжести и нарастает при тяжелой анемии. Она обусловлена неполным обеспечением кислородом и проявляется следующими жалобами: общая слабость, быстрая утомляемость, головокружение, головные боли, шум в ушах, тахикардия, одышка, извращение вкусовых ощущений, нарушение глотания с ощущением инородного тела в горле (синдром Пламмера–Винсона). При объективном обследовании больных обнаруживаются бледность кожных покровов и слизистых оболочек, сухость кожи, появление на ней трещин, возможна легкая желтизна рук и носогубного треугольника, мышечная слабость, ангулярный стоматит, хейлит, атрофия сосочков языка, утолщение и ломкость ногтей, сухость, ломкость волос [12, 13].
Допустимыми пределами физиологической гемодилюции при беременности считаются снижение показателей гемоглобина до 110 г/л, эритроцитов – до 3,6×1012/л, гематокрита – до 32–34%. Эти показатели у небеременных женщин считаются нормальными при значениях гемоглобина от 120 до 140 г/л, эритроцитов – 3,7–4,7×1012/л, гематокрита – от 36 до 42%. Дальнейшее снижение показателей красной крови в условиях повышенной потребности организма беременной женщины в железе следует расценивать как истинную анемию [12, 14].
Экспертами ВОЗ принята следующая классификация анемии у беременных: анемия легкой степени тяжести – концентрация Hb в крови от 90 до 110 г/л; умеренно выраженная анемия – концентрация Hb в крови от 89 до 70 г/л; тяжелая анемия – концентрация Hb в крови менее 70 г/л.
В большинстве случаев для коррекции ЖДА в отсутствие специальных показаний препараты железа следует назначать внутрь. Парентеральный путь введения препаратов железа у большинства беременных без специальных показаний считается нецелесообразным [15, 16].
Одним из наиболее эффективных препаратов для лечения ЖДА является тардиферон. Одна таблетка пролонгированного действия, покрытая пленочной оболочкой, содержит железа сульфат × 1½ H2O – 256,3 мг (что соответствует концентрации железа 80 мг). Основу таблетки составляет запатентованный полимерный комплекс эудрагит в виде матричной структуры, в которую включен активный ингредиент Fe2+. Постепенное высвобождение железа из матричного комплекса происходит главным образом в дистальном отделе тонкой кишки, что повышает его биодоступность. Отсутствие местного раздражающего действия на слизистую оболочку желудка способствует хорошей переносимости препарата со стороны желудочно-кишечного тракта. После приема препарата всасывание железа происходит, главным образом, в двенадцатиперстной кишке и в проксимальном отделе тощей кишки. Тардиферон принимают перорально, при этом предпочтительно принимать лекарственное средство до или во время приемов пищи, запивая водой.
Доза препарата рассчитывается индивидуально и адаптируется в соответствии с общим дефицитом железа по следующей формуле:
Общий дефицит железа (мг) = масса тела (кг) × (нормальный уровень гемоглобина – уровень гемоглобина больного) (г/л) × 0,24 + железо запасов (мг).
После нормализации уровня гемоглобина рекомендуется продолжить прием антианемических препаратов внутрь в профилактических дозах в течение 1 месяца [1, 15, 17, 18]. Лечение железодефицитной анемии всегда длительно, а эффективность напрямую зависит от переносимости препарата пациентом: хорошая переносимость обеспечивает высокую приверженность к лечению и, таким образом, увеличивает вероятность успеха терапии.
Цель исследования: изучение эффективности терапии манифестного дефицита железа у беременных препаратом тардиферон.
Материал и методы исследования
Под нашим наблюдением в течение 2017–2018 гг. находились 108 беременных с одноплодной беременностью и железодефицитной анемией легкой степени. Группу 1 (основная группа) составили 55 беременных, получавших терапию ЖДА препаратом тардиферон, группу 2 (группа сравнения) составили 53 беременных, получавших терапию ЖДА путем приема железа (III) гидроксида полимальтозата с содержанием железа 100 мг.
Критериями отбора беременных в группы были: концентрация гемоглобина от 90 до 110 г/л, сывороточного железа 12,5 мкмоль/л и ниже, ферритина ≤20 мкг/л, гестационный срок 28–32 недели. Продолжительность лечения составила 28 дней, после чего оценивались показатели гемограммы. Оценку эффективности терапии определяли по динамике гематологических показателей и показателей обмена железа.
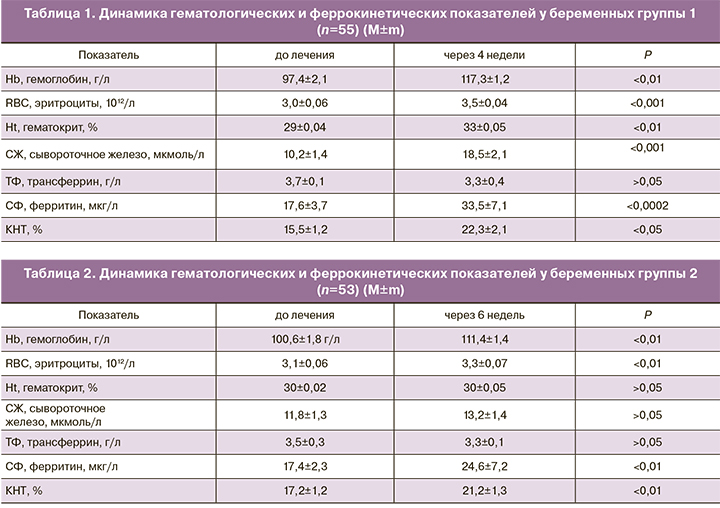
Пациентки обеих групп были сопоставимы по возрасту и паритету. Возраст беременных колебался от 20 до 34 лет и в среднем составил 28,3±1,6 года для пациенток группы 1 и 27,3±2,1 года – для группы 2. Исходное значение гемоглобина в основной группе колебалось от 90 до 110 г/л и в среднем составило 97,4±2,1 г/л в группе сравнения – 100,6±1,8 г/л.
У каждой беременной до начала исследования и через 4 недели проводили определение гематологических и феррокинетических параметров: гемоглобина (Hb), гематокрита (Ht), эритроцитов (RBC), сывороточного железа (СЖ), ферритина (СФ), трансферина (ТФ), а также определяли коэффициент насыщения трансферрина железом (КНТ). После родов, на 3и сутки, определяли уровень: Hb, Ht, RBC.
Количество RBC, концентрацию Hb в периферической крови, показатель Ht определяли на приборе Micros 60 (Франция). Определение концентрации CЖ, СФ и TФ в сыворотке осуществлялось на биохимическом анализаторе «Коnе Ultra» (Финляндия) с использованием стандартных реактивов. Коэффициент насыщения трансферрина железом, отражающий процент насыщения трансферрина железом определяли по стандартной формуле. Статистическую обработку результатов выполняли с использованием прикладных программ для статистической обработки Excel версия 7.0, раздел программы «Анализ данных». Различия между сравниваемыми величинами признавали статистически достоверными при уровне значимости Р<0,05.
Результаты исследования и обсуждение
При анализе осложнений беременности в 1-м и 2-м триместрах пациентки обеих групп были сопоставимы. Через естественные родовые пути произошли роды у 72,7% (40) беременной группы 1 и у 64,1% (34) группы 2. У всех женщин родились живые дети, из них 52 (94,5%) доношенных в группе 1, 50 (94,3%) – в группе 2. Средняя масса тела составила 3560±67 г в основной группе и 3472±62 г в группе сравнения.
Объем кровопотери в среднем составил в группе 1 – 528±64 мл, в группе 2 – 610±55 мл.
Кроме того, проведен анализ характера жалоб при беременности и после родоразрешения. Основные жалобы: шум в ушах, мышечная слабость, головокружение, утомляемость, одышка при физической нагрузке. После проведенного курса лечения препаратами количество жалоб у больных уменьшилось, одышка и слабость исчезли у всех пациенток обеих групп. Клинический и гематологический эффекты были получены через 4 недели приема препаратов у 81% больных. При этом у пациенток группы 1 клинический эффект был достигнут через 2 недели приема препарата, а у пациенток группы 2 – через 3–4 недели.
Уровень Нb, количество RBC, Ht, СЖ, ТФ, СФ в сыворотке крови у обследованных женщин обеих групп приведены в табл. 1 и 2.
Как видно из табл. 1 и 2, у беременных, получавших терапию анемии препаратами обнаружено достоверное повышение как гематологических показателей (Hb и количества RBC, Ht), так и показателей обмена железа в сыворотке: уровня CЖ, СФ, КНТ в обеих группах. Для объективной оценки эффективности лечения в основной группе был подсчитан рост каждого показателя по отношению к исходному уровню, выраженный в процентах. Прирост средних значений гематологических показателей на фоне лечения составил для Hb – 9,5%, для Ht – 1,4%, для RBC – 10,6 %, что соответствует удовлетворительному результату лечения. Однако достоверной разницы в уровне показателей гемограммы после лечения между группами получено не было, но основные показатели гемограммы у пациенток группы 1, получавших лечение препаратом тардиферон были выше по сравнению с группой 2. В связи с этим необходимы дальнейшие исследования эффективности препарата на большей выборке пациенток.
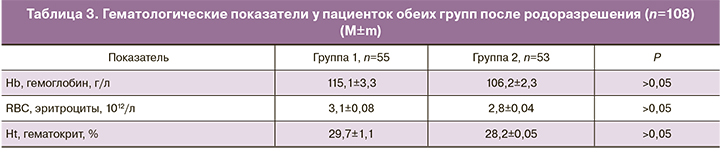
Стоит отметить, что по данным анализа гематологических показателей после родоразрешения, у пациенток группы сравнения имелось снижение всех гематологических показателей, однако достоверной разницы межу группами получено не было (табл. 3).
Таким образом, у беременных с анемией на фоне лечения препаратами железа происходит достоверная нормализация феррокинетических показателей, что приводит к улучшению оксигенации тканей и к благоприятным изменениям в организме беременных с анемией и, как следствие, положительному клиническому эффекту.
Применение солевых препаратов железа, особенно их таблетированных форм немедленного высвобождения, может вызывать токсичность и нежелательные побочные явления: запор, боли в эпигастральной области, рвоту; понос, тошноту, металлический привкус. В нашем исследовании данные побочные эффекты отмечены у 21 (39,6%) при лечении препаратом железа (III) гидроксида полимальтозата и у 5 (9,1%) беременных при лечении препаратом тардиферон, что свидетельствует о хорошей переносимости, и, соответственно обеспечит высокую приверженность к лечению.
Заключение
На основании анализа полученных данных можно сделать вывод, что при ЖДА у беременных тардиферон обладает выраженной терапевтической эффективностью и имеет высокую безопасность. Он характеризуются хорошей переносимостью со стороны ЖКТ, не взаимодействуют с компонентами пищи и применяемыми одновременно хелатными лекарственными средствами.
Таким образом, терапия железодефицитной анемии у беременных препаратами железа является высокоэффективной, приводит к нормализации показателей гемограммы, улучшению общего состояния пациенток, снижению акушерских и неонатальных осложнений.



