Применение антиретровирусной терапии (АРВТ) и химиопрофилактики во время беременности
и в родах снизило риск перинатальной передачи ВИЧ-инфекции до 1−2% [1]. Однако, несмотря на очевидный положительный эффект АРВТ и химиопрофилактики, специалистам приходится иметь дело и с побочными эффектами данного лечения. Анемия − часто встречаемое заболевание у ВИЧ-инфицированных пациенток; она составляет примерно 30% в начальной бессимптомной стадии
инфекции и доходит до 80−90% при прогрессировании заболевания [5].
Основными причинами анемии при ВИЧ-инфекции являются:
1. Снижение продукции эритроцитов вследствие неопластической инфильтрации костного мозга,
инфекционного поражения костного мозга, приема антиретровирусных лекарственных препаратов.
2. Неэффективная продукция эритроцитов вследствие дефицита фолиевой кислоты и витамина В . Во
время беременности ВИЧ-инфицированные пациентки предрасположены к мальабсорбции, которая,
по-видимому, вызывается самой инфекцией.
3. Гемолиз эритроцитов с их значительным фагоцитозом макрофагами костного мозга и выработкой
аутоантител с положительной пробой Кумбса, сниженной резистентностью эритроцитов [3, 4].
Угнетение кроветворения при проведении химиопрофилактики у беременных имеет значение для
анестезиолога-реаниматолога, так как понимание генеза данного осложнения помогает провести правильную коррекцию возникших нарушений в периоперационном периоде. Некоторые антиретровирусные препараты, особенно нуклеозидные ингибиторы обратной транскриптазы (в первую очередь зидовудин), угнетают кроветворение, эритропоэз и вызывают анемию [2]. Не стоит забывать, что зидовудин отличается выраженным миелотоксическим эффектом, в связи с чем данный препарат не назначают лицам с тяжелой анемией (уровнем гемоглобина ≤70 г/л) а при развитии тяжелой анемии на фоне АРВТ – заменяется на другой препарат, не имеющий подобных побочных эффектов (чаще диданозин).
Для анемии, возникающей вследствие применения нуклеозидных ингибиторов обратной транскриптазы, в частности зидовудина, характерно развитие макроцитоза (средний объем эритроцитов >100 фемтолитров – фл), что может быть использовано в качестве объективного критерия угнетения кроветворения на фоне АРВТ [2]. Макроцитарная анемия, вызываемая химиопрофилактикой, не всегда связана с дефицитом витамина В или фолиевой кислоты, а, следовательно, не поддается лечению данными препаратами. Предстоящее оперативное родоразрешение и анемия тяжелой степени диктуют необходимость отмены нуклеозидных ингибиторов обратной транскриптазы (в особенности зидовудина, ламивудина). Препаратом выбора для коррекции анемии на фоне АРВТ служит рекомбинантный эритропоэтин, предпочтительно длительного действия, в редких случаях приходится прибегать к гемотрансфузии [7].
Согласно вышеприведенным данным, анемия является частым осложнением у ВИЧ-инфицированных беременных, принимающих антиретровирусные препараты, что ухудшает течение послеоперационного периода и предопределяет необходимость целенаправленной профилактики и лечения анемии у ВИЧ-инфицированных беременных.
Цель исследования: на основании показателей клинического анализа крови и морфологической
картины эритроцитов выявить характер анемии у ВИЧ-инфицированных беременных, получающих
препараты для химиопрофилактики, а также определить пути коррекции.
Материал и методы исследования
На базе Межрайонного перинатального центра МБУЗ «Клиническая больница № 5» г.о. Тольятти в
период с декабря 2009 по февраль 2012 г. выполнялось проспективное контролируемое клиническое
исследование с участием 162 ВИЧ-инфицированных беременных в III стадии заболевания, со сроком
гестации 37−38 нед, которым выполнялось плановое элективное кесарево сечение Исследуемые
больные основной группы (ОГ) получали АРВТ, начинающуюся после 14 нед беременности и представленную следующими препаратами: калетра (лопинавир+ритонавир) 0,4 г 2 раза в сут, комбивир (ламивудин+зидовудин) 0,45 г 2 раза в сут, никавир (фосфазид) 0,6 г 2 раза в сут, эпивир (ламивудин) 0,15 г 2 раза в сут.
Контрольная группа (КГ) включала 139 пациенток с неосложненным течением беременности.
Пациентки ОГ и КГ были сопоставимы по возрасту, сроку гестации, антропометрическим данным
(табл. 1).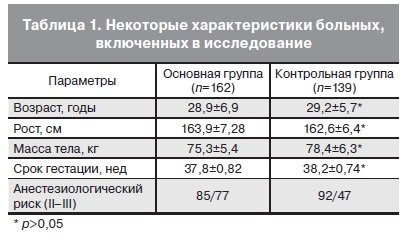
При дальнейшем проведении исследования пациентки ОГ были рандомизированы в 2 подгруппы:
1-я подгруппа – ВИЧ-инфицированные беременные, получающие специфическую предоперационную терапию, направленную на коррекцию анемии. С этой целью назначали внутривенные препараты железа (железа (III)-гидроксид декстран 150 мг внутривенно капельно через день), фолиевую кислоту – 10 мг/сут, химически синтезированный активатор рецепторов эритропоэтина длительного действия − 0,6 мкг/кг внутривенно однократно.
2-я подгруппа – ВИЧ-инфицированные беременные, которым проводилась специфическая предоперационная терапия, но без химически синтезированного активатора рецепторов эритропоэтина длительного действия.
КГ была представлена пациентками с физиологическим течением беременности, сроком гестации
37−38 нед, которые не нуждались в специфической предоперационной терапии.
Критерии исключения из исследования для ВИЧ-инфицированных беременных были следующие:
наличие I, II, IV стадий ВИЧ-инфекции, отказ от приема антиретровирусных препаратов во время
беременности, наличие тяжелых соматических заболеваний у ВИЧ-инфицированных беременных,
влияющих на изучаемые показатели. Критерием исключения из исследования для беременных с
физиологическим течением беременности служило наличие тяжелых соматических заболеваний, влияющих на изучаемые показатели.
У всех больных ОГ после измерения стартовых параметров и регистрации стартовых анализов проводили предоперационную подготовку в течение 7 дней. Предоперационная подготовка в КГ не проводилась. Исследование пациенток ОГ и КГ проводили поэтапно:
I этап − исходный, до начала проведения предоперационной подготовки;
II этап − на 7-е сут лечения, непосредственно перед операцией;
III этап − во время оперативного вмешательства, на этапе гемостаза мягких тканей;
IV этап - через сут после оперативного вмешательства;
V этап – на 5-е сут после оперативного вмешательства.
Премедикация накануне оперативного вмешательства в обеих группах была представлена рутинным назначением диазепама (10 мг внутримышечно) и ингибитора протонной помпы омепразола (20 мг перорально). Оперативное вмешательство в обеих группах проводили в условиях спинальной анестезии маркаином с выполнением Гарвардского стандарта мониторинга.
Гематологические показатели исследовали с помощью автоматического гематологического
анали затора «Sysmex КХ-21». Для экспресс-оценки гематологических показателей (уровней гемоглобина, гематокрит) использовали портативный биохимический анализатор IRMA TRU POINT.
Статистический анализ полученных данных включал описательную статистику по каждому исследуемому показателю, а также проверку гипотезы о статистической значимости различия средних значений 3 групп с помощью дисперсионного анализа на уровне значимости, равном 0,05, и последующим попарным сравнением с учетом поправки Бонфферони. Для сравнения частот осложнений были рассчитаны частотные характеристики выборок в обеих группах, относительный риск (ОР) и 95 % доверительный интервал (ДИ). Вся процедура обработки данных выполнена с использованием пакета статистических программ SPSS 6,0. Различия между выборками считались достоверными при р<0,05.
Результаты исследования
Согласно литературным данным, прием антиретровирусных препаратов, особенно нуклеозидных
ингибиторов обратной транскриптазы, зачастую сопровождается угнетением кроветворения, что
приводит к возникновению макроцитарной анемии. В табл. 2 представлена динамика некоторых
гематологических показателей на всех этапах исследования.
Таблица 2. Динамика некоторых гематологических показателей у обследованных пациенток.
Как видно из табл. 2, на начальном этапе исследования число эритроцитов у ВИЧ-инфицированных
1-й подгруппы ОГ было на 30,7% ниже, чем в КГ, а число эритроцитов у пациенток 2-й подгруппы
ОГ было на 29,2% ниже по сравнению с аналогичными показателями КГ. Снижение продукции
эритроцитов у ВИЧ-инфицированных беременных, скорее всего, связано с угнетением эритропоэза
вследствие приема антиретровирусных препаратов. К 7-м сут лечения число эритроцитов в 1-й подгруппе ОГ увеличилось на 25,5% (2,75±0,46×1012/л на I этапе исследования против 3,69±0,41×1012/л на II этапе исследования), оставаясь все-таки достоверно ниже, чем у женщин с неосложненным течением беременности (p <0,05). На III и IV этапах исследования число эритроцитов в 1-й подгруппе ОГ было также достоверно ниже (p <0,01) по сравнению с показателями КГ. На V этапе исследования число эритроцитов у пациенток 1-й подгруппы ОГ достоверно не отличалось от изучаемого нами параметра КГ (p >0,05). Отсутствие достоверных отличий по числу эритроцитов у пациенток 1-й подгруппы ОГ на 5-е сут после оперативного вмешательства мы связываем с применением активатора рецепторов эритропоэтина длительного действия. Правомерность наших суждений подтверждается и дальнейшими результатами. По сравнению со 2-й подгруппой ОГ, число эритроцитов у пациенток 1-й подгруппы ОГ, начиная со II этапа исследования, было достоверно выше (3,69±0,41×1012/л против 2,84±0,47×1012/л, p <0,01), что свидетельствует о правильной тактике предоперационной подготовки. Показательной была и динамика гемоглобина, уровень которого при поступлении был на 24,2% ниже в 1-й подгруппе ОГ и на 23,7% ниже во 2-й подгруппе ОГ по сравнению с КГ. У пациенток 1-й подгруппы ОГ величина гемоглобина, также как и число эритроцитов в процессе лечения, имела тенденцию к увеличению, составляя на 7-е сут лечения 118,3±11,2 г/л против 93,8±7,74 г/л (p >0,05). Полученные данные свидетельствует об адекватности лечебной концепции. Сохраняющиеся статистически достоверные различия (по числу эритроцитов и уровню гемоглобина) между 1-й и 2-й подгруппами ОГ на всех этапах исследования, указывают на необходимость проведения патогенетической терапии. Препаратом выбора, на наш взгляд, является
активатор эритропоэтиновых рецепторов пролонгированного действия, способствующий более длительной ассоциации с концевыми образованиями чувствительных нервных волокон и гарантирующий более стойкий и продолжительный эффект.
Увеличенный при поступлении средний объем эритроцитов (MCV) (в 1-й подгруппе ОГ был на
28,4% выше, чем в КГ; MCV во 2-й подгруппе ОГ был на 29,2% выше по сравнению с аналогичным
параметром КГ) расценивали как патогномоничный признак анемии при приеме антиретровирусных
препаратов. Увеличение эритроцитов в объеме свидетельствует о нарушении проницаемости клеточной мембраны и указывает на готовность клеток к разрушению. Проведенная комплексная предоперационная терапия в 1-й подгруппе ОГ способствовала значительному снижению данного параметра (88,2±9,3 фл, p >0,05 на II и последующих этапах исследования), чего нельзя сказать о показателях среднего объема эритроцитов во 2-й подгруппе ОГ (p <0,01 на всех этапах исследования, p <0,01 начиная со II этапа исследования). Применение эритропоэтина длительного действия стимулировало синтез функционально активных форм эритроцитов, что подтверждалось и их морфологической картиной.
Оценивая динамику среднего содержания гемоглобина в эритроците (MCH) отметим, что при поступлении ВИЧ-инфицированных пациенток в стационар различие с КГ по данному показателю было статистически недостоверным (28,6±3,15 фл в 1-й подгруппе ОГ против 29,4±2,42 фл в КГ и 28,9±1,68 фл во 2-й подгруппе ОГ против 29,4±2,42 фл в КГ), что прослеживалось и на последующих этапах
исследования (p >0,05, p >0,05, p >0,05). Тем не менее показатель средней концентрации гемоглобина в эритроците (MCHС) на исходном этапе в 1−2-й подгруппах ОГ был достоверно ниже, чем в КГ (320,1±18,5 г/л против 345,6±18,7 г/л, p <0,01; 319,9±19,4 г/л против 345,6±18,7 г/л, p <0,01;). В дальнейшем статистическое различие данного показателя не было достоверным в 1-й подгруппе ОГ (p >0,05). Данный факт – закономерное влияние проводимой специфической терапии, направленной на нормализацию показателей эритропоэза. Помимо лабораторных данных, нарушения гемопоэза, обусловленные приемом антиретровирусных препаратов, иллюстрирует и морфологическая картина эритроцитов.
На (рис. 1, см. на вклейке) представлены окрашенные лейкодиф-200 эритроциты пациентки после
интраоперационной кровопотери (постгеморрагическая анемия) − видны гипохромные эритроциты
и выраженный анизоцитоз.
На (рис. 2 и 3, см. на вклейке) отражена морфологическая картина эритроцитов у ВИЧ-инфицированных пациенток, получающих антиретровирусные препараты. Так, на рис. 2 представлены эритроциты ВИЧ-инфицированной пациентки, которая получала химиопрофилактику
с 32 нед беременности – эритроциты увеличены в размере, имеется выраженный анизоцитоз и гиперхромия эритроцитов. Однако у пациентки, получающей антиретровирусные препараты с 36 нед беременности, анизоцитоз и гиперхромия эритроцитов менее выражены (рис. 3, см. на вклейке). Представленные морфологические данные подтверждают негативное влияние антиретровирусных препаратов на функцию красного кровяного ростка.
На (рис. 4 и 5, см. на вклейке) отражена микроскопическая картина эритроцитов пациентки С.,
которая принимала комбинацию из трех антиретровирусных препаратов с 14 нед беременности.
Практически отсутствуют клетки правильной двояковогнутой формы, характерен выраженный пойкилоцитоз, анизоцитоз, гипохромия красных кровяных телец. Среди представленных эритроцитов преобладают сфероциты, что указывает об аномалии мембраны эритроцитов, нарушении их деформируемости и готовности клеток к гемолизу. Также на рис. 4 и 5 имеется небольшое количество
кодоцитов и шистоцитов, что косвенно указывает на нарушение функции печени. Повышенная агрегационная способность эритроцитов наиболее наглядно отражена на рис. 5. Данное состояние
приводит к нарушению транскаппилярного обмена, выбросу биологически активных веществ, нарушению функционирования клеток крови и транспорта кислорода.
На (рис. 6, см. на вклейке) представлены эритроциты пациентки С. после проведения комплексной
предоперационной подготовки с использованием стимуляторов эритропоэза. Эритроциты уменьшены
в объеме, появились клетки правильной двояковогнутой формы, менее выражены анизоцитоз, пойкилоцитоз, гипохромия эритроцитов. Патологические формы эритроцитов, такие как кодоциты, сфероциты, шистоциты практически отсутствуют, что свидетельствует о появлении нормальных форм эритроцитов. Подобные эффекты достигнуты благодаря применению стимуляторов эритропоэза длительного действия.
Обсуждение
В настоящее время доказано, что основным регулятором эритропоэза является эритропоэтин – фактор роста гликопротеиновой природы. Он контролирует пролиферацию и дифференцировку эритроидных предшественников в костном мозге и влияет на пролиферацию эритробластов, синтез гемоглобина и выход ретикулоцитов в кровь. У ВИЧ-инфицированных беременных вследствие приема нуклеозидных ингибиторов обратной транскриптазы развивается синдром неадекватной продукции эритропоэтина и угнетение эритропоэза. Следовательно, традиционное применение препаратов железа и фолиевой кислоты в данной ситуации является недостаточным.
Предпочтительнее комплексное использование активаторов эритропоэза в сочетании с препаратами железа и фолиевой кислотой. Стимулятор эритропоэза в отличие от рекомбинантного эритропоэтина взаимодействует с эритропоэтиновыми рецепторами на клетках предшественниках костного мозга и характеризуется более длительной ассоциацией с рецептором и более быстрой диссоциацией от рецептора, что позволяет вводить препарат 1 раз в мес. Считаем, что использование активатора эритропоэза в сочетании с препаратами железа и фолиевой кислотой является эффективным и патогенетически обоснованным способом лечения анемии у ВИЧ-инфицированных беременных, принимающих антиретровирусные препараты.
Выводы:
1. У ВИЧ-инфицированных беременных снижена продукция эритроцитов вследствие нарушения гемопоэза при приеме антиретровирусных препаратов – преимущественно нуклеозидных ингибиторов
обратной транскриптазы.
2 Патогенетически обоснованным в лечении анемий у ВИЧ-инфицированных беременных, получающих препараты для химиопрофилактики, является комплексное сочетание активатора эритропоэза в сочетании с препаратами железа и фолиевой кислотой.



