Катетер-ассоциированные инфекции (КАИ) являются частым осложнением при длительной госпитализации в отделениях реанимации и интенсивной терапии (ОРИТ). Способностью образовывать биопленки на поверхности искусственных имплантов обладают многие условно-патогенные микроорганизмы (УПМ). Однако для колонизации имплантов (катетеры, дренажи, интубационные трубки) различной локализации характерно преимущественное заселение специфичными видами УПМ. По данным литературы известно, что для постоянных мочевых катетеров наиболее характерна колонизация Pseudomonas aeruginosa, для эндотрахеальных трубок – Klebsiella pneumoniae, Acinetobacter baumannii, Staphylococcus aureus. Для центральных венозных катетеров (ЦВК) в чаще отмечается колонизация коагулазонегативными стафилококками (CoNS) и дрожжевыми грибами рода Candida [1–3]. Колонизация ЦВК не всегда проявляется клинически, поскольку для манифестации инфекции важно сочетание таких факторов, как вирулентность микроорганизма, степень микробного загрязнения катетера и иммунный статус пациента. В отделениях реанимации новорожденных особую значимость имеют CoNS, являющиеся основными возбудителями позднего неонатального сепсиса у новорожденных, особенно у глубоконедоношенных детей с очень низкой и экстремально низкой массой тела при рождении (ОНМТ и ЭНМТ) [2, 4–6]. CoNS (особенно S. epidermidis) чаще других микроорганизмов обнаруживают в посеве крови новорожденных при манифестации позднего неонатального сепсиса [1]. Причиной того, что микроорганизмы с низким патогенным потенциалом приобрели большое значение в этиологии позднего неонатального сепсиса, считают, с одной стороны, более высокий уровень вирулентности госпитальных клонов CoNS, с другой – дефекты цитокиновых каскадов, опосредованных через Toll-like2 рецепторы (TLR2) и общий сниженный пул гранулоцитарных клеток (нейтрофилов), у недоношенных детей при контакте с CoNS [1, 5, 7]. Первичным источником CoNS-сепсиса может служить как колонизация ЦВК, так и транслокация микроорганизмов со слизистых оболочек в кровь [4, 5]. При этом если транслокация CoNS со слизистых оболочек в кровь возможна только у иммунокомпромитированных пациентов, то катетер-ассоциированная инфекция может манифестировать у детей и с нормальным состоянием иммунитета.
Целью данного исследования было определить частоту колонизации ЦВК у новорожденных и частоту клинических осложнений у этой группы детей.
Материал и методы исследования
Исследование проведено в ОРИТ новорожденных ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России в период с ноября 2014 по август 2016 г. В ходе исследования проанализированы 165 результатов посевов ЦВК от 112 новорожденных, из которых у 34 детей получено несколько ЦВК в разное время; 44 были установлены в пупочную вену, 121 катетер – в периферический венозный доступ на верхних и нижних конечностях. Расчет относительных показателей заболеваемости КАИ проводили в соответствии с Федеральными клиническими рекомендациями «Профилактика катетер-ассоциированных инфекций кровотока и уход за центральным венозным катетером» по показателю плотности инцидентности по формуле [8]:
n = число новых случаев КАИ в исследуемый промежуток времени ×1000 число катетеро-дней всех пациентов с ЦВК в этот же период
Микробиологически подтвержденной катетер-ассоциированной инфекцией считали случаи, когда у новорожденного обнаруживали рост УПМ одного и того же вида в катетере и в гемокультуре, полученной из интактной вены не позднее 48 часов до или после извлечения инфицированного катетера. Общая длительность функционирования исследованных ЦВК составила 1138 катетеро-дней.
Извлечение катетеров у новорожденных для исследования проводили при соблюдении правил асептики и антисептики в реанимационном зале. Дистальный участок катетера отрезали непосредственно возле кювеза стерильными ножницами в две пробирки: с 0,9% NaCl и сахарным бульоном. Посев катетера прокатыванием по чашке Петри в соответствии с рекомендациями не проводили из-за крайне малых размеров катетера, поэтому степень обсемененности ЦВК не оценивали. Оценивали лишь факт наличия или отсутствия колонизации ЦВК. Пробирку с бульоном инкубировали в термостате при температуре 37°С в течение 48 часов. В случае помутнения сахарного бульона проводили высев на чашки Петри с колумбийским агаром и добавлением 5% бараньей крови и на среду Сабуро. Идентификацию выросших колоний осуществляли с помощью времяпролетного масс-спектрометра с програмным обеспечением AutoflexIII (BrukerDaltonics, Германия). Определение чувствительности к антибиотикам выделенных штаммов УПМ проводили с помощью автоматического бактериологического анализатора Vitek2Compact (BioMerieux, США).
Наличие/отсутствие эпизодов отрицательной динамики в клиническом состоянии новорожденных оценивали в двух группах: I группа – новорожденные, катетер которых был колонизирован УПМ, II группа – новорожденные, у которых в катетере после извлечения рост микроорганизмов не обнаружен. Отрицательной динамикой считали появление и/или нарастание дыхательных нарушений, изменение в клиническом анализе крови в виде гиперлейкоцитоза со сдвигом палочкоядерных форм влево, появление и/или увеличение маркеров системной воспалительной реакции (СРБ, ПКТ), а также учитывали гемодинамические нарушения.
Для оценки частоты колонизации катетера в зависимости от длительности стояния новорожденные были разделены на две группы: A – с длительным временем функционирования катетера (более 7 суток) и В – с коротким функционированием катетера (7 суток и менее).
Результаты исследования и обсуждение
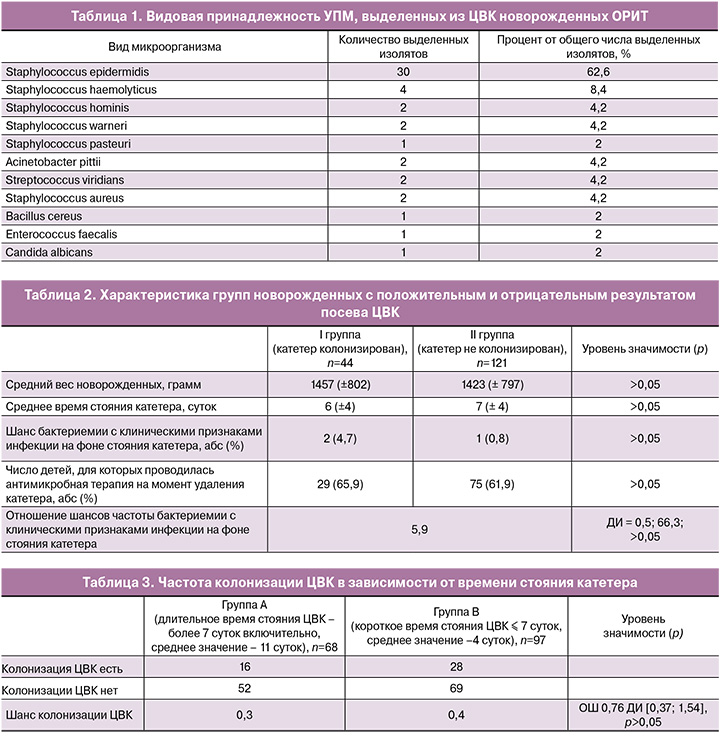
После проведенного анализа установлено, что рост УПМ обнаружен в 44 ЦВК (44/165; 26,6%), из которых выделено 48 штаммов различных УПМ (табл. 1).
По данным, представленным в табл. 1, преобладали CoNS – 81% (39/48) со значительным доминированием вида S. epidermidis, 69% штаммов среди CoNS (27/39) были метициллин-резистентными, ванкомицин-резистентных и линезолид-резистентных штаммов не обнаружено. Оба штамма S. aureus, выделенные из катетеров, были метициллин-чувствительными, но вырабатывали пенициллиназу.
Группы новорожденных с наличием и отсутствием колонизации ЦВК (табл. 2) статистически значимо не отличались по массе тела при рождении, времени стояния катетера и число курсов антимикробной терапии на момент извлечения катетера. При оценке частоты бактериемии с клиническими признаками инфекции на фоне стояния контаминированного и не контаминированного катетеров отношение шансов (ОШ) составило 5,9 (4,7 против 0,8), что говорит о более высокой частоте подтвержденной микробиологически инфекции у детей с колонизированным катетером, однако данное различие не было статистически значимым (p>0,05). В среднем на семь случаев колонизации ЦВК один ребенок имел отрицательную динамику в клиническом состоянии.
Для подтверждения КАИ проанализировано наличие положительной гемокультуры в период 48 часов до и после извлечения катетеров. Среди 165 ЦВК от 112 новорожденных в 54 случаях (32,7%) исследовали кровь на наличие бактериемии. Рост микроорганизмов в крови обнаружен у 4 новорожденных: у одного из них колонизации катетера не обнаружено, у троих – в ЦВК отмечен рост S. epidermidis (3 изолята) и S. haemolyticus (1 изолят в ассоциации с S. epidermidis). В одном случае отмечено несоответствие видов выделенных микроорганизмов из крови и ЦВК: в ЦВК обнаружен рост B. cereus, а в крови – S. epidermidis в ассоциации с S. haemolyticus. Таким образом, частота микробиологически подтвержденной КАИ составила 1,75 на 1000 катетеро-дней.
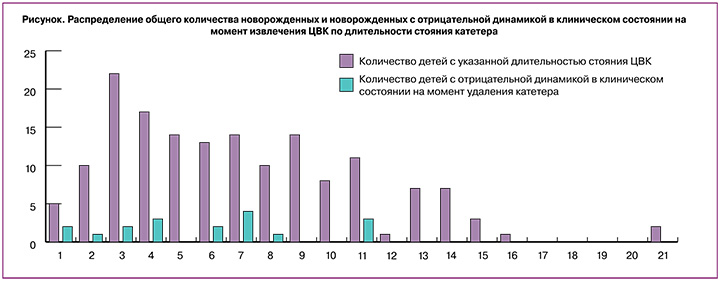
При оценке длительности стояния катетеров среднее значение времени функционирования ЦВК составило 7 суток (min – 1 сутки, max – 21; интерквартильная широта от 5 до 15 суток) (рисунок).
Установлено, что у большинства новорожденных ЦВК длительность функционирования ЦВК составила от 3 до 11 суток (n=99) (рисунок). Эпизоды ухудшения в клиническом состоянии новорожденных чаще развивались в период с 1-х по 11-е сутки функционирования катетера.
Из данных, представленных в табл. 3, видно, что достоверных различий в частоте колонизации ЦВК, функционирующих менее и более 7 суток, не выявлено (0,3 против 0,4; ОШ 0,76), то есть центральный венозный катетер может быть колонизирован УПМ в любой период его функционирования: как на ранних сроках, так и на поздних.
Было проведено сравнение частоты колонизации катетеров и частоты отрицательной динамики в клиническом состоянии новорожденных из разных доступов: пупочного и переферического доступа на конечностях. Частота колонизации ЦВК, установленных в пупочную вену (ПВК), оказалась выше и составила 32% (14/44) против 25% (30/121) для ЦВК из периферического доступа, ОШ=1,3 (p>0,05), однако различие не было статистически значимым. При этом, несмотря на более частую колонизацию ПВК, среднее время стояния ПВК меньше и составило в среднем 3 суток (1–8 суток), чем для ЦВК из периферического доступа: среднее время стояния – 8 суток (2–21 суток).
Таким образом, установлено, что пупочные катетеры были чаще колонизированы УПМ, чем ЦВК из периферического венозного доступа, несмотря на более короткое время стояния. При этом частота случаев отрицательной динамики в клиническом состоянии ребенка на фоне стояния колонизированного пупочного ЦВК и из переферического доступа не была статистически значимой (36% против 43%; ОШ=0,83; p>0,05).
При исследованиях ЦВК на микробную контаминацию принято оценивать титр УПМ, колонизирующих катетер. Но в данном исследовании мы не могли оценивать количество колониеобразующих единиц (КОЕ) при посеве ЦВК, оценивался только факт колонизации катетера. Это связано с техническими трудностями при посеве катетеров со сверхтонким сечением, применяемых в ОРИТ новорожденных. Поэтому оценить взаимосвязь степени обсемененности ЦВК с выраженностью клинических проявлений инфекции в данном исследовании не представлялось возможным. Частота эпизодов отрицательной динамики в клиническом состоянии не зависела от наличия или отсутствия колонизации ЦВК. Возможно, отсутствие статистически значимых различий связано с недостаточной выборкой, поэтому данное исследование будет продолжено. При этом отмечено, что в среднем на 7 случаев колонизации катетеров приходится один случай отрицательной динамики в клиническом состоянии ребенка, но микробиологически подтвержденная КАИ на фоне колонизации ЦВК отмечалась лишь у двух новорожденных. Частота микробиологически подтвержденной КАИ составила 1,75 на 1000 катетеро-дней. Этот показатель не отличается от аналогичных показателей ОРИТ новорожденных США и Европы [2]. В обоих случаях возбудителем КАИ оказался S. epidermidis. Этот вид микроорганизмов является самым частым контаминантом ЦВК как по данным отечественных, так и зарубежных исследователей [1]. Многие авторы связывают этот факт с распространением в госпитальной среде штаммов S. epidermidis, принадлежащих к единому клональному комплексу, родоначальником которого является сиквенс-тип ST2 [9]. Штаммы, филогенетически связанные с этим клональным комплексом, по-видимому, обладают рядом особенностей, позволяющих выживать им в госпитальной среде и получать конкурентное преимущество среди популяции других CoNS. Считается, что госпитальные штаммы CoNS обладают более широким набором факторов вирулентности, в частности, вырабатывают большое количество адгезинов, позволяющих формировать биопленки на поверхности медицинских имплантов – межклеточный полисахаридный адгезин (PIA), который кодируется генами ica-оперона, фибронектин, а также факторы, защищающие клетки CoNS в составе биопленки от иммунного ответа организма хозяина, – антимикробные пептиды (AMP), фенол-растворимые модулины (PSM) [1]. Дополнительным фактором, дающим эволюционное преимущество CoNS в госпитальной среде, является широкое распространение SCCmec-кассеты, несущей ген mecA, обеспечивающий устойчивость бактерий к β-лактамным антибиотикам (метициллин-резистентность). В нашем исследовании частота выделения из ЦВК метициллин-резистентных CoNS составила 69%.
В данном исследовании было выявлено, что колонизация катетеров может происходить на любом этапе их функционирования. При этом частота бактериемии с клиническими признаками инфекции на фоне стояния контаминированного катетера была выше, чем у новорожденных, катетер которых не был контаминирован. Несмотря на то, что эти различия не были статистически значимы в силу небольшой выборки, тем не менее исследование будет продолжено для получения достоверных данных. Частота колонизации длительно функционирующих ЦВК (среднее – 8 суток) статистически значимо не отличалась от таковой у коротко функционирующих (среднее – 3 суток). Контаминация катетера может происходить как во время постановки, так и в процессе эксплуатации. По данным некоторых авторов требуется дополнительный анализ места проведения данной манипуляции (родильный зал, реанимационный зал или развернутая операционная), так как проведение процедуры постановки ЦВК в условиях развернутой операционной многократно снижает риск КАИ, в то время как постановка в условиях реанимационного зала увеличивала этот показатель [2]. Это особенно характерно для ЦВК из пупочного доступа, поскольку такой способ установки ЦВК связан с более высоким риском контаминации, тем не менее, длительное стояние катетера в нашем исследовании не приводило к увеличению частоты колонизации ЦВК микроорганизмами. Полученные результаты не согласуются с данными литературы, поскольку длительное стояние ЦВК считается безусловным фактором риска колонизации и КАИ. Полученное отличие может быть связано с тем, что средняя длительность стояния ЦВК у новорожденных составила 7 суток, максимально – 21 сутки, что значительно меньше, чем у взрослых и детей других возрастных групп, где длительность стояния ЦВК в среднем составляет 30 суток [3]. Причиной контаминации может стать нарушение как техники постановки ЦВК, в первую очередь, из-за трудностей, связанных с венепункцией у недоношенных новорожденных, так и со способами обработки операционного поля во время постановки катетера. В ОРИТ новорожденных Центра обработку кожи перед постановкой ЦВК детям с ОНМТ и ЭНМТ проводят 0,05% водным раствором хлоргексидина. В стационарах Европы и США для этих целей используют также раствор хлоргексидина, но вы более высокой концентрации – 0,5% и в качестве растворителя используют изопропиловый спирт, что улучшает антисептические свойства. Существуют методики обработки операционного поля перед постановкой ЦВК повидон-йодом и раствором спирта. Имеется значительное число дискуссий по поводу антисептической эффективности хлоргексидина в качестве кожного антисептика по сравнению со спиртовыми растворами и повидон-йодом. Но, учитывая особенности строения кожи новорожденных (тонкий роговой слой, обильное кровоснабжение дермы), при использовании спирта могут возникать токсические реакции. По результатам последнего крупного метаанализа, проведенного N.M. Lai и соавт., показано, что на хлоргексидин чаще возникают неблагоприятные реакции в виде контактного дерматита, при этом не обнаружено различий в частоте возникновения как катетер-ассоциированного, так и спонтанного сепсиса у новорожденных при различных способах обработки операционного поля [10].
Различия в доступе при постановке пупочного катетера и ЦВК из периферических вен конечностей определяют и большую частоту колонизации первого по сравнению со вторым способом, несмотря на более короткие сроки стояния, поэтому второй вид доступа при катетеризации должен быть предпочтительным. Тем не менее, несмотря на то что ПВК чаще колонизировались УПМ, это не отразилось на частоте эпизодов отрицательной динамики у новорожденных. При этом оба случая КАИ были связаны с ЦВК из периферического доступа на конечностях.
Важно отметить, что в рутинной клинической практике нет необходимости проводить посев кончиков удаленных венозных катетеров. Положительный результат посевов кончиков катетеров при отрицательном результате посева крови может ввести в заблуждение относительно тактики ведения пациента, в то время как отрицательный результат посева кончика катетера не исключает наличие КАИ [8, 11, 12]. Посев внутривенного катетера допустим лишь для подтверждения источника бактеремии, при условии его проведения одновременно с посевами периферической крови [8].
Так же важно указать, что длительность стояния ЦВК должна быть по возможности минимизирована в связи с высоким риском контаминации катетера и последующим возможным развитием КАИ у ребенка.



