Реализация репродуктивной функции является одним из важных аспектов качества жизни у пациентов молодого возраста. Трансплантация донорских органов для спасения жизни пациента может быть единственным лечением при многих тяжелых заболеваниях внутренних органов. Число трансплантаций органов и тканей постоянно увеличивается и, согласно прогнозам, будет возрастать в дальнейшем [1].
Наличие в анамнезе трансплантированного органа долгое время считалось противопоказанием к беременности. Беременность у женщин с пересаженными органами нередко сопровождается развитием осложнений, таких как артериальная гипертензия, гестационный сахарный диабет, преэклампсия, отторжение трансплантата [2–5]. При этом чаще происходит внутриутробная задержка развития плода и преждевременное рождение недоношенных детей [6].
Совершенствование хирургических методов и особенно тактики иммуносупрессивной терапии улучшили выживаемость и качество жизни женщин с трансплантированными органами, что позволяет многим пациенткам, которые ранее были бесплодны из-за хронической болезни, забеременеть. В настоящее время рождение ребенка стало возможным благодаря современным иммуносупрессивным препаратам, применение которых делает минимальным риск отторжения трансплантата во время беременности. При этом очень важны планирование беременности, подбор схемы и дозировки иммуносупрессивной терапии, необходимой для нормального функционирования трансплантата и обладающей минимальным риском для развивающегося плода [3, 7–10].
Условием существования и функционирования пересаженного органа (если он не от однояйцевого близнеца) является подавление развивающихся иммунологических реакций отторжения, так как антигены трансплантированного чужеродного органа неизбежно вызывают иммунный ответ, поэтому во время беременности нет возможности отказаться от иммуносупрессивных препаратов. Зачатие детей и развитие иммунной системы плода происходят под действием веществ, угнетающих иммунные реакции. Таким образом, беременность протекает на фоне действия вводимых иммуносупрессивных препаратов, и ее исход зависит как от выраженности иммунного ответа, так и от влияния иммуносупрессивных препаратов на развитие плода. Неизбежно возникает вопрос о степени влияния иммуносупрессивных препаратов на становление иммунной системы у плода, ее функционирование и состояние здоровья ребенка после рождения.
В связи с этим целью настоящего исследования явились характеристика состояния здоровья и оценка иммунного статуса новорожденных у матерей с трансплантированным паренхиматозным органом, получавших иммуносупрессивную терапию во время беременности.
Материал и методы исследования
В проспективное когортное исследование были включены 16 женщин с трансплантированным паренхиматозным органом и 20 женщин с физиологическим течением беременности (группа контроля), родивших 16 и 20 детей, соответственно, в ФГБУ «НМИЦ АГиП им. В.И. Кулакова» (2015–2017 годы). Учитывался соматический, акушерско-гинекологический анамнез, течение настоящей беременности, родов, время наступления беременности после трансплантации, схема иммуносупресссивной терапии во время беременности и ее изменения в ходе беременности, а также способ родоразрешения.
Новорожденные были разделены на следующие группы: 1-ю основную группу составили дети (n=16), родившиеся у матерей (n=16) с трансплантированным паренхиматозным органом (у 14-ти – почка, у 2-х – печень), 2-ю группу (контрольную) – дети (n=20), родившиеся у здоровых женщин (n=20) с физиологическим течением беременности. Проводилась оценка течения раннего неонатального периода. Дети оценивались по возрасту гестации, антропометрическим показателям и шкале Апгар на 1-й и 5-й минутах, проводилась оценка течения раннего неонатального периода. Контроль клинического анализа крови с целью диагностики нейтропении, анемии, тромбоцитопении проводился на 1 и 3–4 сутки жизни ребенка. Новорожденным проводилось ультразвуковое исследование головного мозга, сердца, органов брюшной полости и почек, оценка течения раннего неонатального периода. Для оценки иммунного статуса матери и ребенка с целью определения влияния получаемого матерью лечения во время беременности на иммунную систему как матери, так и плода, проводился забор венозной крови перед родами у женщин, пуповинной крови их новорожденных и венозной крови у детей на 3–4 сутки и через месяц от рождения.
Фенотипирование лимфоцитов периферической крови осуществляли методом проточной цитометрии на приборе FACSCanto II (Becton Dickinson, США) с использованием моноклональных антител к поверхностным маркерам CD3, CD16, CD25, CD95, меченных FITC (флуоресцеина изотиоцианатом) и к CD4, CD8, CD19, CD56, CD127, HLA-DR, меченных PE (фикоэритрином), CD4, меченных APC (аллофикоцианином) (BD Biosciences, США). Для оценки позитивно-окрашенных субпопуляций использовали соответствующие изотипические IgG, меченные FITC-, PE- и APC. Лейкоцитарный гейт, позволяющий исключить из анализа другие клетки крови, выявляли с помощью моноклональных антител к CD45, меченных PerCP (перидинин-хлорофилл протеином). Данные анализировали, используя программу FACSDiva (Becton Dickinson, США). Абсолютное содержание лимфоцитов исследуемых субпопуляций рассчитывали, исходя из результатов клинического анализа крови. Содержание иммуноглобулинов классов М, А и G в сыворотке крови определяли турбидиметрическим методом c использованием коммерческих наборов (Human, Германия). Совместно с научно-консультативным педиатрическим отделением осуществлялось наблюдение детей в катамнезе.
Статистическая обработка данных проводилась общепринятыми методами вариационной статистики с использованием пакетов статистического анализа. Соответствие расчетных выборок показателей нормальному распределению оценивали с помощью критерия Шапиро-Уилка с использованием статистического пакета MedCalc12 (Бельгия) для Windows 7. Для оценки различий применяли критерий Стьюдента для данных с нормальным распределением. Результаты были представлены как среднее значение ± стандартное отклонение (Mean±SD). Для оценки различий в выборках, где распределение данных отличалось от нормального, применяли непараметрические критерии: U-критерий Манна-Уитни для независимых выборок и критерий Вилкоксона – для зависимых. В этом случае результаты были представлены как медиана (25-й – 75-й процентили). Различия считали достоверными при уровне значимости Р˂0,05.
Исследование одобрено этическим комитетом ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства здравоохранения Российской Федерации.
Результаты исследования
Женщины, родившие детей, включенные в исследование, были сопоставимы по возрасту. Средний возраст женщин основной группы составил 32,2±5,7 года, возраст женщин контрольной группы – 31,8±5,5 года. Заболеваниями, послужившими причиной трансплантации органа, были следующие: хронический пиелонефрит (n=4), гломерулонефрит (n=7), двухсторонний гидронефроз (n=1), системная красная волчанка (n=2), вирусное поражение печени (n=1), болезнь Вильсона-Коновалова (n=1).
Беременность в 30% случаев наступала в промежутке от 2 до 4 лет после трансплантации. Средний промежуток времени наступления беременности после трансплантации составил 5,5 лет (минимальное время наступления беременности – 2 года, максимальное – 14 лет). В анамнезе у 5 женщин были беременности. Из них 2 искусственных аборта, 2 неразвившиеся беременности и один самопроизвольный выкидыш.
Все женщины основной группы во время беременности получали различные комбинации препаратов: преднизолон (n=14), циклоспорин (n=6), азатиоприн (n=7), такролимус (n=10). В 50% случаев проводилась трехкомпонентная терапия, в 31% случаев – двухкомпонентная и в 19% – однокомпонентная. Следует отметить, что схема иммуносупрессивной терапии менялась с течением беременности: так во 2 и 3 триместрах беременности трехкомпонентную схему иммуносупрессивной терапии получали 12,5% женщин, двухкомпонентную 69%. Наиболее частые сочетания комбинаций препаратов: такролимус и преднизолон, такролимус, азатиоприн и преднизолон.
В этой группе наиболее часто встречались такие осложнения течения беременности, как артериальная гипертензия, угроза прерывания, анемия легкой и средней степени тяжести, острые респираторно-вирусные инфекции.
Родоразрешение в группе матерей с трансплантированным органом в 3 случаях произошло через естественные родовые пути (две женщины с трансплантированной печенью, одна – с трансплантированной почкой и стабильным течением беременности), в 13 случаях – путем операции кесарева сечения. В группе контроля 13 беременностей завершились самопроизвольными родами, 7 – кесаревым сечением.
Новорожденные основной группы имели более низкие массо-ростовые показатели по сравнению с новорожденными из контрольной группы. Однако значимых различий между группами не выявлено. Дети основной группы имели средний вес при рождении 2729,12±595,6 г, контрольной — 3256,85±347,24 г; рост 48,19±4,5 см и 51,0±1,9 см соответственно (p>0,05). Дети из исследуемой и контрольной групп были сопоставимы при оценке по шкале Апгар на 1 и 5 минутах: на 1-й минуте Mе 8,0 (7,0–8,0) и Mе 8,5 (8,0-9,0); на 5-й минуте Mе 9,0 (8,0–9,0) и Mе 9,5 (8,0–9,0) соответственно (p>0,05).
Средний гестационный возраст новорожденных в основной группе составил 36,5±2,7 нед., в контрольной – 39,1±0,8 нед. В основной группе недоношенными родились 4 (25%) ребенка, на сроке беременности менее 32 недель –1 (6,25% от общего числа детей). По сравнению с доношенными, данные дети имеют более высокий риск развития таких патологических состояний как респираторные нарушения, реализация внутриутробной инфекции, нарушения терморегуляции, проблемы усвоения питания, гематологические изменения, гипербилирубинемия и метаболические нарушения.
В структуре заболеваемости новорожденных от матерей с трансплантированными органами были отмечены следующие особенности. По данным нейросонографии выявлена киста сосудистого сплетения у 3-х детей, по данным эхокардиографии у 4-х детей на 3 сутки жизни выявлено стойкое фетальное кровообращение новорожденных. Врожденная пневмония диагностирована у одного новорожденного, у одного ребенка наблюдалась неонатальная желтуха, еще у одного – транзиторное тахипное.
Обследование детей при рождении статистически значимых различий между группами не выявило, что может быть связано с недостаточным количеством детей в основной группе. Поэтому сделать однозначный вывод о наличии или отсутствии вредного влияния иммуносупрессивных препаратов на развитие и состояние плода не представляется возможным.
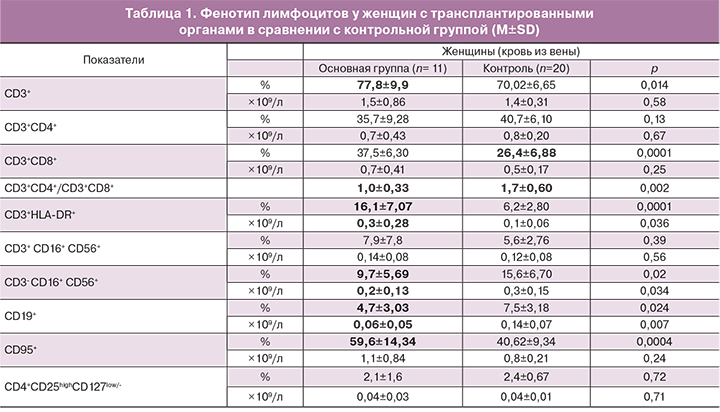
Не выявлено статистически значимых различий в содержании общего количества лимфоцитов в периферической крови матерей основной группы по сравнению с контрольной группой. Но обнаружены изменения в субпопуляционном составе лимфоцитов (таблица 1).
В группе беременных с трансплантированным органом, получавших химиотерапию, наблюдается значительное изменение субпопуляционного состава лимфоцитов в периферической крови. Снижена доля CD3+ Т-лимфоцитов (p<0,05). Снижение соотношения CD3+CD4+ и CD3+CD8+ субпопуляций Т-клеток при сравнении с таковым в контрольной группе (1,0±0,3 против 1,7±0,6 соответственно, p<0,05) произошло за счет снижения CD3+CD4+ -Т-клеток и статистически значимого увеличения CD3+CD8+ Т-клеток. Более чем в 2 раза увеличено количество активированных CD3+HLA-DR+ Т-лимфоцитов. Наблюдается значимое снижение содержания CD3-CD16+CD56+ -NK-клеток и CD19+ В-лимфоцитов. Значимых различий в содержании СD4+CD25highCD127low/- клеток (Т-регуляторные) не выявлено. Увеличена доля лимфоцитов, несущих Fas-антиген (CD95) – маркер готовности клетки к апоптозу. При определении уровня иммуноглобулинов G, М и А классов в сыворотке периферической крови не обнаружено значимой разницы в их концентрации у женщин основной группы по сравнению с контролем (9,2±3,1 г/л против 11,4±2,77 г/л, 1,7±1,1 г/л против 1,9±0,26 г/л и 1,7±0,8 против 1,8±0,8 г/л соответственно, p>0,05).
В группе детей, матери которых получали во время беременности иммуносупрессивную терапию, необходимую для предотвращения отторжения трансплантированного органа, не отмечалось существенной депрессии ростков кроветворения и выраженных гематологических нарушений. Содержание общего количества лейкоцитов, а также соотношение лимфоцитов, нейтрофилов и моноцитов, в пуповинной крови новорожденных основной группы не отличались от содержания в контрольной группе.
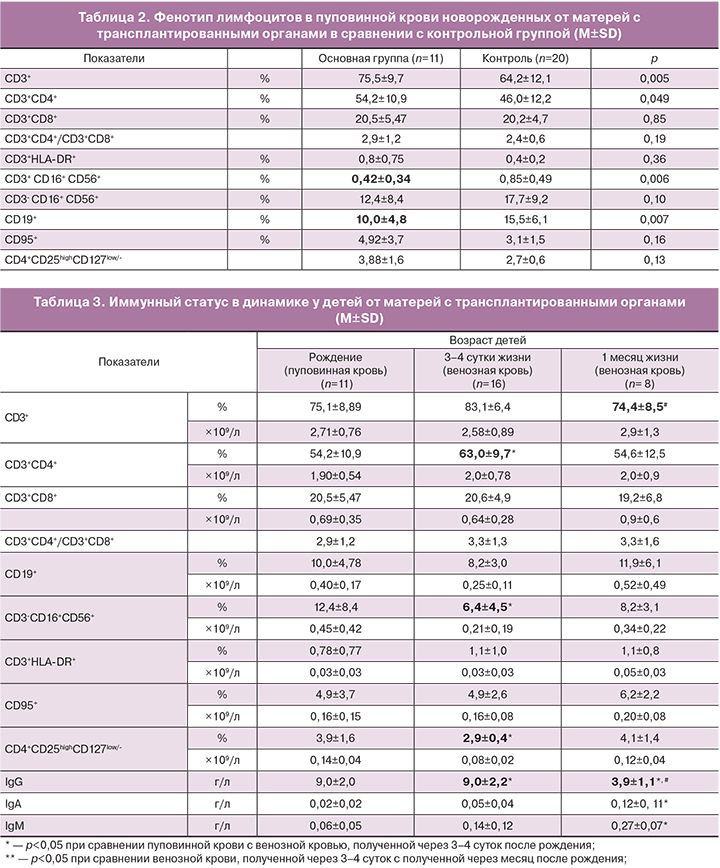
При сравнении субпопуляционного состава пуповинной крови новорожденных в основной и контрольной группах не выявлено изменений в соотношении Т-лимфоцитов, аналогичных наблюдаемым у их матерей (Таблица 2). Имеет место увеличение процента CD3+ Т-лимфоцитов (75,5±9,7% против 64,2±12,1%, p<0,05) за счет увеличения относительного количества CD3+CD4+ Т-клеток (54,2±10,9% против 46,0±12,2%, p<0,05). Однако изменения соотношения CD3+CD4+ и CD3+CD8+ субпопуляций Т-клеток, при сравнении с таковым в контрольной группе, не наблюдается (2,9±1,2% против 2,4±0,6%, p>0,05). Выявлено снижение относительного количества В-лимфоцитов у новорожденных от матерей с трансплантированным органом, получавших иммуносупрессивную терапию во время беременности, (10,0±4,8% против 15,5±6,1%, p<0,05) и CD3+CD16+CD56+ — ТNK- клеток (0,42±0,34% против 0,85±0,49%, p<0,01). Изменений в содержании клеток других субпопуляций лимфоцитов при сравнении с контрольной группой новорожденных не установлено. Таким образом, у детей, внутриутробное развитие которых происходит на фоне иммуносупрессивной терапии матери, наблюдаются менее выраженные различия с показателями контрольной группы, чем у их матерей.
Обращает на себя внимание тот факт, что существенные различия в соотношениях лимфоцитов разных фенотипов обнаруживаются между показателями периферической крови матерей и пуповинной крови детей. Соотношение CD4+ и CD8+ Т-лимфоцитов у новорожденных в обеих группах было значимо выше, чем у их матерей. Доля активированных Т-лимфоцитов (CD3+HLA-DR+) и доля лимфоцитов, несущих Fas-антиген (CD95) – маркер готовности клетки к апоптозу, в обеих группах новорожденных была значительно ниже, по сравнению с таковой у их матерей.
В таблице 3 представлены данные, характеризующие иммунный статус в периоде новорожденности у детей от матерей с трансплантированными органами в динамике.
Сравнительный анализ процентного и абсолютного содержания клеток разных субпопуляций лимфоцитов не выявил значимых различий между пуповинной кровью и венозной кровью ребенка, полученной в раннем неонатальном периоде (через 3–4 суток после рождения), за исключением снижения CD3-CD16+CD56+-NK-клеток. Существенных изменений в субпопуляционном составе лимфоцитов в периферической крови ребенка через месяц не установлено. Однако наблюдается значимое снижение концентрации IgG (9,0±2,2 г/л и 3,9±1,1 г/л, p=0,0004) и увеличение содержания IgМ и IgА.
Обсуждение
В настоящее время в литературе мало данных, касающихся состояния здоровья детей, внутриутробно подвергавшихся воздействию иммуносупрессивных препаратов. Согласно Управлению по контролю качества продуктов и лекарств США (Food and Drug Administration, FDA), все иммуносупрессивные препараты, которые получают пациенты после трансплантации, относятся к категории безопасности ниже В, то есть при исследовании у животных данные препараты показали отрицательное воздействие на плод. В настоящее время нет адекватных и контролируемых исследований у человека данных препаратов и, учитывая необходимость их применения при трансплантации, они могут использоваться у беременных женщин, несмотря на возможные риски [11]. Также необходима согласованная работа акушера и трансплантолога для поддержания оптимального уровня иммуносупрессии, при котором создается баланс между предотвращением отторжения трансплантата и препятствием возникновению неблагоприятных побочных эффектов иммуносупрессии.
По результатам пятилетних наблюдений McKay D.B., Adams P.L, почти у 26% детей, рожденных от матерей с пересаженной почкой, выявлялись значительные кардиальные нарушения [12]. В нашем исследовании не отмечено серьезных нарушений со стороны сердечно-сосудистой системы у новорожденных, рожденных у матерей с трансплантированной почкой.
При исследовании иммунного статуса новорожденных основной и контрольных групп не обнаружены существенные различия в количестве лейкоцитов, уровне гранулоцитов и лимфоцитов между группами новорожденных, что согласуется с данными других авторов [6]. Однако, по данным Ono и соавт., у детей от матерей с трансплантированной почкой при рождении определялось меньше тромбоцитов, лейкоцитов, нейтрофилов и эозинофилов, чем у детей из контрольной группы [13].
Наши данные также согласуются с результатами исследований, в которых показано, что при рождении детей у матерей с трансплантированным органом наблюдается значимое снижение количества В-клеток [13]. Ранее предполагалось, что иммунные изменения, наблюдающиеся у новорожденных от матерей с трансплантированными органами, могут препятствовать нормальному ответу детей на вакцинирование. Рассматривалась возможность отсрочки вакцинации до 6-ти месячного возраста для того, чтобы избежать нежелательных иммунологических реакций в неблагоприятных условиях на живые вакцины [14, 15]. Опубликованы данные, подтверждающие, что младенцы, рожденные у этих матерей могут иметь адекватный серологический ответ на вакцину без более высокого процента неблагоприятных результатов [16]. При этом высказывается мнение, что дети от матерей с трансплантатом должны быть иммунизированы против болезней, предотвращаемых с помощью вакцин, как можно скорее, поскольку они бывают в постоянном контакте с матерями, находящимися в иммунодефицитном состоянии и имеющими повышенный риск инфекционных заболеваний.
Заключение
Течение беременности у женщин с трансплантированными почкой или печенью, протекавшей на фоне иммуносупрессивной терапии, наиболее часто осложнялось угрозой прерывания, анемией легкой и средней степени тяжести, артериальной гипертензией. Для женщин этой группы характерны признаки дисбаланса в клеточном звене иммунитета, которые проявлялись снижением содержания Т-лимфоцитов, иммунорегуляторного индекса (соотношения CD3+CD4+ и CD3+CD8+ субпопуляций Т-лимфоцитов), количества В-лимфоцитов и естественных киллерных клеток, увеличением содержания активированных Т-лимфоцитов и лимфоцитов, готовых к апоптозу.
Дети, рожденные женщинами с трансплантированным органом, чаще имеют более низкие массо-ростовые показатели, более низкий гестационный возраст и повышенную частоту осложнений раннего неонатального периода. В пуповинной крови новорожденных от матерей, получавших иммуносупрессивную терапию во время беременности, выявлено существенное снижение содержания В-лимфоцитов при отсутствии снижения иммунорегуляторного индекса, несмотря на значимое увеличение процента CD3+CD4+-Т-лимфоцитов.
Исследование иммунного статуса у этих детей в периоде новорожденности в динамике значимых изменений в субпопуляционном составе лимфоцитов, по сравнению с содержанием в пуповинной крови, не выявило. Отмечено высокозначимое снижение концентрации IgG и увеличение уровней IgМ и IgА к концу периода новорожденности, что может свидетельствовать о естественном снижении содержания материнских IgG и об увеличении продукции собственных IgМ и IgА.
Для успешного исхода беременности, протекающей на фоне иммуносупрессивной терапии, у женщин с трансплантированными органами, а также нормального становления и развития клеточных основ адаптивного иммунитета у плода требуется дальнейшее совершенствование лечения, имеющего междисциплинарный характер, при тщательном подборе препаратов и их дозировки.



