Основной целью программ вспомогательных репродуктивных технологий (ВРТ) является наступление одноплодной беременности при переносе минимального числа эмбрионов в полость матки. Морфологическая оценка эмбрионов в процессе культивирования, а также селекция эмбрионов для переноса в полость матки являются ключевыми моментами в клинической практике лаборатории ВРТ. Известно, что потенциал эмбриона к имплантации и дальнейшему развитию определяется исходным качеством гамет, при этом основную роль играет именно качество ооцита [1]. Несмотря на это, в повседневной клинической практике эмбриологов оценка качества ооцитов, полученных при трансвагинальной пункции фолликулов, проводится достаточно поверхностно. При этом потенциал развития эмбрионов определяется исключительно по морфологии самого эмбриона, без связи с качеством ооцита, из которого данный эмбрион был получен.
Значительная часть ооцитов (до 70%), полученных в циклах стимуляции суперовуляции, имеют аномалии строения (дисморфизмы). Дисморфизмы ооцитов делятся на две группы: цитоплазматические и экстрацитоплазматические. К цитоплазматическим относятся повышение гранулярности цитоплазмы, наличие в цитоплазме вакуолей, появление аномальных агрегатов гладкого эндоплазматического ретикулума (ГЭР), а также наличие разнообразных цитоплазматических включений. Ооциты, имеющие цитоплазматические дисморфизмы, имеют более низкую частоту оплодотворения, а эмбрионы, полученные из таких клеток, имеют низкий потенциал к имплантации и дальнейшему развитию [2–4]. К экстрацитоплазматическим аномалиям относят изменение ширины перивителлинового пространства, наличие дебриса в перивителлиновом пространстве, а также аномалии строения первого полярного тельца и изменение толщины и формы зоны пеллюцида. Отрицательное влияние данных дисморфизмов на частоту оплодотворения клетки и развитие эмбриона не доказано, а в литературе имеются различные мнения по данному вопросу [5–7].
Цель исследования: оценить влияние различных дисморфизмов ооцитов на исходы программ ЭКО/ИКСИ.
Материал и методы исследования
В проспективное когортное исследование были включены 343 супружеские пары с бесплодием различного генеза, нормальным кариотипом, отсутствием противопоказаний к проведению ВРТ и подписанным информированным согласием на участие в исследовании. Все пациентки были разделены на 3 группы: группа № 1 (n=139) – женщины с цитоплазматическими дисморфизмами ооцитов, группа № 2 (n=97) – женщины с экстрацитоплазматическими дисморфизмами ооцитов, группа № 3 (n=107) – пациентки с морфологически нормальными ооцитами. Критерием отнесения пациенток в группу с дисморфизмами было наличие 100% ооцитов с патологией цитоплазмы или экстрацитоплазматическими нарушениями, в группу без дисморфизмов – наличие 100% нормальных ооцитов. Критериями исключения было наличие тяжелой формы патозооспермии у мужчины (концентрация сперматозоидов менее 100 000/мл, наличие менее 4% морфологически нормальных сперматозоидов по строгим критериям Крюгера, а также наличие азооспермии). Также критериями исключения служили развитие синдрома гиперстимуляции яичников средней или тяжелой степени в данном цикле ЭКО, а также другие причины и осложнения, требующие отмены переноса эмбрионов (ПЭ) в изучаемом цикле. Перед включением в протокол ЭКО все женщины были обследованы согласно Приказу Минздрава России от 30.08.12 №107н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и показаниях к их применению» [8].
Стимуляция функции яичников проводилась с применением рекомбинантного ФСГ или комбинированного препарата рекомбинантного ФСГ и ЛГ, и назначением как агонистов (аг-ГнРГ), так и антагонистов гонадотропин-рилизинг-гормона (ант-ГнРГ). Распределение различных протоколов стимуляции овуляции было следующим: короткий протокол с ант-ГнРГ был назначен 285 пациенткам (83,1%), короткий модифицированный протокол с ант-ГнРГ – 23 пациенткам (6,7%), длинный протокол с аг-ГнРГ – 13 пациенткам (3,8%), короткий протокол с аг-ГнРГ – 7 пациенткам (4,4%). ЭКО в естественном цикле было проведено 15 пациенткам (4,4%). Триггер овуляции вводился при наличии лидирующих фолликулов в яичниках диаметром 17 мм и более. В качестве триггера использовались человеческий хорионический гонадотропин (ХГ) в дозе 7500–10 000 МЕ, а при риске развития синдрома гиперстимуляции яичников в коротком протоколе с ант-ГнРГ – агГнРГ (декапептил) в дозе 0,2 мг, или сочетание аг-ГнРГ с ХГ в дозе 1500 МЕ. Всего препараты ХГ были назначены 295 пациенткам, препараты аг-ГнРГ – 34 пациенткам, а их сочетание – 14 пациенткам. Трансвагинальная пункция яичников (ТВП) осуществлялась через 36 часов после введения триггера. Поддержка лютеиновой фазы индуцированного цикла у всех пациенток проводилась по стандартному протоколу с назначением натурального микронизированного прогестерона интравагинально в дозе 600 мг в сутки после ТВП. Если в качестве триггера овуляции был использован агГнРГ, или сочетание агГнРГ с ХГ в дозе 1500 МЕ, для поддержки лютеиновой фазы назначали эстрадиола валерат в дозе 6 мг в сутки.
Очищение ооцитов от клеток кумулюса осуществляли как энзимным, так и механическим путем; зрелые клетки на стадии МІІ культивировали отдельно от незрелых. Морфологическая оценка ооцитов проводилась эмбриологом во время проведения процедуры ИКСИ, после оплодотворения ооциты культивировались в отдельных каплях. Оценка оплодотворения проводилась через 16–18 часов после проведения ИКСИ. Нормальное оплодотворение регистрировали при наличии двух пронуклеусов, равных по размеру, в цитоплазме ооцита. Морфологическую оценку качества развивающихся эмбрионов проводили на 3-и сутки культивирования; в качестве критериев оценки использовали скорость дробления, симметрию бластомеров, а также наличие фрагментации в отдельных бластомерах. ПЭ в полость матки осуществляли на 3-и или 5-е сутки культивирования. При наличии подъема уровня сывороточного ХГ через 14 дней после ПЭ в полость матки регистрировали биохимическую беременность, а при визуализации плодного яйца в полости матки через 21 день после ПЭ – клиническую беременность.
Для статистического анализа использовался пакет статистических программ Statistica 10 (США). Расчет объема выборки был основан на данных литературы о частоте наступления беременности в программах ВРТ у пациенток с дисморфизмами ооцитов [9].
Первичной конечной точкой было скорректированное отношение шансов (ОШкор) наступления клинической беременности в изучаемых группах. Вторичными конечными точками были средние и частотные значения различных параметров раннего эмбрионального развития в изучаемых группах. Статистический анализ проводился с применением χ2-теста для оценки частотных показателей, теста Манна–Уитни и Крускала–Уоллиса для сравнения непрерывных величин, а также многофакторного регрессионного анализа (логистической регрессии) для расчета ОШкор. Корреляционный анализ проводился с использованием непараметрического корреляционного критерия Спирмена. Различия между статистическими величинами считали статистически значимыми при уровне достоверности р<0,05.
Исследование было одобрено этическим комитетом ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России.
Результаты
При оценке клинико-анамнестических особенностей пациенток различных групп было выявлено, что пациентки с дисморфизмами ооцитов были более старшего возраста (35,2±5,7 года и 33,8±4,4 года для групп № 1 и № 2 соответственно) по сравнению с пациентками группы № 3 (31,8±4,6 года) (p<0,0001). Социально-экономические характеристики (уровень образования, семейное положение, наличие или отсутствие работы) не различались в группах сравнения. Индекс массы тела (ИМТ) был выше у женщин с наличием цитоплазматических дисморфизмов и составил в группе № 1 – 23,6±4,5, в группе № 2 – 22,9±3,9, в группе № 3 – 21,9±3,4 (р=0,016). Женщины трех групп не отличались по характеру менструальной функции, гинекологической и соматической заболеваемости и наличию вредных привычек. Причина бесплодия, а также количество циклов ЭКО/ИКСИ в анамнезе существенно не различались в 3 группах.
При оценке уровней гормонов, измеренных однократно на 3-й день менструального цикла у каждой пациентки, было отмечено, что уровень антимюллерового гормона (АМГ) и свободного тироксина (Т4) в крови пациенток с морфологически нормальными ооцитами был значимо выше по сравнению с группами № 1 и № 2. Другие лабораторные показатели не отличались в группах сравнения.
При оценке влияния на развитие дисморфизмов ооцитов ятрогенных факторов было выявлено, что частота назначения различных протоколов стимуляции суперовуляции не отличалась статистически значимо в группах сравнения, однако доля протоколов с агонистами была выше в группе №2 по сравнению с группами № 1 и № 3 (9,3% по сравнению с 5,1 и 3,8%). Длительность стимуляции суперовуляции существенно не различалась в группах, как и частота использования различных препаратов гонадотропинов. В группах пациенток с дисморфизмами ооцитов была выявлена незначительно более высокая суммарная доза назначаемых препаратов гонадотропинов по сравнению с группой № 3. Что касается триггера овуляции, то у пациенток с экстрацитоплазматическими дисморфизмами ооцитов отмечалось более частое применение аг-ГнРГ в качестве триггера овуляции по сравнению с группами № 1 и № 3 (14,4% по сравнению с 8,6 и 7,5%) (р=0,0985) (таблица). Все вышеописанные различия учитывались в дальнейшем статистическом анализе как возможные конфаундеры.
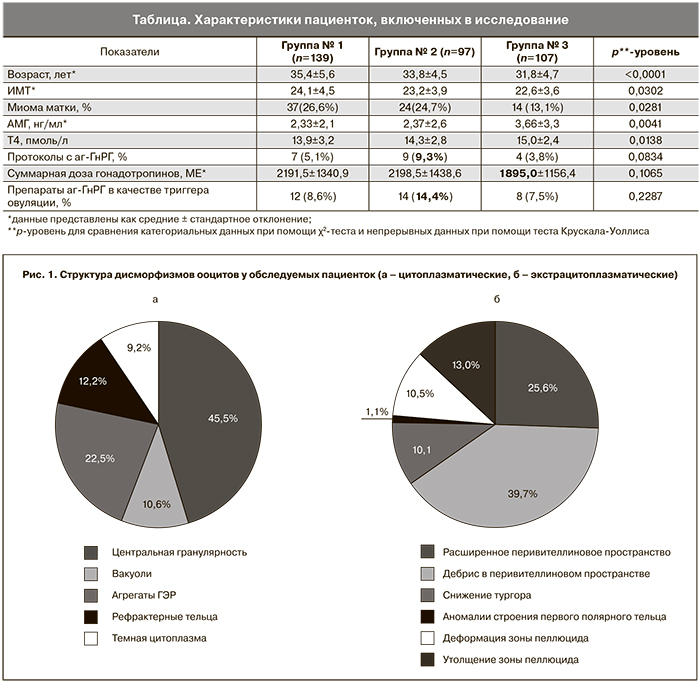
Всего в циклах стимуляции было получено 2134 ооцитов, из которых 1793 (84%) находились на стадии МII. У пациенток группы № 1 всего было получено 688 ооцитов (38,4%), у пациенток группы № 2 – 476 ооцитов (26,5%), у пациенток группы № 3 – 629 ооцитов (35,1%). Структура цитоплазматических и экстрацитоплазматических дисморфизмов представлена на рис. 1а и 1б.
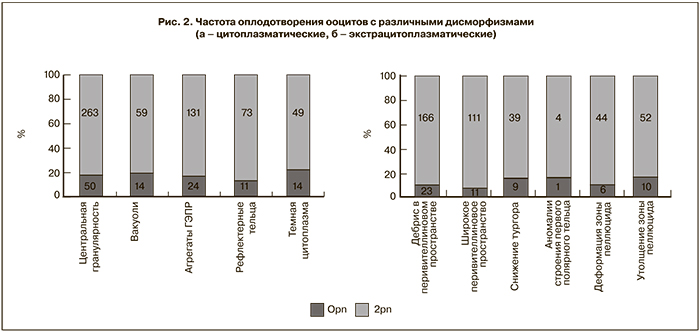
Частота оплодотворения ооцитов существенно различалась между группами и была минимальной при наличии цитоплазматических дисморфизмов. Так, в группе № 1 частота оплодотворения составила 83,6%, в группе № 2 – 87,4%, в группе № 3 – 88,4% (р=0,0284). Среди ооцитов с цитоплазматическими дисморфизмами наименьшую частоту оплодотворения имели ооциты с темной цитоплазмой (77,8%), а наибольшую частоту – ооциты с рефрактерными тельцами в цитоплазме (86,9%). Среди ооцитов с экстрацитоплазматическими дисморфизмами наименьшую частоту оплодотворения имели ооциты со снижением тургора цитоплазмы (81,25%) и аномалиями строения первого полярного тельца (80%), а наибольшую частоту – ооциты с широким перивителлиновым пространством (90,9%) (рис. 2а и 2б).
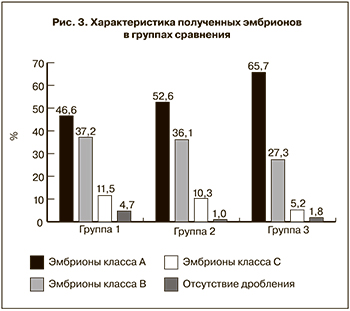
При оценке морфологических характеристик эмбрионов, полученных из ооцитов с различными морфотипами, были выявлены существенные различия между группами. Для каждой группы производилась оценка доли эмбрионов разных классов (А, В и С) на 3-и сутки культивирования, а также доли эмбрионов, остановившихся в развитии на раннем этапе культивирования.
Эмбрионов класса А было получено 268 (46,6%) в группе № 1, 219 (52,6%) в группе № 2 и 365 (65,7%) в группе № 3 (р<0,0001). Соответственно по группам было получено 214 (37,2%), 150 (36,1%) и 152 (27,3%) эмбрионов класса В (р=0,0008); 66 (11,5%), 43 (10,3%) и 29 (5,2%) эмбрионов класса С (р=0,0005). Остановка развития произошла у 27 (4,7%), 4 (1%) и 10 (1,8%) по группам соответственно (р=0,0004). Таким образом, наибольшее число «качественных» эмбрионов было получено у женщин без дисморфизмов ооцитов, а максимальное число эмбрионов класса С и остановившихся в развитии – у пациенток с цитоплазматическими дисморфизмами. Полученные данные представлены на рис. 3.
В группе № 3 не было ни одного цикла с отменой ПЭ по причине отсутствия эмбрионов, пригодных для переноса в полость матки. При этом частота циклов c отменой ПЭ в группе № 1 составила 5,8%, в группе № 2 – 7,2% (р<0,05).
 Частота наступления клинической и биохимической беременности также существенно различалась между группами. Частота имплантации в группе № 1 составила 27,3% (n=38), в группе № 2 – 39,2% (n=38), а в группе контроля – 57,0% (n=61) (р<0,001). Клиническая беременность наступила у 34 женщин группы № 1 (24,6%), у 38 женщин в группе № 2 (39,2%) и у 60 женщин в группе контроля (56,1%) (р<0,001).
Частота наступления клинической и биохимической беременности также существенно различалась между группами. Частота имплантации в группе № 1 составила 27,3% (n=38), в группе № 2 – 39,2% (n=38), а в группе контроля – 57,0% (n=61) (р<0,001). Клиническая беременность наступила у 34 женщин группы № 1 (24,6%), у 38 женщин в группе № 2 (39,2%) и у 60 женщин в группе контроля (56,1%) (р<0,001).
На наступление беременности помимо наличия дисморфизмов ооцитов влияли возраст пациентки, количество программ ЭКО в анамнезе, а также тип выбранного протокола, препарат для стимуляции функции яичников и число полученных зрелых ооцитов. Мы провели многофакторный анализ ОШ наступления клинической беременности в зависимости от влияния клинико-анамнестических особенностей пациенток, особенностей протокола стимуляции, а также наличия или отсутствия дисморфизмов ооцитов. В модель были включены факторы, выделенные в ходе однофакторного анализа.
Грубое ОШ (ОШгр) наступления беременности между группами составило 1,46 (95% ДИ 1,09; 1,95). При этом ОШкор наступления беременности с учетом возраста, числа зрелых ооцитов и выбора препарата для стимуляции функции яичников составило 1,37 (95% ДИ 1,02; 1,85).
ОШгр наступления беременности у женщин с цитоплазматическими дисморфизмами по сравнению с группой контроля составило 3,9 (95% ДИ 2,27; 6,73), а ОШкор с учетом числа зрелых ооцитов – 3,69 (95% ДИ 2,12; 6,14).
ОШгр наступления беременности у женщин с экстрацитоплазматическими дисморфизмами по сравнению с группой контроля составило 1,4 (95% ДИ 1,06; 1,86), а ОШкор с учетом выбора препарата для стимуляции функции яичников – 1,42 (95% ДИ 1,07; 1,89).
Обсуждение
Морфологическая и структурная зрелость гамет определяет дальнейшую судьбу эмбриона, а значит, и вероятность наступления беременности и рождения здорового ребенка. В клинической практике лаборатории ЭКО морфологической оценке ооцитов уделяется значительно меньшее внимание, чем выбору сперматозоида для проведения процедуры ИКСИ или селекции эмбриона для переноса в полость матки. Значительная часть ооцитов, полученных при аспирации фолликулярной жидкости, имеет различные аномалии строения. Но даже при наличии грубых морфологических изменений все зрелые клетки подвергаются оплодотворению методом ИКСИ.
Большинство циклов ЭКО в настоящее время проводится с применением контролируемой стимуляции овуляции, которая подавляет естественную селекцию и способствует созреванию ооцитов, которые физиологически должны были подвергнуться апоптозу.
Данные литературы о негативном влиянии дисморфизмов ооцитов на дальнейшее развитие эмбрионов являются противоречивыми, в связи с чем основной целью нашего исследования была оценка влияния различных аномалий строения ооцитов на эмбриологические и клинические исходы программ ВРТ. Цитоплазматические и экстрацитоплазматические дисморфизмы принято рассматривать как отдельные формы патологии, в связи с чем пациентки были разделены на 3 группы в зависимости от наличия или отсутствия дисморфизмов, а также от типа аномалий строения ооцитов. Чтобы минимизировать влияние мужского фактора на частоту оплодотворения, качество эмбрионов и частоту наступления беременности, нами были отобраны супружеские пары с фертильной или субфертильной спермой у супруга.
По данным нашего исследования, ооциты с цитоплазматическими дисморфизмами (наличие центральной гранулярности цитоплазмы, повышение вакуолизации, скопление аномальных агрегатов ГЭР, рефрактерные тельца, темная цитоплазма) имеют значительно более низкую частоту оплодотворения и худшее качество полученных эмбрионов. Также в данной группе было больше всего эмбрионов, остановившихся в развитии на ранних этапах культивирования. Полученные данные согласуются с результатами других исследований, согласно которым наличие различных цитоплазматических дисморфизмов отрицательно коррелирует с частотой оплодотворения и качеством полученных эмбрионов [5, 10, 11].
Цитоплазматические дисморфизмы ооцитов являются косвенными признаками цитоплазматической незрелости клетки, то есть асинхронизации созревания ядра и подготовки органелл клетки к оплодотворению. Низкая частота оплодотворения ооцитов с цитоплазматическими аномалиями может быть связана как с механическим смещением веретена деления и нарушением архитектоники цитоскелета, так и со структурными нарушениями органелл, приводящими к метаболическим нарушениям в клетке. Развивающемуся эмбриону необходимы накопленные в течение оогенеза продукты – мРНК, протеины, питательные вещества, которые аккумулируются в ооците [12]. Именно поэтому ооцит играет решающую роль в формировании способного к дальнейшему развитию эмбриона. Вероятно, ооциты с цитоплазматическими дисморфизмами имеют нарушенный потенциал к формированию полноценного эмбриона за счет метаболических нарушений на молекулярном уровне, которые невозможно диагностировать с помощью световой микроскопии.
Частота наступления беременности у женщин с цитоплазматическими дисморфизмами в нашем исследовании была значительно ниже, чем в контрольной группе. Согласно полученным данным, ОШкор наступления беременности у женщин с цитоплазматическими дисморфизмами с учетом числа зрелых ооцитов составило 3,69 (95% ДИ 2,12; 6,14). Похожие результаты были получены в исследованиях Otsuki и соавт. (2004), Ubaldi и соавт. (2008). Частота наступления беременности при переносе в полость матки эмбрионов, полученных при оплодотворении ооцитов с дисморфизмами, была значительно ниже, чем в контрольной группе [2, 11]. Существует гипотеза, что ооциты с различными дисморфизмами имеют большую частоту хромосомных нарушений, что в свою очередь приводит к появлению анеуплоидных эмбрионов и низкой частоте наступления беременности у пациенток с дисморфизмами [13, 14]. Тем не менее, данная проблема изучена недостаточно, требуется проведение дальнейших исследований в этом направлении.
Ооциты с экстрацитоплазматическими дисморфизмами (расширение перивителлинового пространства и появление в нем дебриса, снижение тургора ооцита, аномалии строения первого полярного тельца, деформация или утолщение зоны пеллюцида) имели практически одинаковую частоту оплодотворения (87,4%) по сравнению с нормальными ооцитами (88,4%). Тем не менее, в данной группе по сравнению с контрольной был ниже процент эмбрионов класса А (52,6 и 65,7%, соответственно) и выше процент эмбрионов класса С (11,5 и 5,2%, соответственно). Относительно влияния экстрацитоплазматических дисморфизмов на частоту оплодотворения и качество эмбрионов в литературе нет единого мнения. Наши данные не согласуются с исследованиями Lasiene и соавт. (2009) и Ubaldi и соавт. (2008), в которых частота оплодотворения ооцитов с экстрацитоплазматическими дисморфизмами была значительно ниже, чем в группе контроля [2, 15]. В исследовании Chamayou и соавт. (2006) при оплодотворении ооцитов с экстрацитоплазматическими дисморфизмами были получены эмбрионы более низкого качества, чем в контрольной группе. При этом частота наступления беременности в обеих группа существенно не различалась [16].
Большинство исследователей придерживаются мнения, что экстрацитоплазматические аномалии строения являются только фенотипическими особенностями клеток, не нарушая их потенциал к оплодотворению и дальнейшему развитию [17]. В нашем исследовании частота наступления беременности у пациенток с экстрацитоплазматическими дисморфизмами была значительно выше, чем у пациенток с цитоплазматическими дисморфизмами (39,2 и 24,6% соответственно), но ниже, чем в контрольной группе (56,1%). Нами не было найдено данных о связи экстрацитоплазматических аномалий ооцитов с хромосомными нарушениями. Тем не менее данный вопрос представляет большой научный интерес.
Заключение
Качество ооцитов играет важную роль в фертилизации, получении качественных эмбрионов и, как следствие, эффективности программ ВРТ. В клинической практике изучение патологии ооцитов является важной задачей, решение которой необходимо для разработки неинвазивной селекции гамет и эмбрионов. Необходимо проведение дальнейших исследований в области изучения хромосомных аномалий и молекулярных нарушений в ооцитах, а также их корреляции с морфологией ооцитов.



