Известно, что ооциты, полученные в программах экстракорпорального оплодотворения (ЭКО), имеют разный потенциал оплодотворения, а эмбрионы по-разному развиваются в период дробления. Так, только 5% ооцитов дают эмбрионы, перенос которых заканчивается живорождением [1]. Связь между качеством ооцитов и эмбрионов была подтверждена в нескольких исследованиях, которые показали, что ранние неудачи развития эмбрионов обусловлены преимущественно материнскими факторами [2–5]. Ряд дефектов созревания эмбрионов формируется еще до оплодотворения в соответствующем ооците и во многом зависит от внутриклеточных механизмов эпигенетических модификаций генома [6–8]. Приобретение компетентности ооцита – это все еще плохо изученный процесс, который формируется на протяжении всего оогенеза [9]. Привлекает внимание изучение механизмов остановки эмбрионов в развитии, т.е. ситуации, когда не формируется эмбрион, пригодный для переноса. В зависимости от стадии, на которой отмечается остановка эмбриона, можно наблюдать неспособность зиготы начать процесс дробления, остановку самого дробления на 2-й или 3-й день, т.е. на стадии от двух- до восьмиклеточного эмбриона, неспособность сформировать морулу и впоследствии бластоцисту. Представленные публикации анализируют возможные причины остановки развития эмбриона на разных стадиях дробления [10–12].
В ряде исследований обобщены данные о молекулярных факторах остановки развития эмбрионов на различных стадиях. Было показано, что остановка развития эмбриона – это многофакторное явление, зависящее от внутренних и внешних параметров. При исследовании причинно-следственных связей, определяющих остановку развития эмбрионов, оказалось, что ее причинами являются материнские и/или отцовские факторы, активность эмбрионального метаболизма, нарушение важнейших молекулярных путей, останавливающих процесс развития, генетические аномалии или лабораторные условия [13–15]. Выявленные эмбриональные факторы, связанные с арестом, включали вариации генов, число копий митохондриальной ДНК, характер метилирования, хромосомные аномалии, метаболический профиль и морфологические особенности, а родительские факторы включали вариации генов, уровни экспрессии белков и этиологию бесплодия [16–18]. Несмотря на обширный анализ данных литературы, проведенный авторами, не удалось установить какие-либо конкретные причины остановки развития эмбриона. Все перечисленные факторы потенциально могут участвовать в этом процессе, но каким образом, пока неясно, учитывая разнообразие и гетерогенность причин «ареста» раннего эмбриогенеза, а также их неизбежные взаимосвязи [19].
Тем не менее для клинической практики важно на этапе обследования пациенток иметь критерии, позволяющие с той или иной степенью достоверности прогнозировать этап эмбрионального развития.
В этой связи целью исследования явилось: оценить клинико-гормональные параметры и результаты программ ЭКО у пациенток, имеющих нарушения дробления эмбрионов, в сравнении с женщинами, имеющими эмбрионы, пригодные для переноса.
Материалы и методы
Было проведено обсервационное клиническое исследование случай-контроль, включающее 770 пациенток, проходящих лечение бесплодия методом ЭКО.
Для достижения цели исследования все пациентки, соответствующие критериям включения и невключения, были разделены на 2 группы: 1-ю группу (основную) составили 287 пациенток, у которых при проведении программ ЭКО эмбрионы остановились в развитии на разных стадиях дробления; во 2-ю группу (контрольную) вошли 483 пациентки с наличием бластоцисты, пригодной для переноса на 5-е или 6-е сутки культивирования.
Было проанализировано 770 циклов ЭКО, проведенных на базе отделения НКО ВРТ им. Ф. Паулсена ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России в 2022 г. у пациенток исследуемых групп.
Дополнительно были выделены репрезентативные группы пациенток – 1а и 2а, которые были сопоставимы по возрасту, состоянию овариального резерва, количеству полученных ооцитов и зигот. В каждую группу вошли по 37 пациенток. В группе 1а все эмбрионы остановились в развитии, у пациенток группы 2а получены эмбрионы, пригодные для переноса.
Критериями включения в исследуемые группы послужили: отсутствие наступления беременности в течение 1 года и более, нормальный кариотип обоих супругов, наличие показаний для достижения беременности методом ЭКО.
Критериями невключения в исследуемые группы послужили: использование донорских гамет в изучаемом цикле вспомогательных репродуктивных технологий (ВРТ), программы переноса криоконсервированных эмбрионов, все состояния, являющиеся противопоказаниями к проведению ВРТ и достижению беременности, в соответствии с приказом Минздрава России от 31 июля 2020 г. № 803н.
Всем супружеским парам было проведено полное клинико-лабораторное обследование в соответствии с приказом № 803н Минздрава России от 31 июля 2020 г.
Стимуляцию функции яичников проводили гонадотропинами (рекомбинантный фолликулостимулирующий гормон (ФСГ) и/или человеческий менопаузальный гонадотропин) по стандартным протоколам с антагонистами гонадотропин-рилизинг-гормона или с агонистами гонадотропин-рилизинг-гормона. В качестве триггера овуляции использовали мочевую или рекомбинантную формы хорионического гонадотропина человека. Ультразвуковой мониторинг осуществляли 3–5 раз в течение овариальной стимуляции. Трансвагинальную пункцию фолликулов осуществляли спустя 36–37 ч после введения триггера овуляции. Оплодотворение аспирированных ооцитов проводили методами ЭКО или интрацитоплазматической инъекции сперматозоида (ИКСИ). Все эмбрионы культивировали в индивидуальных каплях одношаговой культуральной среды (G-TL, Vitrolife) в мультигазовых инкубаторах. Оценку качества полученных эмбрионов проводили на 2, 3, 4, 5 и 6-е сутки культивирования на основании морфологических критериев в соответствии с классификацией Гарднера (ESHRE 2011 «модифицированная» классификация D.Gardner) [20].
Исследование было одобрено комитетом по этике ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Статистический анализ
Для статистической обработки данных использовали программное обеспечение для статистического анализа данных и построения графиков GraphPad Prism v6 (GraphPad Software Inc, USA). Для построения логистической регрессии использовали язык статистического программирования R. Для качественных данных указаны абсолютные значения и процент (абс. (%)), использован точный тест Фишера. Для определения типа распределения количественных данных использован критерий Шапиро–Уилка. Для непараметрических количественных данных указаны медианы и интерквартильный размах (Ме (Q1; Q3)), использован тест Манна–Уитни. С целью оценки качества бинарной классификации выполнен ROC-анализ. При проведении ROC-анализа рассчитывали порог отсечки, площадь под ROC-кривой (AUC), чувствительность и специфичность. С целью определения связи между зависимой переменной и одной или несколькими независимыми переменными выполнен регрессионный анализ. Для построения логистической регрессии использовали язык статистического программирования R. Проверку на мультиколлинеарность выполняли методом корреляционного анализа – тест Спирмена. Различия считали статистически значимыми при p<0,05.
Результаты
Группу 1 (исследования) составили 287 женщин в среднем возрасте 38 (34; 41) лет, у которых в программе ЭКО было получено 3 и более (3; 6) зрелых ооцитов и 3 и более (3; 4) зиготы, но все эмбрионы остановились в развитии.
Группу 2 (контроль) составили 483 пациентки в среднем возрасте 35 (32; 39) лет, у которых в программе ЭКО было получено 8 (5; 13) зрелых ооцитов, 6 (4; 10) зигот и 3 (2; 6) бластоцисты.
При сравнении клинических характеристик пациенток исследуемых групп не было выявлено различий по частоте первичного/вторичного бесплодия, длительности бесплодия, числу попыток ВРТ в анамнезе пациенток (табл. 1).
Вместе с тем при анализе репродуктивной функции пациенток, имеющих беременность в анамнезе, было показано, что у женщин 2-й группы в 88/234 (37,6%) случаев были роды, в 107/234 (45,7%) – прерывание беременности по желанию женщины, и лишь у 39/234 (16,0%) – самопроизвольные выкидыши. Среди пациенток 1-й группы роды были лишь в 19/151 (12,5%, p<0,001) случаев, аборты по желанию пациентки – в 41/151 (27,2%, p<0,001) случае, а 90/151 (59,6%, p<0,001) пациенток имели как минимум одну неразвивающуюся беременность.
Скрупулезный анализ причин бесплодия у сравниваемых групп пациенток показал, что трубно-перитонеальный фактор бесплодия встречался у пациенток группы 2 в 256/483 (53,0%) случаях, тогда как в группе 1 – в 65/287 (22,7%); бесплодие неясного генеза диагностировано у 115/287 (40,1%) пациенток группы 1 и у 58/483 (12,0%) – в группе 2. Бесплодие, ассоциированное с эндометриозом, диагностировано у 46/287 (16,0%) пациенток группы 1 и у 43/483 (8,9%) женщин группы 2. Частота встречаемости сочетанных форм бесплодия и бесплодия, связанного с мужским фактором, не различалась в группах (табл. 2).
Таким образом, клиническими факторами, ассоциированными с нарушением развития эмбрионов, были: поздний репродуктивный возраст – в 1-й группе 38 лет (34,5; 41), во 2-й группе – 35 лет (32; 39); неразвивающиеся беременности – у 59,6% женщин 1-й группы и у 16% – во 2-й группе среди пациенток, имеющих беременность в анамнезе; бесплодие неясного генеза – 40,1 и 12% соответственно; наружный генитальный эндометриоз – у 16% женщин 1-й группы и 8,9% – во 2-й группе.
Объективным подтверждением возможного нарушения развития эмбрионов может быть анализ предыдущих попыток ЭКО, когда не было получено эмбриона пригодного для переноса. В настоящем исследовании повторные попытки ЭКО в анамнезе были практически у половины пациенток группы исследования; ни в одной из них не был получен эмбрион, пригодный для переноса.
Значительные различия были выявлены в состоянии овариального резерва исследуемых пациенток (табл. 3). Пациентки с нарушениями развития эмбрионов имели сниженные показатели овариального резерва по сравнению с контрольной группой.
Полученные данные подтвердили мнения многих специалистов о том, что поздний возраст является решающим фактором, определяющим не только количество, но и качество получаемых ооцитов [21]. Вместе с тем известно, что овариальный резерв, в частности уровень антимюллерова гормона (АМГ), является предиктором количества полученных ооцитов, но не связан с их качеством и частотой наступления беременности [22].
Мы провели анализ числа полученных ооцитов в основной и контрольной группах пациенток (табл. 4).
Все результаты представлены в расчете на одну попытку ЭКО. Как видно из таблицы, вероятность ареста эмбриогенеза всех эмбрионов была напрямую связана с количеством преовуляторных фолликулов и числом полученных ооцитов.
Частота оплодотворения (2PN) в исследуемых группах пациенток составила 68,4 и 76,3% соответственно.
Представленные данные демонстрируют зависимость между числом полученных ооцитов и остановкой развития эмбрионов. Так, в основной группе среднее количество ооцитов составило 3, тогда как в группе контроля – 10; 71,8% попыток в группе исследования характеризовались «бедным ответом» яичников, тогда как в контрольной группе таких пациентов было 24,4%. Полученные результаты согласуются с клинико-гормональными характеристиками пациенток, когда в основной группе было больше женщин старшего возраста со сниженными показателями овариального резерва.
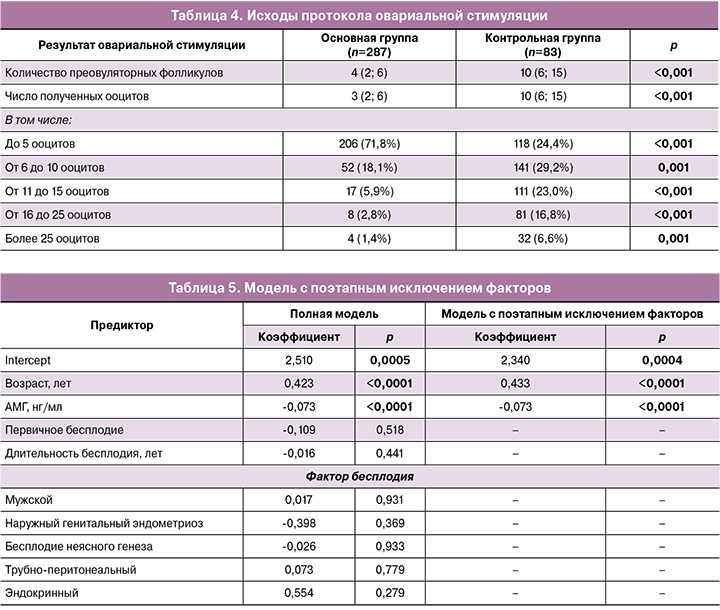
На примере контрольной группы пациенток был проведен расчет выхода бластоцист в зависимости от числа полученных зрелых ооцитов. Расчет бластуляции проводили путем деления числа полученных бластоцист на число полученных ооцитов.
Учитывая, что средний процент бластуляции на один ооцит составил 31,1%, можно рассчитать вероятность ареста эмбриогенеза при получении небольшого числа ооцитов с допущением того, что этот процесс является случайным.
Для уточнения влияния отдельных предикторов была выполнена логистическая регрессия, результаты построения зависимости параметров представлены в таблице 5. При проверке на мультиколлинеарность (методом корреляционного анализа) была выявлена только слабая отрицательная корреляция между возрастом и уровнем АМГ (r=-0,172, p=0,004). В качестве независимой переменной использовали факт остановки всех эмбрионов в развитии. В качестве зависимых переменных использовали возраст, уровень АМГ, тип бесплодия, продолжительность бесплодия, фактор бесплодия. С целью поэтапного исключения предикторов использовали функцию stepAIC пакета MASS. Уравнение регрессии соответствовало модели:
Y = exp(z)/(1+exp(z));
z = Intercept+0,433*(Возраст, лет)-0,073*(АМГ, нг/мл);
Intercept=2,340.
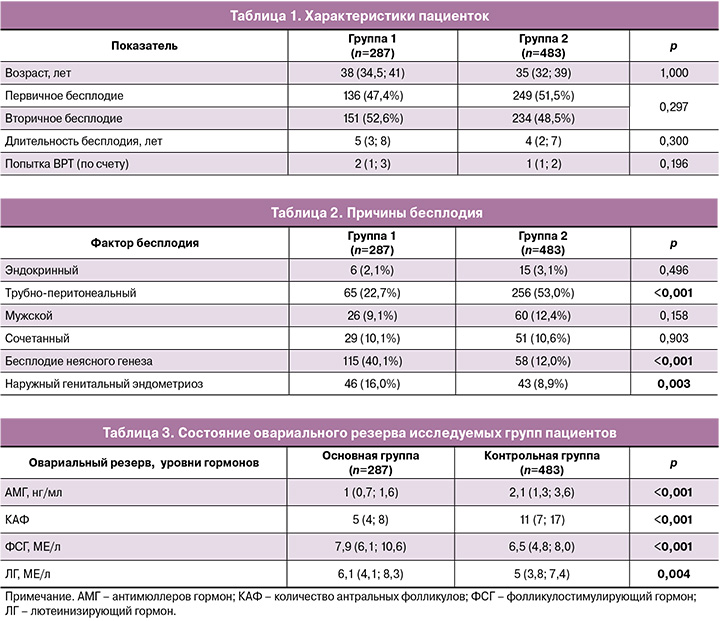
Таким образом, значимыми факторами были только возраст пациентки и уровень АМГ. Для определения достоверности указанных признаков выполнен ROC-анализ, ROC-кривая представлена на рисунке 1. Площадь под кривой (AUC) составила 0,739, чувствительность – 83,9%, специфичность – 48,4% (ОШ=5,57; 95% ДИ 3,88–8,01).
Число полученных ооцитов и число полученных зигот является важным показателем эффективности эмбриологического этапа программ ЭКО (рис. 2).
Не отрицая зависимости формирования бластоцист от числа ооцитов и зигот, нельзя полностью ориентироваться только на этот факт.
В настоящем исследовании у 28,2% пациенток, имеющих остановку развития эмбрионов, было получено достаточное и сопоставимое с группой контроля количество зрелых ооцитов (6 и более), что диктует необходимость поиска других факторов, обуславливающих в первую очередь качество гамет, а не только их количество.
Мы попытались сравнить клинико-лабораторные характеристики выбранных репрезентативных по возрасту пациенток группы исследования и контрольной группы (рис. 3).
При последующем анализе мы исключили фактор возраста и малого количества полученных ооцитов, сравнив пациенток до 36 лет с получением более 5 ооцитов и не менее 3 зигот для выявления факторов, связанных с арестом эмбриогенеза, в группе пациенток, где данный исход является наименее ожидаемым (табл. 6), и женщин с аналогичными характеристиками, но имеющими не менее 1 бластоцисты, пригодной для переноса. Группу 1а (исследования) составили 37 женщин в возрасте 32 (30,5; 35,5) лет, у которых в программе ЭКО было получено 8 (6; 12) зрелых ооцитов и 4 (3; 6) зиготы, но все эмбрионы остановились в развитии. Группу 2а (контроль) составили 37 пациенток в возрасте 32 (30,5; 35,5) лет, у которых в программе ЭКО было получено 10 (8; 18) зрелых ооцитов, 8 (5; 10) зигот и 4 (3; 5) бластоцисты.
Несмотря на сопоставимость пациенток, были выявлены следующие различия.
1. Пациентки с арестом эмбриогенеза имели большую продолжительность бесплодия (5 (3; 8) лет против 3 (2; 4) лет соответственно, p=0,035).
2. Первичное бесплодие в группе 1a имело место у 54,1% пациенток против 27,0% в группе 2a (p=0,032).
3. Тяжелую форму патозооспермии, в том числе в сочетании с другими факторами бесплодия, имели 17/37 (46,0%) и 6/37 (16,2%) супругов соответственно (p=0,011).
4. Бесплодие неясного генеза диагностировано в 24,3% случаев в группе 1a против 5,4% в группе 2a (p=0,046).
5. Наружный генитальный эндометриоз выявлен у 25,9% пациенток против 3,7% соответственно (p=0,050).
6. В группе 1a неразвивающиеся беременности в анамнезе имели 88,2% пациенток с вторичным бесплодием против 44,4% в группе 2a (p=0,005).
7. Пациентки группы 1a имели не менее 3 неудачных попыток ЭКО в анамнезе (3 (0; 4), группы 2a – 1 (0; 1)) (p=0,048).
Обсуждение
Остановку в развитии эмбрионов, полученных при проведении программы ЭКО, можно отнести к разряду физиологических явлений, своего рода естественному отбору, когда нежизнеспособные эмбрионы не развиваются. Считается, что нормой является частота бластуляции 40–45% числа полученных зигот [23]. Тем не менее в ряде случаев не удается получить эмбрион, пригодный для переноса, происходит остановка в развитии всех полученных эмбрионов. К сожалению, это явление усугубляется, что связано со старшим возрастом пациенток и малым количеством получаемых ооцитов. Настоящее исследование подтвердило общеизвестный факт о том, что клиническими факторами, обуславливающими нарушение развития эмбрионов, является возраст женщины и связанное с ним снижение овариального резерва, диагностируемое по уровню АМГ. В настоящей работе определена возможность формирования бластоцисты в зависимости от количества полученных ооцитов и зигот. Выявленные закономерности могут быть полезны в практической работе врача, когда, оценивая возможное число ооцитов, полученных при стимуляции яичников, можно предположить, будет ли бластоциста, пригодная для переноса в полость матки. Более того, при неблагоприятном прогнозе дробления эмбрионов можно изменить тактику ведения пациентки и осуществить ранний перенос эмбриона – на 2–3-и сутки развития, а может быть, на стадии зиготы. Такие немногочисленные работы встречаются в литературе [24–26]. Вместе с тем ситуации, когда получают не менее 5 зрелых ооцитов и не менее 3 зигот, а эмбрионы останавливаются в развитии, трудны как для объяснения, так и для клинического решения. В представленном исследовании мы сравнили клинико-анамнестические данные репрезентативных по возрасту, состоянию овариального резерва, количеству полученных зрелых ооцитов и зигот женщин с нарушением параметров раннего эмбриогенеза и пациенток, у которых были бластоцисты, пригодные для переноса. Отличающимися факторами оказались большее количество неразвивающихся беременностей в 1а группе по сравнению с группой сравнения 2а, наличие бесплодия неясного генеза, большая доля выявленного наружного генитального эндометриоза. По всей видимости, указанные факторы могут являться возможными клиническими причинами нарушения развития эмбрионов. Это подтверждается и результатами предыдущих попыток ЭКО у пациенток, когда ни в одной из попыток не было получено эмбрионов, пригодных для переноса. Представленные результаты диктуют необходимость тщательного анализа анамнестических, клинических характеристик пациенток, результатов предыдущих программ ЭКО для определения тактики достижения беременности.
Заключение
Развитие эмбрионов на ранних стадиях культивирования и частота формирования бластоцист зависят от количества полученных зрелых ооцитов и зигот, что, в свою очередь, определяется возрастом пациентки и состоянием ее овариального резерва. Наличие неразвивающихся беременностей в анамнезе, бесплодия неясного генеза, наружного генитального эндометриоза, нарушения развития эмбрионов в предыдущих попытках ЭКО – клинико-анамнестические характеристики, которые могут быть факторами риска остановки развития эмбрионов у молодых женщин даже при условии получения не менее 5 зрелых ооцитов и не менее 3 зигот.



