Известно, что наибольшую группу больных гинекологического стационара представляют пациентки с миомой матки. Операции по поводу миомы матки составляют 80% плановых хирургических вмешательств [1, 2]. Интраоперационные хирургические проблемы связаны со значительными размерами матки, локализацией узлов миомы (атипичные миомы матки) и вероятностью значительной кровопотери во время оперативного вмешательства, особенно в объеме миомэктомии [3, 4]. Одним из решающих факторов положительного исхода оперативного лечения гинекологических больных является необходимость адекватного восполнения интраоперационной кровопотери. Последние годы ознаменовались бурным развитием нового направления, объединяющего хирургов, анестезиологов, гематологов и трансфузиологов – кровесберегающей хирургии [5–8]. Одним из наиболее значимых методов кровесбережения, используемых при оперативном лечении больных, является аппаратная интраоперационная реинфузия аутоэритроцитов (ИРА) с использованием современных сепараторов крови, что позволяет произвести отмывание собранной из полости крови аппаратным способом [9, 10]. Суть метода проста: кровь из операционной раны аспирируется с помощью стерильного насоса в специальную емкость, где смешивается с антикоагулянтом, затем поступает в сепаратор, где во время вращения промывается физиологическим раствором, происходит гемоконцентрация, и конечным продуктом является эритровзвесь с гематокритом порядка 60%. При аппаратном отмывании эритроцитов продукты деградации фибрина и фибриногена, разрушенные или поврежденные клетки крови вымываются наиболее тщательно, одновременно обеспечивается максимальная защищенность крови от бактериального загрязнения. Имеются данные о том, что срок жизни отмытых для реинфузии аутоэритроцитов равен обычным эритроцитам. Отмывание эритроцитов существенно снижает уровень свободного гемоглобина, уменьшая их возможный нефротоксичый эффект. При тщательном отмывании реинфузируемой эритровзвеси уровень свободного гемоглобина в плазме пациента не повышается. Тщательная аспирация и отмывание эритроцитов позволяет даже при массивной кровопотере достичь практически исходного уровня гемоглобина. При этом улучшаются показатели гемостаза, снижается риск тромбоэмболических осложнений [11–13]. Авторами отмечено, что в гинекологической практике перспективно применение данного метода при кровопотере более 500 мл, что способствует снижению частоты инфекционно-воспалительных осложнений на 8% и сокращению койко-дней на 2-е сут у женщин по сравнению с пациентками, которым переливали компоненты донорской крови [14, 15]. Исследования эритроцитов, меченных радиоактивным изотопом хрома, показали, что одна доза аутокрови больного может заменить 2–4 дозы донорской крови [16]. А.П. Зильбер [17] показал достоверные различия по длительности пребывания в стационаре больных после переливания донорской и аутокрови. С учетом затрат на пребывание и длительность пребывания стоимость лечения каждого больного, получившего донорскую кровь, увеличивается в среднем на 30%. Оптимизация трансфузионной терапии позволяет адекватно восполнить дефицит ОЦК и восстановить кислородтранспортную функцию крови. Большинство авторов считают аутодонорство единственным методом, позволяющим обеспечить максимальную инфекционную безопасность, которая является основополагающей характеристикой трансфузионной терапии [18, 19]. Вместе с тем достаточно ограниченные сведения об использовании интраоперационной аппаратной реинфузии в оперативной гинекологии определяют необходимость комплексной оценки влияния данного метода на показатели гомеостаза оперированных больных.
Цель настоящего исследования: оценка влияния ИРА на морфофункциональные показатели эритроцитов у больных, перенесших операцию по поводу миомы матки.
Материали методы исследования
Группу исследования составили 179 пациенток, оперированных по поводу множественной миомы матки (миомэктомия и гистерэктомия). При операции 94 пациенткам (1-я – основная группа) с целью восполнения кровопотери был применен метод интраоперационной реинфузии аутоэритроцитов на аппарате для аутотрансфузии крови в комплексе с инфузионно-трансфузионной терапией, при этом 29 пациенток оперированы лапароскопическим доступом, 65 женщин – абдоминальным доступом. 85 больным (2-я – сравнительная группа) для восполнения глобулярного объема были перелиты донорские эритроциты, проводилась инфузионная и симптоматическая терапия, при этом 25 пациенток оперированы лапароскопическим доступом, 60 – абдоминальным доступом (поперечное надлобковое чревосечение). Группа контроля – 20 здоровых женщин – доноров крови. Отбор пациенток в группы осуществлялся по следующим критериям: оперативное лечение в объеме миомэктомии или гистерэктомии у пациенток с множественной миомой матки, миомой матки больших размеров, с низким и интралигаментарным расположением миоматозных узлов; редкие группы крови, при этом анемия – гемоглобин менее 90 г/л, отягощенный гемотрансфузионный анамнез, отказ от переливания донорских компонентов. Критериями исключения из исследования были оперативное вмешательство у больных с заболеваниями крови и дефектами системы гемостаза; оперативное вмешательство у больных со спаечным процессом в брюшной полости; оперативные вмешательства при злокачественных опухолях.
При обследовании использовались клинические и лабораторные методы. Для определения объема интраоперационной кровопотери использовали визуальный метод (оценка интенсивности пропитывания операционного материала и белья кровью); индекс Альговера [20]: шоковый индекс = ЧСС/ АДс, где ЧСС – частота сердечных сокращений; АДс – систолическое артериальное давление; аппаратный метод: при проведении интраоперационной реинфузии аутоэритроцитов величину кровопотери оценивали на основании показаний аппарата для аутотрансфузии крови. Расчет при автоматическом режиме работы с получением эритровзвеси с гематокритом 60% проводится по следующей формуле: ВК=1,5×V эр.×К, где ВК – величина кровопотери (мл), 1,5 – константа, учитывающая гемоконцентрацию получаемой эритровзвеси (гематокрит 60–65%), при гематокрите 30–40% коэффициент концентрации (1,1–1,2), К – коэффициент потерь на гемолиз, потери вне раны и на операционном материале (в среднем 1,5).
Для оценки морфометрических и электрокинетических показателей эритроцитов использовали возможности нового отечественного аппаратно-программного комплекса (АПК) (ООО «ВЕСТТРЭЙД ЛТД», Москва), включающего модули когерентной фазово-интерференционной микроскопии (КФМ) и компьютерного микроэлектрофореза (МЭФ) [21, 22]. Модуль КФМ представляет собой микроинтерферометр Линника на базе модифицированного и автоматизированного МИИ-4 (ЛОМО, Санкт-Петербург) с регистрацией фазы света путем модуляции опорной волны. Источник света – лазер с длиной волны 633 нм. В основе принципа действия микроскопа, содержащего идентичные объективы в сигнальном и реперном плечах, лежит сравнение волнового фронта, прошедшего через объект, с опорным, отраженным от высококачественного зеркала. Проводили визуализацию фазово- интерференционного образа клетки (отображение топограммы, 3-мерного изображения, оптического профиля, гистограммы распределения фазовых высот); расчет морфометрических показателей отдельных клеток (диаметр – Dmax, периметр – Per, высота – Height, площадь – Area, объем – Vol); оценку распределения объема и площади фазово-интерференционного образа клетки по уровням сканирования (взаимодействие с чужеродной поверхностью); контурное изображение топографии интерференционного поля (послойная интерферограмма клетки в псевдоцвете); интегральный анализ клеточной популяции по мерным признакам (Dmax, Per, Height, Area, Vol); построение гемоцитограмм, диагностики с цифровой обработкой. Модуль микроэлектрофореза аппаратно-программного комплекса включает прибор для компьютерного микроэлектрофореза («Цито-Эксперт», ТУ 9443-137-43674401-2005) для оценки изменения среднего эффективного электрического заряда и доли подвижных эритроцитов. Включив видеокамеру, проводили последовательно запись нескольких видеофайлов (серии) клеточного микроэлектрофореза с одного поля зрения с перерывами по времени. Автоматическую обработку записанных видеофайлов проводили с помощью программного пакета NTUComplex. По завершении обработки составляли отчет, в котором, кроме таблицы амплитуд колебаний для каждой распознанной клетки, приводили следующие электрокинетические параметры для всей клеточной популяции (Руководство пользователя пакета программ NTUComplex): среднее значение амплитуды колебаний и ее отклонения; доля подвижных клеток относительно общего количества клеток; гистограмма распределения клеток по амплитудам (график); асимметрия гистограммы (численный показатель ее симметричности); эксцесс гистограммы (численный показатель ее пирамидальности).
Исследования морфофункционального состояния эритроцитов проводили в динамике до и после оперативного лечения пациентки и в полученном реинфузате в лаборатории компьютерной цитоморфометрии. Математическая обработка и анализ полученных результатов проведены методом вариационной статистики. Для количественных показателей определяли среднее значение (M), ошибку среднего (m), средне-квадратичное отклонение (δ), медиана (Ме) и интерквартильный размах (25–75%). Достоверность различий между группами оценивали по t-критерию Стьюдента или U-критерию Манна–Уитни (для показателей, не удовлетворяющих закону нормального распределения). Изменение количественных показателей в динамике оценивалось с помощью парного критерия Стьюдента или непараметрического критерия Вилкоксона. Сравнение частот осуществлялось с помощью критерия χ2. Различия считали достоверными при значении р<0,05.
Результаты исследования и обсуждение
Возраст пациенток колебался от 24 до 56 лет и в среднем составил 41,6±5,6 года. Все больные поступили на оперативное лечение по поводу множественной миомы матки. Длительность заболевания колебалась от 4 до 12 лет и в среднем составила 5,4±4,9 года. Анализ структуры экстрагенитальной патологии, сопутствующей миоме матки, выявил существенное преобладание заболеваний органов пищеварения, которые регистрировались в различных группах с примерно одинаковой частотой до 33,2%. При изучении менструальной функции больных установлено, что более половины паци- енток (58%) оценивали менструальные выделения как длительные и обильные, у 28% менструации были болезненными, тяжесть внизу живота отметили 24%, увеличение объема живота – 11%, нарушение мочеиспускания – 18%. Показаниями к оперативному лечению у большинства (68%) больных были большие размеры миоматозно измененной матки (14 недель гестации и больше). У 46 (25,6%) женщин наблюдались патологические маточные кровотечения по типу менометроррагии. У 75 (41,9%) наблюдались нарушения функции соседних органов.
Миомэктомия была проведена в основной группе у 72% больных, в группе сравнения у 66%. Гистерэктомия была проведена у 27% женщин в основной группе и у 31% в сравнительной. Интраоперационная реинфузия крови проводилась при кровопотере более 500 мл. Объем кровопотери в основной группе, определенный аппаратным методом, в среднем составил 1012,6±511,3 мл. В группе сравнения объем интраоперационной кровопотери составил в среднем 998,4±405,3 мл. Объем реинфузированных аутоэритроцитов в основной группе в среднем составил 579,3±227,4 мл. Объем трансфузируемых донорских эритроцитов в сравнительной группе составил в среднем 598,9±198,4 мл.
При изучении влияния интраоперационной реинфузии аутоэритроцитов на морфофункциональное состояние эритроцитов периферической крови обследованных пациенток с привлечением экспресс-методов оценки морфометрических и электрокинетических показателей клеток было установлено, что фазовоинтерференционные образы подавляющего большинства живых красных клеток крови сохраняют классическую форму двояковогнутого диска (рис. 1).
Рисунок 1. Различные формы эритроцитов: дискоцит (1), эхиноцит (2), сфероцит (3). По данным электронной микроскопии 3000х (А) и витальной компьютерной фазометрии 1000х: фазово-интерференционный портрет живой клетки (В), 3D-реконструкция (С).
Топограмма эритроцита в псевдоцвете и его трехмерное изображение, взаимно дополняя друг друга, помогают воссоздать точное представление о рельефе и объемных характеристиках живой клетки. Центральная часть интактного эритроцита имеет малую оптическую плотность и отражает зону пэллора – вогнутую область. Периферийная − оптически более плотная часть фазового изображения, соответствует эритроцитарному тору, где концентрация гемоглобина наиболее высока. Очевидно, что зарегистрированные нами особенности различных морфологических типов живых клеток четко сопоставимы с данными электронной микроскопии, при этом метод не требует проведения сложной и длительной пробоподготовки и позволяет получать результат в режиме реального времени.
Таблица 1. Средние в популяции размерные параметры эритроцитов периферической крови практически здоровых женщин-доноров (М±σ).
Таблица 2. Электрокинетические показатели эритроцитов периферической крови (М±σ).
В табл. 2 представлены средние в популяции размерные параметры эритроцитов периферической крови практически здоровых женщин – доноров крови и больных миомой матки до оперативного проведения лечения.
Полученные данные свидетельствуют о том, что у пациенток с миомой матки выявлена тенденция к увеличению среднего диаметра, периметра и площади циркулирующих эритроцитов при снижении средних значений фазовой высоты клеток.
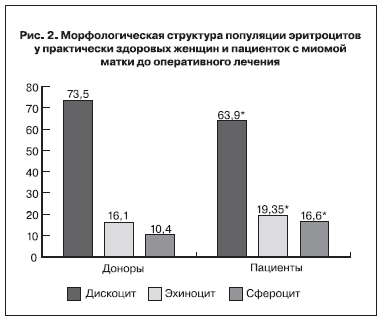
При анализе фазово-интерференционных изображений следует учитывать, что размерные параметры фазового портрета содержат информацию не только о пространственно-объемных характеристиках клетки, но и о ее оптических свойствах, в частности о внутриклеточной анизотропии. Величина показателя преломления, измеряемая в каждой точке цитообъекта, непосредственно зависит от концентрации, химического состава, агрегатного состояния внутриклеточного вещества, наличия или отсутствия органелл и включений. Изменение любого из указанных условий находит отражение в характерных локальных трансформациях фазового изображения клетки. По динамике размеров эритроцитов можно косвенно судить о возрастном составе циркулирующего пула клеток. А такие показатели, как фазовая высота и объем клеток непосредственно связаны с содержанием внутриклеточного гемоглобина. Следовательно, зарегистрированная тенденция увеличения средних в популяции диаметра, периметра и площади эритроцитов у пациенток с миомой матки демонстрирует повышенное содержание молодых незрелых эритроцитов и отражает некоторое увеличение уровня активности спонтанного эритропоэза в условиях компенсированной анемии. Снижение величин фазовой высоты и объема клеток указывают на появление признаков гипохромии. Анализ морфологической структуры популяции эритроцитов показал, что у здоровых женщин-доноров содержание дискоцитов, эхиноцитов и сфероцитов составляет 73,5, 16,1 и 10,4% соответственно (рис. 2). В группе обследованных пациенток с миомой матки соотношение морфологических типов клеток отличается и составляет 63,9, 19,5 и 16,6% соответственно. Отношение числа всех трансформированных эритроцитов к абсолютному количеству дискоцитов – индекс трансформации – у этой группы (0,56) был значительно выше, чем у здоровых добровольцев (0,36), что количественно характеризует наличие и степень выраженности пойкилоцитоза. Известно, что большинство клеток животного происхождения, в том числе эритроциты, на своей поверхности несут определенный заряд [23]. Этот заряд характеризует электрокинетические свойства клеток, то есть скорость их передвижения в электрическом поле, которая определяется методом микроэлектрофореза. Обычно поверхность живых клеток имеет отрицательный заряд, величина которого зависит от количества адсорбированных на их поверхности молекул или ионов. Мы предприняли попытку оценить динамику электрокинетических свойств эритроцитов у пациенток с миомой матки в процессе оперативного лечения с использовани ем ИРА и без нее.
Результаты электрокинетического анализа эритроцитов представлены в табл. 2.
Выявлено, что у здоровых доноров количество клеток, пригодных к обработке, составило 175,8±69,3 в поле зрения, неподвижных клеток всего 5,23±1,73%, средняя амплитуда колебаний эритроцитов – 8,53±1,62 мкм. У больных миомой матки до операции эти показатели достоверно отличаются от показателей здоровых доноров. Установлено, что у пациенток основной группы среднее число пригодных к обработке клеток составило 165,87±72,65 (в группе сравнения 159,9±67,9); средняя амплитуда колебаний эритроцитов была ниже и составила 5,62±1,78 мкм (в группе сравнения 6,63±2,18 мкм); процент неподвижных эритроцитов – 29,21±7,92% (в группе сравнения 28,37±9,61%). Очевидно, к этим изменениями приводят такие нарушения, сопровождающие миому матки, как анемия, волемические, реологические и метаболические расстройства [24]. Хронические кровотечения очень быстро истощают адаптивные возможности организма женщины, в частности систем кроветворения, микроциркуляции, реологии крови, и способствуют развитию хронической тканевой гипоксии. В полученном интраоперационно реинфузате аутоэритроцитов среднее число пригодных к обработке клеток значительно возросло и составляло уже 339,40±125,53, средняя амплитуда колебаний эритроцитов достоверно возросла до 15,43±4,17 мкм, процент неподвижных эритроцитов значительно уменьшился – всего 10,52±4,18%. Зарегистрированные изменения, очевидно, связаны с активацией эритроцитов вследствие непосредственного контакта крови с фильтрующими мембранами, кровопроводящими магистралями, отмывающими растворами.
В послеоперационном периоде у пациенток, получивших ИРА, отмечено значимое по сравнению с показателями второй группы женщин и с исходными параметрами улучшение электрокинетических показателей: среднее число пригодных к обработке клеток возросло до 331,25±98,0; средняя амплитуда колебаний эритроцитов достоверно возросла до 6,12±3,46 мкм, процент неподвижных эритроцитов составил 36,23±6,92%. У пациенток сравнительной группы (без ИРА) достоверно выше процент неподвижных клеток – до 46,62±8,81%; снизилась амплитуда колебаний эритроцитов до 4,66±0,99 мкм, недостоверно возросло число клеток, пригодных к обработке, до 229,33±12,4.
Заключение
Таким образом, использование К.ФМ и МЭФ позволило количественно оценить уровень изменений электрокннетических и морфометрических свойств эритроцитов у пациенток с миомой матки ло оперативного вмешательства, качество отмытых аутоэритроцнтов и показатели после их переливания. Данные, полученные с помощью вышеуказанных подколов, являются взаимно дополняющими, и в режиме реального времени обеспечивают про веление объективного комплексного анализа морфофункционального состояния эритроцитов. Полученные результаты исследования по изучению влияния ИРА на морфокннетические показатели эритроцитов могут служить убедительным подтверждением эффективности и целесообразности ее применения при гинекологических операциях, в частности по поводу миомы матки, которая обеспечивает быструю стабилизацию морфометрических и электрокинетических показателей циркулирующих эритроцитов, что, несомненно, способствует улучшению к ислородтра не портной функции клеток, восстановлению реологических свойств крови. У пациенток при переливании донорских эритроцитов выявлено отрицательное влияние на морфокинетические показатели эритроцитов, что, очевидно, связано с хранением донорских эритроцитов, так как показано, что при хранении в эритроцитах происходят неблагоприятные реакции: ухудшаются реологические свойства, снижается активность каталазы
(основного оке и дан та эритроцитов), активируется протеолиз и перекисное окисление липидов.
происходит диск-трансформация, уменьшаются связывающая способность, сроки циркуляции
перелитых клеток, их антигипоксическое, антитоксическое и антианемическое действие |25. 26].
При снижении эластичных свойств мембраны эритроцитов последние теряют способность свободно проникать в узкий просвет капилляров, что приводит к шунтированию эритроцитов через прекапидлярные анастомозы. Доказано, что в 1 мл консервированной нитратом крови в 1-й лень хранения образуется до 200, а при двухнедельном хранении — около 20 000 микросгустков (размером от 15 до 200 мкм). В системе для переливания крови задерживаются только микросгустки размером более 160 мкм. а остальные попадают в организм реципиента, оседают в легочных капиллярах и могут быть причиной легочно-циркуляторной недостаточности и респираторного дистресс-синдрома, в связи с этим переливание донорских компонентов следует проводить с использованием микроагрегатных и
лейкоцитарных фильтров 127]. Аппаратная интраоперационная реинфузия аутоэритроцитов
является современным методом крове сбережения, позволяющим быстро и эффективно восстановить глобулярный объем циркулирующей крови при оперативном лечении больных миомой матки.



