Исследование поддержано РФФИ, грант 12-03-00401.
Рак яичников – одна из наиболее инвазивных и злокачественных опухолей женской репродуктивной системы, при этом у большинства больных заболевание диагностируется на достаточно поздних стадиях, когда опухоль уже распространена по брюшине. Трудности ранней диагностики и высокий метастатический и инвазивный потенциал рака яичников определяют необходимость углубленного изучения механизмов роста и распространения этой опухоли, знание которых могло бы стать основой для прогнозирования результатов стандартного лечения больных и включения в схемы препаратов, целенаправленно воздействующих на регуляторные молекулы.
Важнейшую роль в возникновении и прогрессии различных злокачественных опухолей играет сигнальная система инсулиноподобных факторов роста (ИФР). Она включает ИФР 1-го и 2-го типа (ИФР-I и ИФР-II) – митогенные пептиды, высокогомологичные друг другу и инсулину, синтезирующиеся в печени и некоторых других тканях под влиянием соматотропного гормона гипофиза и воздействующие на периферические ткани, распространяясь по организму с кровью (центральный или эндокринный механизм действия); их трансмембранные клеточные рецепторы и ИФР-связывающие белки (ИФРСБ) крови. ИФР синтезируются также клетками различных опухолей и являются в этом случае ауто/паракринными медиаторами, опосредующими рост, метастазирование и антиапоптотические ответы злокачественных клеток. ИФР, рецепторы ИФР и ИФРСБ образуют сложную сеть взаимодействий как между собой, так и с другими биологическими регуляторами роста и выживаемости клеток.
В настоящее время известны шесть ИФРСБ, связывающих ИФР, с одинаковым или даже большим сродством, чем ИФР-рецепторы, а также семейство гомологичных ИФРСБ, которые обладают значительно меньшим сродством к ИФР-лигандам. ИФРСБ модулируют биологическую доступность и активность ИФР несколькими способами: осуществляют перенос ИФР из периферической крови к тканям-мишеням (ИФРСБ-1, 2 и 4), поддерживают резервный уровень ИФР в крови (главным образом ИФРСБ-3), усиливают или ингибируют эффекты ИФР, а также опосредуют некоторые ИФР-независимые биологические эффекты. В различных физиологических условиях ИФРСБ могут, как стимулировать, так и подавлять эффекты ИФР, либо продлевая время полужизни факторов роста, либо конкурируя с рецепторами за их связывание. Активность самих ИФРСБ и опосредованно клеточные эффекты ИФР регулируются специфическими протеазами, в частности, сериновыми протеазами и матриксными металлопротеиназами, которые увеличивают биодоступность ИФР, гидролизуя ИФРСБ до небольших фрагментов, обладающих меньшим сродством к ИФР.
Сигнальная система ИФР играет важную роль как в нормальном функционировании яичников [1], так и в возникновении и прогрессии злокачественных эпителиальных опухолей [2]. Все компоненты этой системы экспрессируются в клетках рака яичников и являются значимыми факторами прогноза заболевания [3–5]. В то же время роль циркулирующих в периферической крови ИФР и ИФРСБ в возникновении и прогрессии рака яичников неоднозначна. Одной из важнейших причин для исследования роли ИФР-сигнальной системы при раке яичников является возможность использования специфических («таргетных») ингибиторов для подавления ее активности [6–8]. Существуют несколько подходов к решению этого вопроса: снижение уровня и/или биологической активности циркулирующих факторов роста, блокирование функции рецепторов и активация АМР-киназы, блокирующей нижележащие эффекты рецепторов ИФР. В экспериментальных исследованиях уже продемонстрирована возможность торможения роста рака яичников с помощью моноклональных антител к ИФР-рецепторам [9, 10] и низкомолекулярных ингибиторов их активности [11, 12], а также активатора АМР-киназы метформина [8, 13]. Проводятся также первые клинические испытания подобных препаратов при раке яичников [14, 15].
Цель данного исследования – сравнительная оценка содержания ИФР-I, II и ИФРСБ 1, 2 и 3-го типа в сыворотке крови больных различными новообразованиями яичников, а также анализ взаимосвязи изученных показателей с основными клинико-морфологическими особенностями рака яичников.
Материал и методы исследования
В исследование вошли 44 больных раком, а также 11 больных пограничными и 12 доброкачественными новообразованиями яичников; контрольную группу составили 33 практически здоровые женщины. Все обследованные группы были сравнимы по возрасту, медианы которого составили соответственно 56,5 (21–82), 35 (22–55), 48 (20–71) и 37 (24–65) лет. По гистологическому строению 3 доброкачественные опухоли принадлежали к серозному типу, 4 – к эндометриоидному, 6 – к другим гистологическим типам. Пограничные опухоли относились преимущественно к серозному (6) или муцинозному (3) типу. 72% злокачественных опухолей представляли собой серозные аденокарциномы. У 8 больных раком яичников была I стадия заболевания по классификации FIGO, у 4 – II, у остальных пациенток был распространенный процесс с преобладанием IIIc стадии (18 больных).
Содержание ИФР-I, II и ИФРСБ-1, 2, 3 исследовали в сыворотке крови, полученной по стандартной методике до начала специфического лечения. Концентрацию маркеров определяли с помощью стандартных наборов для прямого иммуноферментного анализа производства компании «Mediagnost» (Германия) в соответствии с инструкциями производителей. Измерения проводили на автоматическом анализаторе BEP-2000 (Siemens Healthcare, Германия). Концентрацию исследованных показателей в сыворотке крови выражали в нг/мл.
Данные обрабатывали с помощью программы Statistica 7.0. В связи с тем, что распределение большинства исследованных показателей отличалось от нормального, при сравнении показателей и анализе их взаимосвязей использовали непараметрические методы: критерии Манна–Уитни и Краскела–Уоллиса, тест корреляции рангов Спирмена (R). Различия и корреляции считали достоверными при p<0,05.
Результаты исследования и обсуждение
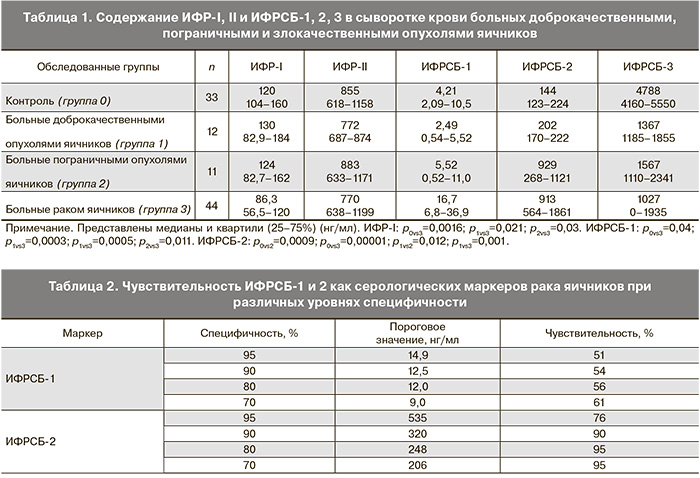
На первом этапе статистического анализа мы сопоставили содержание ИФР и ИФРСБ в сыворотке крови больных доброкачественными, пограничными и злокачественными опухолями яичников и женщин контрольной группы (табл. 1).
Обнаружено достоверное снижение медианного уровня ИФР-I и увеличение уровня ИФРСБ-1 в сыворотке крови больных раком яичников по сравнению со всеми остальными группами пациенток, тогда как уровень ИФР-II был практически одинаковым во всех группах. Уровень ИФРСБ-2 был повышен в сыворотке крови больных раком и пограничными опухолями яичников по сравнению как с контролем, так и с группой больных доброкачественными новообразованиями. Наиболее высокий уровень ИФРСБ-3 выявлен в сыворотке крови женщин контрольной группы, а самый низкий – у больных раком яичников, однако достоверных различий между группами не выявлено, и в целом тенденция не достигала уровня статистической значимости (p=0,059). Аналогичные изменения уровня ИФР-I мы наблюдали у больных другими опухолями репродуктивной системы – раком молочной железы [16] и раком шейки матки [17]. Выявленные закономерности соответствуют также данным литературы о содержании ИФР-I и ИФРСБ в сыворотке крови больных раком яичников [18–20], но так же, как и эти данные, находятся в определенном противоречии с результатами некоторых эпидемиологических исследований, свидетельствующих о связи высоких сывороточных уровней ИФР-I с риском развития рака яичников в определенных возрастных группах [21]. Следует, однако, отметить, что совместный анализ данных трех когортных исследований, проведенный в работе P.H. Peeters и соавт. [22], не подтвердил влияния компонентов системы ИФР на риск развития рака яичников.
Выявлена отрицательная корреляционная связь уровня ИФР-I в сыворотке крови всех больных новообразованиями яичников с уровнями ИФРСБ-1 (R=-0,45; p=0,0004) и ИФРСБ-2 (R=-0,43; p=0,008) и положительная взаимосвязь уровня ИФР-I и ИФРСБ-3 (R=0,57; p=0,00004). Уровень ИФРСБ-1 и ИФРСБ-2 также положительно коррелировал между собой (R=0,65; p=0,00002). Аналогичные взаимосвязи обнаружены и при анализе группы больных раком яичников. В то же время в сыворотке крови женщин контрольной группы не выявлено взаимосвязи уровня ИФР-I ни с одним из изученных ИФРСБ, тогда как уровень ИФР-II положительно коррелировал с ИФРСБ-3. Совокупность этих данных свидетельствует о нарушении баланса между ИФР и связывающими их белками крови у больных раком и другими новообразованиями яичников, и косвенно отражает различную роль ИФРСБ-1 и 2, с одной стороны, и ИФРСБ-3, с другой, в регуляции биодоступности ИФР.
Потенциально значимыми серологическими маркерами рака яичников оказались только ИФРСБ-1 и ИФРСБ-2, уровень которых повышен у больных раком (оба маркера) и пограничными опухолями (ИФРСБ-2). Для оценки диагностической значимости мы рассчитали их чувствительность при различных уровнях специфичности (табл. 2).
Оказалось, что чувствительность ИФРСБ-1 при приемлемом уровне специфичности (70% и более) составляет не более 61%, тогда как ИФРСБ-2 обладает достаточно высокой чувствительностью (76–95%) при специфичности 95–70% соответственно. Оптимальным пороговым уровнем этого маркера является, на наш взгляд, показатель 320 нг/мл, при котором и чувствительность, и специфичность составляют 90%.
Дополнительным свидетельством в пользу возможности использования ИФРСБ-2 в качестве серологического маркера рака яичников является положительная взаимосвязь его содержания в сыворотке крови со стадией рака яичников (R=0,52; p=0,008) и положительная корреляция уровня данного маркера с показателями классического маркера рака яичников СА-125 (R=0,39; p=0,041). Уровень остальных исследованных компонентов системы ИФР не был связан ни со стадией по классификации FIGO, ни с уровнем СА-125. Кроме того, детальный анализ взаимосвязей уровня всех исследованных белков с основными показателями распространенности рака яичников – размером первичной опухоли по данным ультразвукового исследования, наличием и характером диссеминации по брюшине и метастазов в большом сальнике, наличием и объемом асцита – также не выявил каких-либо достоверных корреляций. Не обнаружено и зависимости сывороточного уровня ИФР/ИФРСБ от гистологического строения и степени дифференцировки опухоли.
Заключение
Сравнительное иммуноферментное исследование содержания ИФР-I и II и связывающих их белков 1, 2 и 3-го типа в сыворотке крови больных различными новообразованиями яичников и здоровых женщин продемонстрировало существенные нарушения баланса ИФР/ИФРСБ у больных раком яичников, свидетельствующие об увеличении биодоступности ИФР для опухолевых клеток при отсутствии выраженных изменений концентрации самих факторов роста (ИФР-II) или даже ее снижении (ИФР-I). Показано, что ИФРСБ-2 является потенциальным серологическим маркером рака яичников, концентрация которого зависит от стадии заболевания и коррелирует с показателями СА-125, а чувствительность при 90% специфичности составляет также 90%. Несмотря на то что взаимосвязи большинства исследованных показателей с основными клинико-морфологическими особенностями рака яичников не обнаружено, они могут оказаться независимыми факторами прогноза заболевания по результатам дальнейшего наблюдения за обследованными пациентами.



