Врастание плаценты (ВП) – патологическое состояние, характеризующееся аномальной инвазией ворсин трофобласта в стенку матки. Частота возникновения данного осложнения к настоящему времени составляет 1 на 533 беременности, а по некоторым данным – 1 на 272 [1, 2]. Основными факторами риска врастания плаценты являются предлежание плаценты и предыдущее кесарево сечение (КС); риски развития значительно повышаются при сочетании данных факторов, а также в случае расположения плаценты в области рубца на матке после перенесенного КС [3]. Кроме того, не стоит забывать и о том, что повреждение эндометрия в связи с кюретажем стенок полости матки, аблацией эндометрия, а также эмболизация маточных артерий и ручное отделение последа в предыдущих родах также могут привести к аномальному прикреплению плаценты [4]. Глубина и площадь врастания плаценты являются главными факторами, определяющими хирургическую тактику и исходы для пациенток [5]. В последние годы были разработаны консервативные стратегии и мультидисциплинарные подходы, направленные на снижение объема кровопотери и сохранение фертильности пациенток [6].
Целью данного исследования явилась оценка эффективности хирургической тактики у пациенток с различной глубиной инвазии трофобласта.
Материалы и методы
В период с 1 января 2017 г. по 31 декабря 2018 г. был проведен ретроспективный анализ данных 64 пациенток с диагнозом «врастание плаценты» в ФГБУ «НМИЦ АГиП им. В.И. Кулакова» Минздрава России. Все пациентки с вышеуказанным диагнозом были отобраны и включены в исследование. Данные материнских исходов были получены из историй болезни. Оцениваемые переменные включали возраст матери, предшествующие операции на матке, информацию о предыдущих беременностях (количество, предшествующие операции КС), объеме кровопотери, экстирпации матки, перевязке внутренних подвздошных сосудов. Дородовая диагностика ВП проводилась при помощи ультразвукового исследования (УЗИ) и магнитно-резонансной томографии (МРТ). Всем пациенткам с подозрением на ВП проводили оперативное лечение в объеме нижнесрединной лапаротомии с обходом пупка слева, донного КС, комплексного компрессионного гемостаза, баллонной тампонады матки, метропластики, реинфузии аутоэритроцитов. Впоследствии было проведено патоморфологическое исследование для подтверждения диагноза.
Для статистического анализа и построения графиков использовали пакет статистических программ GraphPad Prism (GraphPad Software, США). Для определения нормальности распределения использовали обобщенный тест Д’Агостино–Пирсона. Параметрические данные представлены как среднее значение (стандартное отклонение), непараметрические данные представлены как медиана (интерквартильный размах). Качественные признаки представлены как абсолютное значение (%). Для множественного сравнения параметрических данных использован тест ANOVA, непараметрических данных – тест Краскела–Уоллиса. Для сравнения качественных признаков – точный тест Фишера. Различия считались статистически значимыми при p<0,05.
Результаты
В исследование были включены 64 беременных с ВП, пролеченных в ФГБУ «НМИЦ АГиП им. акад. В.И. Кулакова» Минздрава России в 2017–2018 гг. Диагнозы placenta accreta, increta, percreta были подтверждены при помощи морфологического исследования у 18 (28,1%), 42 (65,6%) и 4 (6,3%) пациенток соответственно.
В табл. 1 представлены демографические характеристики пациенток. Средний возраст пациенток с подтвержденным диагнозом placenta accreta составил 35,1 (4,5) года, при placenta increta – 33,0 (5,3) года, при placenta percreta – 36,5 (3,0) года (p=0,191). Число беременностей в анамнезе также не различалась в группах сравнения: 4 (3–5,25) против 3,5 (2–5) и 3,5 (2,25– 4,75) соответственно (p=0,335). Число самопроизвольных и оперативных родов пациенток в анамнезе составило 1 (1–2) и 2 (1–3) при placenta accreta, 1 (1–1) и 1 (1–2) при placenta increta, 1 (1–1) и 1 (1–2) при placenta percreta соответственно и не было связано со степенью врастания плаценты (p=0,655; p=0,324).
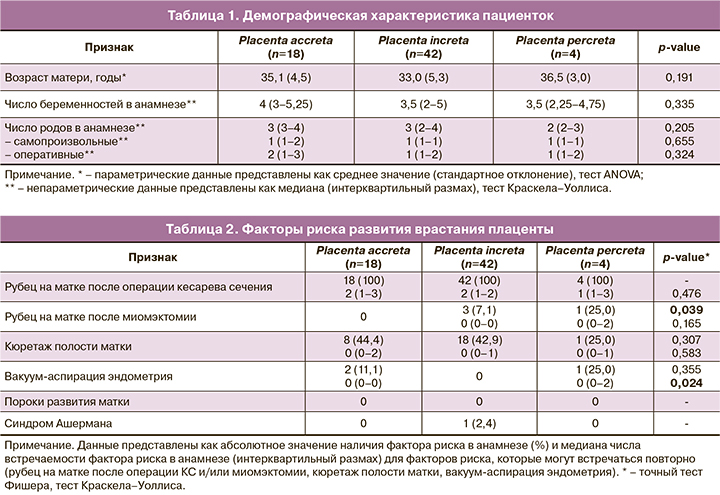
Распространенность наиболее часто встречаемых факторов риска ВП представлена в табл. 2. Рубец на матке после операции КС в анамнезе встречался у всех пациенток с ВП. При этом не было выявлено разницы в частоте оперативных вмешательств: 2 (1–3) вмешательства при placenta accreta, 2 (1–2) – при placenta increta и 1 (1–3) – при placenta percreta (p=0,476). Рубец на матке после миомэктомии в анамнезе встречался только у пациенток с placenta increta (7,1%) и placenta percreta (25,0%) и наблюдался значимо чаще у пациенток с большей глубиной инвазии плаценты (p=0,039). Не было выявлено влияния числа проведенных миомэктомий на степень ВП (p=0,165), что может быть связано с небольшой распространенностью рубца на матке после миомэктомии у пациенток с ВП.
Кюретаж полости матки, в том числе повторный, имелся в анамнезе 44,4% пациенток с placenta accreta, 42,9% пациенток с placenta increta и 25,0% пациенток с placenta percreta (p=0,307). Вакуум-аспирация эндометрия присутствовала в анамнезе у 11,1% пациенток с placenta accreta и 25,0% пациенток с placenta percreta (p=0,355). При этом число вакуум-аспираций эндометрия в анамнезе было ассоциировано со степенью ВП (p=0,024), однако небольшое количество пациенток требует дальнейшего анализа полученных данных. В исследование не вошли пациентки с пороками развития матки, а синдром Ашермана был диагностирован только у 1 (2,4%) пациентки с placenta increta, что делает невозможной оценку влияния данных факторов на степень ВП.
Особенности и исходы оперативного родоразрешения пациенток с ВП представлены в табл. 3. Срок родоразрешения пациенток был сопоставим во всех группах и составил 34,8 (1,2) недели при placenta accretа, 34,5 (1,1) недели – при placenta increta и 34,7 (0,7) недели – при placenta percreta (p=0,593). При этом объем периоперационной (суммарной) кровопотери ожидаемо возрастал с увеличением глубины инвазии ворсин хориона в миометрий. Так, при placenta accreta объем кровопотери составил 975 (700–1600) мл, при placenta increta – 1300 (987,5–2050) мл, при placenta percreta – 2200 (1300–4225) мл (p=0,048). Частота перевязки внутренних подвздошных сосудов также значимо возрастала и составила 5,6, 14,3 и 50% соответственно (p=0,026). При этом частота развития послеродового кровотечения была относительно невысокой и не различалась в группах сравнения (p=0,407). В группе placenta accreta она составила 5,6%, в группе placenta increta – 9,5%, при placenta percreta послеродовое кровотечение не было отмечено ни у одной пациентки, что может быть связано с небольшим размером группы. Проведение гистерэктомии (ГЭ) потребовалось 4 (9,5%) пациенткам с placenta increta и 1 (25%) пациентке с placenta percreta. ГЭ не была произведена ни одной пациентке с placenta accreta. Таким образом, проведение ГЭ значимо чаще требовалось пациенткам с более выраженной степенью ВП (p=0,038).

Обсуждение
Несмотря на то что основной задачей данного исследования являлась оценка эффективности хирургической тактики, остается открытым вопрос патогенеза и рисков развития различных типов ВП. В большом количестве исследований показано, что наиболее значимыми факторами риска являются количество КС в анамнезе и предлежание плаценты, но недостаточно данных о причинах, способствующих увеличению глубины инвазии трофобласта [3]. В связи с этим был проведен анализ наиболее часто встречаемых факторов риска, и получены данные о том, что количество КС в анамнезе не играет значительной роли в развитии более глубокой степени инвазии плаценты, так же как миомэктомия или кюретаж полости матки, однако вакуум-аспирация в анамнезе подтверждает вероятность более глубокого поражения стенки матки. Кроме того, не было выявлено диагностически значимой разницы в возрасте и количестве родов у женщин из различных групп, несмотря на то, что существуют противоречивые данные о повышении риска ВП при увеличении возраста матери, что может быть связано с более высоким паритетом [7], а некоторые таковой взаимосвязи не обнаружили [8].
При анализе сроков родоразрешения не выявлено статистически значимых различий у пациенток с различной степенью инвазии трофобласта. Все женщины были прооперированы в сроке 34–35 недель беременности, что является наиболее оптимальным для предотвращения развития дородового кровотечения и улучшения исходов для новорожденного [9]. Belfort M.A. и Robinson B.K. подтверждают, что родоразрешение в данные сроки при ВП позволяет избежать экстренной операции, вероятность которой после 34–35 недель беременности резко возрастает [10–12].
Основной проблемой, возникающей при родоразрешении пациенток с патологией прикрепления плаценты, является объем интра- и послеоперационной кровопотери, для решения которой необходимо использование оптимальной хирургической техники гемостаза, позволяющей проводить органосохраняющую операцию без фатальных последствий для матери и плода. Данным методом является комплексный компрессионный гемостаз, показавший высокую эффективность и безопасность, а кроме того, снижающий общий объем кровопотери [13]. Однако при сравнении трех групп в зависимости от глубины инвазии трофобласта, несмотря на применение вышеуказанного метода, кровопотеря различалась и была наибольшей в группе placenta percreta. В этой же группе наиболее часто проводилась перевязка внутренних подвздошных сосудов в связи с продолжающимся кровотечением, что подтверждает гипотезу об увеличении кровопотери по мере роста ворсин трофобласта [14]. ГЭ, часто проводимая при ВП, травматична и также способствует увеличению кровопотери, а кроме того, лишает женщину репродуктивного потенциала и нарушает анатомию тазового дна, что в дальнейшем приводит к развитию полисистемных синдромов. Анализ среднего показателя общей кровопотери при ГЭ по поводу ВП варьирует в широком диапазоне от 2000 мл до 7800 мл, в 90% случаев превышая 3000 мл, что ставит под сомнение мнение ряда исследователей об оправданности данной операции [15–17]. В данном исследовании показано, что глубина инвазии напрямую коррелирует с частотой ГЭ.
Заключение
Проанализированные данные позволяют разработать наиболее оптимальную тактику в отношении предикции ВП, а также ведения и хирургической тактики родоразрешения беременных с данным осложнением, однако необходимо дальнейшее изучение проблемы для снижения объема кровопотери и улучшения исходов при работе с наиболее тяжелыми случаями ВП.



