Гиперпластические процессы эндо- и миометрия остаются одной из актуальной проблем гинекологии. Данные заболевания, как правило, развиваются на фоне повышенной секреции гонадотропинов,
гиперэстрогении и дефицита прогестерона, поэтому нельзя исключить общность их генеза.
Гиперплазия эндометрия (ГЭ) относится к мультифакторным заболеваниям, развивающимся в результате комплексного взаимодействия генов, гормонов, факторов роста, цитокинов в совокупности с неблагоприятными факторами окружающей среды [3].
В большинстве случаев развитие ГЭ связано c наличием гормональных нарушений [4]. ГЭ формируется в условиях гиперэстрогении и дефицита прогестерона. Известно, что подобные условия возникают при ановуляции (СПКЯ, НОЭС, гормонально-активных опухолях яичников) [9]. Многочисленные исследования показали, что эстрогены в большинстве случаев необходимы для возникновения гиперпластических процессов эндометрия, а также для инициации и поддержания роста злокачественных опухолей эндометрия. По отношению к ГЭ и раку эндометрия в литературе обсуждается в основном пролиферативный эффект эстрогенов [1]. Вместе с тем доказан и прямой генотоксический эффект метаболитов эстрогенов [2].
Биологический эффект эстрогенов реализуется через их взаимодействие с эстрогеновыми рецепторами, которые в свою очередь активируют гены-мишени во многих тканях [7].
В ряде случаев удалось установить, что длительная гиперсекреция эстрогенов ассоциирована с наличием доброкачественных и злокачественных процессов в матке, таких как фибромиома матки, гиперплазия и рак эндометрия [5]. Однако по другим данным, эти же патологические процессы могут возникать и без гиперэстрогенемии [5, 8].
Лечение женщин с гиперпластическими процессами эндо- и миометрия может быть хирургическим и консервативным. Актуальным направлением в лечении миомы матки является эндоваскулярное вмешательство – эмболизация маточных артерий (ЭМА), являющаяся альтернативным малоинвазивным органосохраняющим методом хирургического лечения данной патологии.
Целью данного исследования явилось изучение гормонального фона и рецепторного статуса у пациенток пременопаузального возраста с миомой матки в сочетании с гиперплазией эндометрия в постэмболизационном периоде.
Материал и методы исследования
За период с 2006 по 2008 г. на базе гинекологического отделения Московской городской клинической больницы № 1 им. Н.И. Пирогова проведено комплексное клинико-лабораторное обследование и лечение (ЭМА) 81 больной пременопаузального возраста с миомой матки и сопутствующей ГЭ.
Критерием отбора в исследование являлось наличие у пациенток гистологически верифицированной ГЭ без атипии.
Из исследования исключались пациентки с атипической гиперплазией, полипами эндометрия и раком тела матки; опухолями яичников и молочных желез; злокачественными процессами в шейке матки; острыми воспалительными заболеваниями органов малого таза; тяжелой соматической патологией.
В зависимости от тактики ведения больные миомой матки в сочетании с ГЭ были разделены на две группы: I группу составили 39 пациенток, которым с целью противорецидивного лечения ГЭ назначали гормональную терапию (дидрогестерон); во II группу были включены 42 больные, у которых лечение ГЭ после ЭМА не проводили в связи с наличием у них противопоказаний к гормонотерапии (отягощенный соматический статус), либо отказом больных от приема гормональных препаратов. Группу контроля составили 20 больных миомой матки без патологии эндометрия, которым планировалось оперативное лечение.
Средний возраст пациенток I группы составил 46,4±1,4 года, II группы – 46,9±2,0 года, группы
контроля – 47,4±1,6 года.
Исследование гормонального профиля проводили хемилюминесцентным методом на микрочастицах с использованием аппарата ARCHITECT 2000 SR, фирмы ABBOTT (Германия) до ЭМА, через 3 и 6 мес после проведения процедуры.
Гистероскопию выполняли до раздельного диагностического вмешательства с помощью эндоскопического оборудования фирмы «Karl Storz» (Германия) по стандартной методике.
Патоморфологическое исследование эндометрия проводили до ЭМА, через 3 и 6 мес после
процедуры. Путем кюретажа или пайпель-биопсии получали ткань эндометрия, которую фиксировали в 10% растворе нейтрального формалина. После заливки в парафин готовили срезы толщиной 5–6 мкм и окрашивали их гематоксилином и эозином.
Все эндоваскулярные и хирургические исследования и вмешательства проводили на современных ангиокардиографических аппаратах Philips Integris Allura 9000 (Philips, Голландия) и Oec-9800 (General Electric, США), с функцией цифровой субтракционной ангиографии с возможностью смещения субтракционной маски, пульсовой рентгеноскопией до 25 кадров в секунду. Для инъекции контрастного вещества применяли автоматические шприцы-инъекторы Angiomat 6000 (Liebel-Flarsheim, США) и Medrad PPD (Medrad, США), оснащенные функцией синхронизации с ангиографическим аппаратом. В ходе эндоваскулярного вмешательства проводили мониторирование состояния пациенток при помощи кардиомониторов Marqutte DASH 2000 (General Electric, США). Артериографию органов малого таза проводили непосредственно перед ЭМА. Эндоваскулярные диагностические и лечебные вмешательства выполняли сотрудники отделения Федерального Центра рентгенохирургических методов диагностики и лечения ГКБ № 1 им. Н.И. Пирогова и сотрудники
ПНИЛ внутрисердечных и контрастных методов рентгенологических исследований РГМУ. Специальные методы исследования проведены на базе лаборатории клинической иммунологии ФГБУ НЦ АГиП им. академика В.И. Кулакова Минздравсоцразвития России. Исследование рецепторов стероидных гормонов в эндометрии проводили до лечения и через 6 мес после ЭМА. Молекулярно-биологическое исследование экспрессии генов рецепторов к прогестерону (РП) и эстрадиолу (РЭ) включало выделение тотальной РНК, постановку обратной транскрипции, анализ экспрессии изучаемых генов
путем определения концентрации кДНК на приборе Real-time PCR («RotorGene 6000», фирма «Corbett Research») с использованием интеркалирующего красителя SYBR-green I (ЗАО «Синтол», Россия) методом относительного количественного анализа (ΔΔС ). Уровень продукции мРНК каждого фактора в пролиферативном эндометрии принимался за единицу.
Результаты исследования и обсуждение
В результате исследования гормонального статуса у больных миомой матки было выявлено, что средний уровень гонадотропных гормонов сыворотки крови у пациенток исследуемых групп несколько превышал нормативные значения. При этом средняя концентрация гормонов гипофиза достоверно не отличалась у пациенток с изолированным заболеванием миометрия и при сочетанной патологии эндои миометрия. При изучении концентрации половых гормонов было выявлено, что средняя концентрация эстрадиола у исследуемых пациенток соответствовала референсным значениям и не имела статистически достоверной разницы. При изучении концентрации прогестерона было выявлено, что содержание гормона в группе контроля достоверно превышало аналогичный показатель в I и II группах в 3,79 и 3,28 раза соответственно (р<0,05) (табл. 1).
При гистологическом исследовании соскобов из полости матки пациенток основных групп у 26 (66,6%) женщин I группы и у 24 (57,1%) II группы была выявлена простая типичная гиперплазия эндометрия (ПГЭ). Сложная гиперплазия (СГЭ) диагностирована у 13 (33,3%) больных I группы и у 18 (42,9%) II группы. В группе контроля в 13 (65%) наблюдениях выявлен эндометрий фазы пролиферации, в 7 (35%) – фазы секреции.
Таблица 1. Содержание гормонов в сыворотке крови до лечения, М±m.
При изучении рецепторного статуса выявлено многократное повышение экспрессии РЭ при ПГЭ
и СГЭ относительно уровня экспрессии данного гена в нормальном эндометрии фазы пролиферации (p<0,05). Аналогичные данные получены при молекулярно-биологическом исследовании экспрессии РП в образцах слизистой оболочки матки больных исследуемых групп – повышение количества мРНК РП при ПГЭ и СГЭ по сравнению с пролиферативным эндометрием (p<0,05, рис. 1). Соотношение РЭ/РП составило в пролиферативном эндометрии 1,38, при ПГЭ – 1,89, при СГЭ – 1,87. Повышение экспрессии генов рецепторов стероидных гормонов при ГЭ, по-видимому, является следствием увеличения объема ткани, а, следовательно, и клеток, экспрессирующих данные рецепторы.
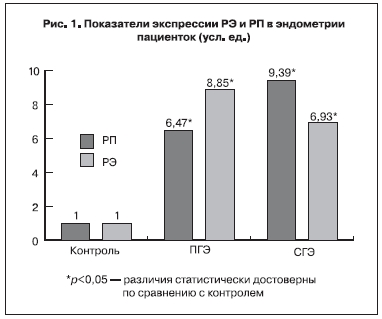
При исследовании гормонального профиля пациенток I и II групп через 3 и 6 мес после ЭМА были
выявлены колебания основных его показателей в пределах референсных значений (табл. 2, 3). При
изучении концентрации гонадотропных гормонов у больных I группы максимальные изменения их
содержания зарегистрированы через 6 мес после ЭМА. При этом концентрация ФСГ уменьшилась
на 12,79%. Колебания уровня ЛГ были более выражены и составили 29,13%. При исследовании содержания половых гормонов: концентрация эстрадиола через 6 мес была ниже таковой до ЭМА и через 3 мес после ЭМА на 16,65 и 12,02% соответственно (р<0,05). В группе пациенток, которым после ЭМА назначали гормональную терапию ГЭ, выявлено закономерное повышение среднего значения прогестерона в сыворотке крови через 3 мес в 5,13 раза и 14,85 раза через 6 мес по сравнению с исходным уровнем (р<0,05, табл. 2). У пациенток II группы концентрация ФСГ через 3 мес уменьшилась на 26,42%, а через 6 мес превысила показатель до ЭМА на 17,5%. Колебания концентрации ЛГ были менее выражены. Концентрация эстрадиола через 3 мес была меньше таковой до ЭМА на 37,87%, а через 6 мес. – на 27,64% (р<0,05). У пациенток II группы уровень сывороточного прогестерона на протяжении всего периода наблюдения оставался ниже возрастной нормы и существенно не изменялся на протяжении всего исследования (табл. 3).
Таблица 2. Динамика показателей гормонального профиля пациенток I группы, М±m.
Таблица 3. Динамика показателей гормонального профиля пациенток II группы, М±m
При исследовании рецепторного статуса эндометрия больных после ЭМА выявлено достоверное (р<0,05) снижение уровней экспрессии генов РЭ и РП во всех исследуемых образцах слизистой
оболочки матки по сравнению с аналогичными значениями при ГЭ (рис. 2, 3). Достоверных различий между показателями, полученными нами в образцах больных I и II групп через 6 мес после ЭМА, не выявлено.
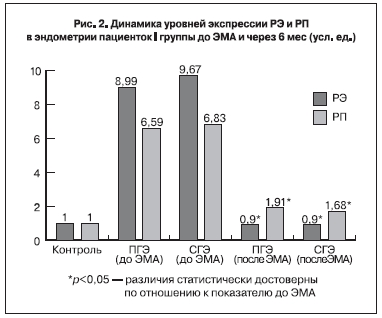
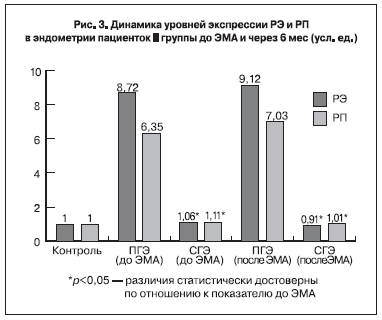
Следует отметить, что в I группе показатель РЭ/РП в образцах эндометрия пациенток с ПГЭ, выявленной до ЭМА, был 0,65, при СГЭ – 0,74. Во II группе соотношение уровней мРНК РЭ/РП составило 1,33 и 1,54 соответственно у больных с простой и сложной типичной гиперплазией, выявленной до ЭМА.
Согласно результатам гистологического исследования, выполненного через 6 мес после ЭМА,
в I группе больных морфологическая картина полученного материала у 2 (5,1%) пациенток соответствовала простой гиперплазии без атипии, у 5 (12,8%) – установлена атрофия эндометрия, у
31 (79,5%) – пролиферативные изменения слизистой оболочки матки. Пациенткам I группы с ГЭ
были назначены агонисты гонадотропных релизинг-гормонов.
Во II группе у 11 (26,2%) пациенток была установлена ГЭ, в остальных случаях – эндометрий фазы пролиферации. Учитывая отказ от гормонотерапии и незаинтересованность в менструальной функции, пациенткам II группы с ГЭ была выполнена аблация эндометрия.
Учитывая результаты морфологического исследования эндометрия у пациенток II группы, следует сделать вывод об уменьшении пролиферативной активности эндометрия, что является следствием снижения васкуляризации эндометриальной ткани (внутриорганного кровотока) после процедуры ЭМА у данной категории пациенток.
Традиционно эстрогены рассматриваются как главные стимуляторы роста. Эстрадиол стимулирует синтез рецепторов к эстрогенам и прогестерону. В свою очередь прогестины ускоряют оборот ранее синтезированных рецепторов, результатом чего является ингибирование эстроген-индуцированного синтеза стероидных рецепторов путем прерывания транскрипции эстроген-регулируемых генов. Таким образом, прогестерон способен оказывать двойное действие: во-первых, блокируя действие эстрогенов, угнетая экспрессию их рецепторов, во-вторых, оказывая свой эффект непосредственно через свои рецепторы.
По результатам проведенного исследования можно сделать вывод о возможном влиянии ЭМА на нормализацию гормонального гомеостаза у пациенток с сочетанной патологией эндо- и миометрия в пременопаузальном периоде: снижение уровня эстрадиола, тенденция к повышению уровня прогестерона в сыворотке крови, что оказывает положительное влияние на течение ГЭ.
Дидрогестерон, являясь аналогом натурального прогестерона, снижает уровни мРНК РЭ и РП в эндометрии, способствуя преобладанию экспрессии РП, увеличивает чувствительность слизистой оболочки матки к прогестерону. Таким образом, использование гормонотерапии в постэмболизационном периоде у пациенток с сочетанной патологией эндо- и миометрия в пременопаузе позволяет увеличить эффективность ЭМА у данной категории больных.



