Расширение терапевтических возможностей вспомогательных репродуктивных технологий (ВРТ) и использование этих методов как универсальных практически при всех формах бесплодия обусловило необходимость дифференцированного подбора протоколов стимуляции суперовуляции для отдельных групп пациенток. Этому способствовало наличие препаратов с различным составом гормонов: рекомбинантного фолликулостимулирующего гормона (рФСГ), рекомбинантного лютеинизирующего гормона (рЛГ), рФСГ+рЛГ, человеческого менопаузального гонадотропина (чМГ), содержащих или ФСГ, или ЛГ, либо оба гонадотропина [1, 2]. Задача настоящего периода заключается в выборе адекватного метода гонадотропной стимуляции с учетом состояния репродуктивной системы пациентки, для того чтобы добиться оптимальных результатов лечения и избежать осложнений [1, 3, 4].
Препараты чМГ содержат ФСГ и ЛГ. Наличие ФСГ в препаратах чМГ играет решающую роль в формировании когорты развивающихся фолликулов и отборе лидирующих фолликулов. В 90-х годах была разработана генно-инженерная технология получения ФСГ in vitro. Были получены высокоочищенные рекомбинантные гонадотропины, имеющие высокую биохимическую чистоту и удельную биологическую активность. Это препараты пурегон (фоллитропин-бета, «Органон», Голландия), гонал-ф (фоллитропин-альфа, «Сероно», Швейцария). В литературе широко обсуждаются преимущества рекомбинантных перед мочевыми гонадотропинами [5–7].
Антагонисты гонадотропин-рилизинг гормона (антГнРГ) стали использоваться в протоколах стимуляции функции яичников с конца 90-х годов для подавления преждевременного роста ЛГ [4, 8, 9].
Снижение частоты наступления беременности в программах ЭКО нередко связано с преждевременной лютеинизацией, отражением которой является повышение концентрации прогестерона (Р) в сыворотке крови в день введения триггера овуляции – человеческого хорионического гонадотропина (чХГ). Впервые феномен преждевременной лютеинизации был описан в начале 90-х годов XX века [10]. Позднее в литературе появились первые сообщения об обратной зависимости между концентрацией Р в день чХГ и частотой наступления беременности в программе ЭКО, что послужило толчком к более детальному изучению этого феномена [11, 12]. В работе Bosch в 2010 г. были проанализированы 4000 циклов стимуляции и определено пороговое значение Р, которое составило 1,5 нг/мл. По данным различных авторов, частота преждевременной лютеинизации в циклах с антГнРГ варьирует от 13 до 71% [13]. Наблюдения Papanikolau и соавт. свидетельствуют, что даже небольшой подъем концентрации Р выше этого пограничного уровня оказывает крайне неблагоприятное влияние на потенциал имплантации эмбрионов хорошего качества при их переносе в полость матки, что неминуемо сказывается на частоте наступления беременности [14]. В то же время другие авторы не находят взаимосвязи между преждевременной лютеинизацией и вероятностью наступления беременности [15].
Одним из факторов, оказывающих влияние на качество ооцитов, является пороговая концентрация ЛГ. Уровень гормона ниже 1,0 МЕ/л, как было показано, оказывает негативное влияние на качество ооцитов и исход беременности [16]. Низкая концентрация ЛГ может привести к снижению выработки предшественников андрогенов, в результате сокращается биосинтез эстрадиола (Е2) в яичниках [16–18]. Это подтверждается исследованиями у женщин с гипогонадотропным гипогонадизмом стимулируемых рФСГ, которые демонстрировали очень низкую концентрацию преовуляторного Е2 и имели соответственно очень низкую частоту клинических беременностей [19].
В то же время было высказано мнение, что применение в циклах стимуляции чМГ, который включает в себя компонент ЛГ, может снижать частоту наступления беременности [20]. Другое недавнее исследование показало, что добавление эндогенного ЛГ сокращает количество мелких фолликулов и увеличивает число более крупных. Рост небольшого количества более крупных фолликулов способствует снижению частоты развития синдрома гиперстимуляции яичников [20]. Следует отметить, что при использовании чМГ получают, как правило, меньшее число ооцитов по сравнению с их количеством в циклах с рФСГ.
Таким образом, несмотря на длительное использование в клинической практике гонадотропной стимуляции яичников, возникает ряд вопросов по поводу особенностей фолликуло- и стероидогенеза в яичниках при назначении различных групп гонадотропинов, что обусловило актуальность проведенного исследования.
Целью данного исследования стала оценка гормонального профиля при использовании рФСГ и чМГ в циклах с антГнРГ и его влияния на частоту наступления беременности.
Материал и методы исследования
В исследование были включены 190 пациенток, которые были рандомизированы на группы: 90 женщинам индукция суперовуляции проводилась чМГ, 100 женщинам – рФСГ.
Критерии включения: возраст ≤35 лет; базальная концентрация ФСГ <12 МЕ/л; регулярный ритм менструаций (21–35 дней); индекс массы тела от 18 до 29 (включительно); не более 2 безуспешных попыток ЭКО в анамнезе; стимуляция в протоколе с антГнРГ в циклах ЭКО или ЭКО+ИКСИ; наличие информированного согласия на участие в исследовании.
Критерии исключения: синдром поликистозных яичников; наружный генитальный эндометриоз III–IV стадии; аденомиоз III степени; интерстициальная или субсерозная миома матки размером более 4 см; гидросальпинкс и/или тубоовариальное образование (с одной или обеих сторон) по данным гистеросальпингографии и/или ультразвукового исследования (УЗИ); пороки развития внутренних половых органов, включая состояния после их хирургической коррекции; врожденные и приобретенные деформации полости матки, при которых невозможна имплантация эмбрионов или вынашивание беременности; патозооспермия III–IV степени; прием циклической гормональной терапии, комбинированных оральных контрацептивов или гестагенов в цикле, предшествующем циклу стимуляции; проведение переноса криоконсервированных/размороженных эмбрионов в цикле, предшествующем циклу стимуляции.
Всем пациенткам поводилось комплексное клинико-лабораторное обследование перед программой ВРТ. Критерием для начала стимуляции служил уровень Е2 не ниже 100 пмоль/л, отсутствие кист в яичниках по результатам УЗИ. Контролируемая овариальная стимуляция (КОС) проводилась по стандартному протоколу с антГнРГ, пациенты получали рФСГ или чМГ. В ходе стимуляции производился ультразвуковой мониторинг, регистрировавший рост фолликулов, а также гормональный мониторинг, контролирующий гормональный фон женщины в период ключевых этапов стимуляции. У всех пациенток мы оценивали уровень ЛГ, ФСГ, Е2, Р на 2-й день менструального цикла, перед началом КОС. Кроме того определяли уровень ЛГ, Е2, Р на 6-й день стимуляции, а также в день введения триггера овуляции (чХГ) – при наличии трех или более фолликулов диаметром ≥18 мм и/или уровня Е2 1000 пмоль/л и более (примерно 278 пг/мл) в расчете на один фолликул.
О преждевременной лютеинизации судили по повышению уровня Р на день введения триггера овуляции выше 4,7 нмоль/л (1,5 нг/мг; в соответствии 1 нг/мг х 3,18=1 нмоль/л).
Поддержка лютеиновой фазы и посттрансферного периода проводилась препаратом микронизированного прогестерона (утрожестан) 600 мг вагинально со дня трансвагинальной пункции яичников до определения результата во всех группах исследования.
Для автоматизации статистической обработки использовали статистический пакет Statistica 10 (StatSoft Inc., США). В работе были применены следующие методы обработки данных: критерий c2 для таблиц сопряженности признаков 2*2 и 2*4 (для сравнения частот встречаемости признаков в анализируемых группах), в том числе с использованием поправки Бонферрони (для большей достоверности при повторном анализе части уже проанализированных данных). Сравнительный анализ переменных проводили с помощью непараметрического критерия Вилкоксона–Манна–Уитни для несвязанных совокупностей (так как провести проверку на нормальность не представлялось возможным из-за малого объема выборок; выбор данного критерия обусловлен его наибольшей мощностью для рассматриваемых групп); сравнительный анализ связанных переменных проводили с помощью критерия Вилкоксона связанных пар (Т-критерий Вилкоксона); критерий знаков. Статистически значимыми считали различия при р<0,05.
Протокол исследования был одобрен независимым комитетом по этике.
Результаты исследования
Средний возраст пациенток составил 31,6±3,8 года (от 24 до 39 лет).
Была проведена оценка параметров овариального резерва.
Проведенное исследование гормональных маркеров овариального резерва показало, что у 144 75,7%) женщин он соответствовал возрастной норме, у 46 женщин (24,2%) – отмечена некоторая тенденция к снижению овариального резерва. Уровень ФСГ соответствовал 7,09±3,5 МЕ/л, антимюллерового гормона – 3,06±2,7 нг/мл. Объем яичников при проведении УЗИ на 3 день менструального цикла колебался от 5,3 см3 до 12,0 см3 (в среднем составил 8,6 см3), число антральных фолликулов варьировало от 4,6 до 8,8 (6,7±2,1), что соответствует нормативным значениям.
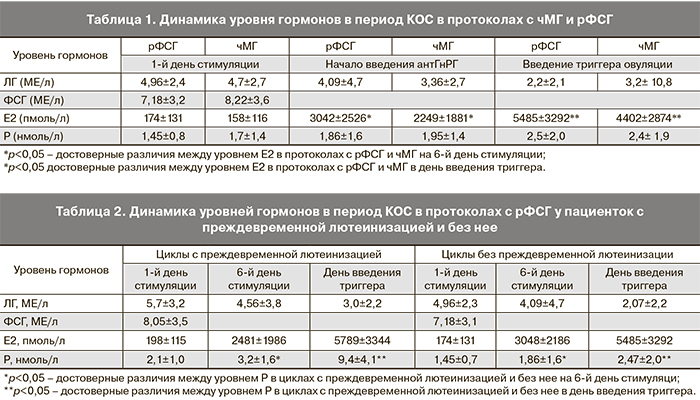
Далее был проанализирован уровень ФСГ, ЛГ, Е2, Р до начала стимуляции, ЛГ, Е2, Р – на 6-й день стимуляции (в день назначения антГнРГ), а также в день введения триггера овуляции (чХГ) (табл. 1) в протоколах с чМГ и рФСГ.
Как видно из данных таблицы, имелись различия в преовуляторном уровне Е2 в день введения триггера и на 6-й день стимуляции – в группе с рФСГ указанные параметры оказались выше, чем в группе с чМГ. Уровень других гормонов в указанных точках достоверно не различался в обеих группах, в том числе преовуляторный уровень Р.
В то же время в обеих группах имелись пациентки, у которых уровень Р в день введения триггера превышал 4,7 нмоль/л, то есть имела место преждевременная лютеинизация. В нашей работе преждевременная лютеинизация в циклах с чМГ отмечена в 7 случаях (7,7%), а в программах с использованием рФСГ – в 6 (6%) (p>0,05).
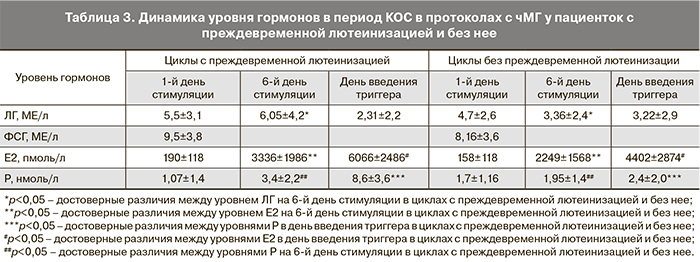
 Далее мы сочли целесообразным дифференцированно рассмотреть гормональные параметры в динамике КОС у пациенток с преждевременной лютеинизацией и без нее при использовании различных индукторов (табл. 2, 3).
Далее мы сочли целесообразным дифференцированно рассмотреть гормональные параметры в динамике КОС у пациенток с преждевременной лютеинизацией и без нее при использовании различных индукторов (табл. 2, 3).
Как видно из данных табл. 2, имели место достоверные различия между уровнями Рв циклах стимуляции рФСГ с преждевременной лютеинизацией и без нее при отсутствии достоверных различий в уровнях ЛГ и Е2. Таким образом, начиная с 6-го дня стимуляции, в циклах с преждевременной лютеинизацией синтезировались более высокие уровни Р, при этом нормальные уровни ЛГ свидетельствовали об адекватном действии антГнРГ.
Анализ гормональных показателей индуцированного чМГ цикла показал, что достоверные различия имели место в уровнях Р и Е2, начиная с 6-го дня стимуляции – в обеих точках средние значения указанных стероидных гормонов были выше при преждевременной лютеинизации. Кроме того, особенностью чМГ стимулированного цикла был достоверно более высокий уровень ЛГ на 6-й день стимуляции в группах с лютеинизацией. При этом дальнейшего повышения концентрации ЛГ не происходило, и в день введения триггера уровень ЛГ оказался низким, что свидетельствовало об адекватном действии антГнРГ.
Таким образом, повышение уровня Р в день введения триггера овуляции (преждевременная лютеинизация), как при использовании рФСГ, так и при применении чМГ, не сопровождалось «паразитарными» пиками ЛГ, что свидетельствовало об адекватной десенситизации гипоталамо-гипофизарной системы под действием антГнРГ. В то же время преждевременная лютеинизация имела место на фоне более высоких преовуляторных уровней Е2, хотя в протоколах с рФСГ эта разница была не достоверна. Тем не менее, эти наблюдения позволяют предположить связь преждевременной лютеинизации с более интенсивным стероидогенезом в яичниках, что могло быть вызвано более «жесткой» гонадотропной стимуляцией.
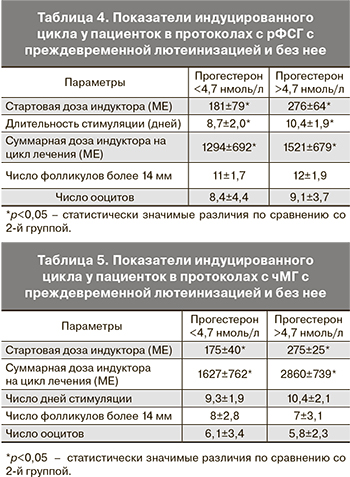
В связи с этим предположением мы проанализировали параметры циклов с преждевременной лютеинизацией и без нее, индуцированных рФСГ и чМГ (табл. 4 и 5). Было показано, что в обеих группах наличие этого феномена имело место при использовании высоких стартовых и курсовых доз гонадотропина и более длительной стимуляции.
При повышенных преовуляторных значениях Р практически в 2 раза выше была стартовая и курсовая доза гонадотропина при использовании как рФСГ, так и чМГ (р<0,05), тогда как число преовуляторных фолликулов и полученных ооцитов достоверно не различалось (8±2,8 и 7±3,1, 6,1±3,4 и 5,8±2,3 соответственно, р>0,05).
Следует отметить, что число растущих фолликулов в группе с рФСГ в среднем было выше, чем при стимуляции мочевыми гонадотропинами: при использовании чМГ – 8,2±3,5, а в группе с использованием рФСГ – 10,5±4,4 (p<0,05). Среднее число пунктированных фолликулов в группе с чМГ составило 6,3±2,9, а в группе с рФСГ – 8,5±4,4 (p<0,05). Однако в группе с рФСГ визуализировались фолликулы разного диаметра, несмотря на их численное преимущество по сравнению с чМГ-протоколами, где отмечался более синхронный рост фолликулов, а также преобладание фолликулов большего диаметра в преовуляторный период: в группе с рФСГ средний диаметр преовуляторных фолликулов составил 16,6±2,4 мм, в группе с чМГ – 17,5±4,1 мм (p>0,05). Доля зрелых ооцитов (MII), полученных в циклах с чМГ, составила 85%, в циклах с рФСГ – 81% (р<0,05). Частота оплодотворения (2PN) в циклах с чМГ составила 78,91%, в циклах с рФСГ – 78,61% (р>0,05); доля дробящихся эмбрионов в циклах с чМГ – 99,4%, в циклах с рФСГ – 96,8% (р>0,05); частота образования бластоцист при применении чМГ составила 48,2%, в циклах с рФСГ стадии бластоцисты достигло 53,6% эмбрионов (р>0,05). Среднее количество эмбрионов на перенос составило в группе с чМГ 1,83±0,17, в группе с рФСГ – 1,88±0,12 (р>0,05). Доля эмбрионов хорошего качества (Top quality) составила 33,5% в группе с чМГ и 32,3% в группе с рФСГ (p>0,05). В 21,9% от всех произведенных циклов с чМГ была проведена криоконсервация эмбрионов, всего в данной группе было заморожено 17,4% полученных эмбрионов. В группе с рФСГ криоконсервировано 25,3% эмбрионов в 36,9% из произведенных циклов ЭКО/ИКСИ (р>0,05). Частота имплантации в циклах с чМГ составила 17,2%, в циклах с рФСГ – 20,0% (р>0,05). Частота наступления клинической беременности в группе с чМГ составила 36%, в группе с рФСГ – 37% (p>0,05). Следует отметить, что параметры оо- и эмбриогенеза не отличались в группах с выявленной лютеинизацией и нормальными показателями преовуляторного Р. В то же время при выявленной преждевременной лютеинизации в группе с чМГ беременность наступила только в одном случае, в группе с использованием рФСГ при наличии преждевременной лютеинизации беременностей не было.
Обсуждение
В последние годы появилась серия работ, изучающих гормональные параметры индуцированного цикла в контексте использования гонадотропинов различных групп – чМГ и рФСГ. В основном эти работы касаются динамики ЛГ в течение индуцированного цикла, роли ЛГ в процессах фолликуло-, оо- и эмбриогенеза, а также значения повышенных преовуляторных концентраций Р на исходы лечения. По существу, эти вопросы связаны между собой и в конечном итоге призваны решить основную клиническую проблему: какой препарат выбрать для стимуляции в каждом конкретном случае.
Следует еще раз подчеркнуть сложность гонадотропной регуляции стероидогенеза в яичниках и неоднозначность роли ЛГ. Более детальный анализ [21] свидетельствует о необходимости четкого разграничения его действия на клетки теки и гранулезы фолликула.
С одной стороны, ЛГ взаимодействует с рецепторами клеток теки, стимулируя ферментный комплекс цитохрома Р450 – CYP17, превращающий Р в 17-гидроксипрогестерон и андрогены. Этот путь осуществляется через ферменты 17-гидроксилазу и 17-20-лиазу и приводит к снижению уровня Р. Но ЛГ действует также на 3β-гидроксистероид дегидрогеназу типа ΙΙ, которая превращает прегнандиол в Р, при этом уровень Р может повышаться. Такое двоякое действие ЛГ на продукцию Р тека клетками обусловливает то, что именно активность указанных ферментов определяет конечный уровень Р.
Приведенные механизмы регуляции концентрации Р характерны для ранней и средней фолликулярной фазы. На последних стадиях фолликулогенеза ФСГ индуцирует появление рецепторов к ЛГ на клетках гранулезы и ЛГ, действуя на эти рецепторы, стимулирует совместно с ФСГ продукцию стероидов – Е2 и Р. При этом показано, что ЛГ стимулирует продукцию гормонов сильнее, чем ФСГ [22].
Изучение динамики концентрации ЛГ в течение индуцированного цикла было спровоцировано работами, указывающими на неблагоприятное влияние повышенной концентрации Р в преовуляторный период на исход лечебного цикла. Kolibianakis и соавт. (2004) сформулировали положение о том, что если пролонгировать фолликулярную фазу на 2 дня после появления ≥3 фолликулов размерами ≥17 мм, что регистрируется с помощью эхографии в циклах стимуляции ФСГ/антГнРГ, то возможно последующее снижение частоты наступления беременности в связи с большим воздействием повышенных доз Р на эндометрий. Было показано, что при значениях Р в преовуляторный период >4 нмоль/л частота наступления беременности значительно ниже (16 и 29%) [23]. В исследовании Bosch и соавт. (2010) при анализе более 4000 циклов продемонстрировано отрицательное влияние повышенных концентраций Р на частоту наступления беременности [24]. Другие специалисты также зарегистрировали этот факт, причем плохой результат лечения при повышенных преовуляторных значениях Р связали с нарушением экспрессии генов в эндометрии, а не с качеством яйцеклеток, так как рецепторов Р на яйцеклетках нет [25, 26]. Большинство авторов критическим считают преовуляторный уровень Р=4 нмоль/л, но каков источник повышенной концентрации Р при десенситизации гипоталамо-гипофизарной системы аналогами ГнРГ и отсутствии эндогенных выбросов ЛГ? Считается, что это связано с высокими дозами и длительной стимуляцией ФСГ, когда на клетках гранулезы фолликула формируются рецепторы к ЛГ, и оба гонадотропина стимулируют выработку Р. Естественно, что этот процесс ассоциирован с большим числом полученных ооцитов и более высокими преовуляторными значениями Е2 [24, 27].
Какова же роль экзогенно вводимого ЛГ в формировании повышенных значений Р и последующих неблагоприятных эффектов?
В систематическом обзоре, опубликованном в журнале Human Reprodaction в 2012 г., J.N. Hugues провел анализ существующих исследований, сравнивающих уровень Р в преовуляторный период в зависимости от используемых для стимуляции препаратов [28]. В подавляющем большинстве исследований не было отмечено разницы между концентрацией Р. Тем не менее, в циклах, где препараты с ЛГ-активностью вводили с начала стимуляции зарегистрировано преовуляторное снижение уровня Р; напротив, в тех случаях, когда ЛГ-содержащие препараты применяли с середины фолликулярной фазы – его повышение.
Автор считает, что преждевременно делать однозначные выводы, так как пациентки были не сопоставимы по параметрам овариального резерва и характеру ответа на гонадотропную стимуляцию. Кроме того, использовали различные препараты и в разных дозах: чМГ, содержащий значительное количество ХГ, рекомбинантный ЛГ и даже ХГ.
Указанные факты требуют дополнительных исследований и являются весомой предпосылкой для их проведения.
Проведенное исследование в основном подтвердило предположения, высказываемые специалистами. Действительно, высокий преовуляторный уровень Р ассоциирован с плохими результатами лечения, но не было обнаружено достоверной разницы между циклами, где использовали чМГ и рФСГ. Возможно, не сам препарат, а степень гиперстимуляции яичников, вызываемая тем или иным гонадотропином, является решающим фактором, приводящим к повышению преовуляторных значений Р.
Заключение
Таким образом, проведенное исследование продемонстрировало различия в динамике фолликуло- и стероидогенеза индуцированного цикла в зависимости от используемого индуктора овуляции. Особенностями фолликулогенеза цикла, индуцированного препаратом чМГ, было меньшее число растущих фолликулов и, соответственно, более низкий уровень суммарного Е2 в сыворотке крови. В то же время при использовании препаратов чМГ, в отличие от ФСГ-содержащих препаратов, преобладали фолликулы большего диаметра. При этом параметры оо- и эмбриогенеза в обеих группах не различались.
Как показали наши результаты, при нормальных показателях овариального резерва частота наступления беременности не зависела от используемого индуктора. Высокий преовуляторный уровень Р был зарегистрированы в обеих группах больных с одинаковой частотой, что сопровождалось низкой эффективностью лечения. Повышение уровня Р на конечных этапах стимуляции в циклах КОС с антагонистом ГнРГ не было связано с преждевременным пиком ЛГ, а зависело от степени гиперстимуляции яичников. При этом преждевременная лютеинизация не оказывала негативного влияния на качество ооцитов и эмбрионов.
Указанные факты делают необходимым определение преовуляторных значений Р в индуцированных циклах для решения вопроса о целесообразности переноса эмбрионов при его высоких значениях.



