В России последние годы характеризуются ростом заболеваемости злокачественными новообразованиями шейки матки, частота которых за последнее десятилетие составила 3,1% [1]. При этом в старших возрастных группах наблюдается некоторая стабилизация уровня заболеваемости рака шейки матки (РШМ), тогда как число женщин c цервикальными неоплазиями в возрасте от 20 до 40 лет растет [2]. Неуклонный рост числа женщин со злокачественными новообразованиями шейки матки и тенденция к омоложению болезни, несомненно, свидетельствуют об актуальности поиска, разработки и внедрения новых подходов к профилактике и лечению РШМ. В успешной реализации этих задач важная роль отводится этиологическому фактору цервикального канцерогенеза – вирусу папилломы человека (ВПЧ), ДНК которого обнаруживается в 99,7% случаев РШМ [3].
Динамика вирусной инфекции может заключаться либо в ее регрессии, то есть элиминации вирусного пула, либо, наоборот, при длительной персистенции ВПЧ – прогрессии клеточных изменений в цервикальные интраэпителиальные неоплазии (CIN) I–II–III и микроинвазивный рак. Длительность этих процессов составляет от 2 до 10 лет [4], при этом вероятность их развития у женщин с персистирующей формой ВПЧ высокого онкологического риска по сравнению с не зараженной ВПЧ популяцией в среднем возрастает более чем в 300 раз [5]. Если сегодня не предпринимать профилактических и лечебных мер, то каждый случай плоскоклеточного рака через несколько лет будет ассоциирован с ВПЧ [6], а после 2050 г. ежегодно в мире РШМ будет заболевать 1 млн женщин [7].
В последние годы отмечается увеличение случаев стремительного развития РШМ в течение двух-трех лет после инфицирования ВПЧ у 15–28% женщин. При отсутствии же ВПЧ прогрессирование заболевания в короткие сроки развивается лишь у 1–3% женщин [8]. Неутешительный прогноз увеличения числа женщин с онкопатологией шейки матки в ближайшем будущем с большей убедительностью показывают первостепенное значение своевременного и эффективного лечения предопухолевых и начальных опухолевых поражений цервикального эпителия, что предотвратит развитие злокачественного процесса и прогрессирование заболевания до инвазивных форм.
Эти методы лечения согласно Я.В. Бохману (1989) можно условно разделить на два вида: деструктивные, то есть разрушающие патологическую ткань шейки матки (диатермокоагуляция, криодеструкция, лазерная вапоризация), и хирургические, удаляющие шейку матки в форме конуса (ножевая, лазерная, электро- и радиоволновая эксцизия). С появлением вирусной концепции цервикального канцерогенеза лечебные воздействия должны быть направлены и на геном ВПЧ. Такой подход к лечению ВПЧ-ассоциированной цервикальной патологии обусловлен недостаточной эффективностью монотерапии для элиминации ВПЧ, отсутствием «точечных» воздействий на геном вируса и неглубокой деструкцией [9].
Все эти причины ведут к сохранению ВПЧ в местах первичных поражений, зоне некроза, во внешне неизмененных тканях, прилежащих к краю резекции или деструкции [10]. Экспрессия персистирующей ДНК ВПЧ и реактивация вирусного генома обуславливают достаточно высокий риск развития в короткий срок после первичного лечения CIN I–II–III, прогрессирования процесса в преинвазивный или со временем – микроинвазивный рак (от 15 до 70%) [11].
 Таким образом, с учетом доказанной этиологической роли онкотропных типов ВПЧ в цервикальном канцерогенезе, увеличения числа заболевших женщин РШМ и омоложения болезни, участившихся случаев стремительного развития РШМ и рецидивов заболевания, назрела необходимость активного поиска новых патогенетически обоснованных лечебных воздействий на ВПЧ-ассоциированную патологию шейки матки. Эти методы лечения должны обладать одновременно противоопухолевым и противовирусным эффектом с сохранением анатомической и функциональной целостности органа, привести к более высоким показателям эрадикации ВПЧ и более низким – реактивации инфекции, полноценно реабилитировать женщину в медицинском и социальном аспектах.
Таким образом, с учетом доказанной этиологической роли онкотропных типов ВПЧ в цервикальном канцерогенезе, увеличения числа заболевших женщин РШМ и омоложения болезни, участившихся случаев стремительного развития РШМ и рецидивов заболевания, назрела необходимость активного поиска новых патогенетически обоснованных лечебных воздействий на ВПЧ-ассоциированную патологию шейки матки. Эти методы лечения должны обладать одновременно противоопухолевым и противовирусным эффектом с сохранением анатомической и функциональной целостности органа, привести к более высоким показателям эрадикации ВПЧ и более низким – реактивации инфекции, полноценно реабилитировать женщину в медицинском и социальном аспектах.
Поиск и решение этих задач стал возможным вследствие все большего применения в клинической онкологии новых достижений в области химии, биологии и квантовой физики. Среди них особое место занимает фотодинамическая терапия (ФДТ), основанная на способности ряда лекарственных препаратов – фотосенсибилизаторов (ФС) накапливаться в опухолевой ткани и при взаимодействии с излучением света определенной длины волны инициировать за счет серии фотофизических процессов повреждение и/или разрушение структур опухоли [12, 13].
Клиническое использование ФДТ в последние годы существенно расширяется благодаря несомненным достоинствам метода: малая инвазивность, селективность деструкции, минимальность повреждения здоровой ткани, возможность многократного применения за счет отсутствия резистентности к повторным циклам, отсутствие токсических и иммунодепрессивных реакций [14]. Перспективность ФДТ при патологии женских половых органов заключается в самостоятельном органосберегающем лечении.
На протяжении последних двух десятилетий отмечается возрастающий интерес гинекологов всего мира к возможностям ФДТ в лечении заболеваний женских половых органов. Метод нашел свое применение при эндометриозе, дисфункциональных маточных кровотечениях, фоновых заболеваниях шейки матки и вульвы [15, 16]. Возможности ФДТ в лечении CIN стали исследоваться с 90-х годов прошлого столетия. Первым препаратом, который был предложен в качестве ФС, был фотофрин [17]. В последующие годы проводились попытки оптимизации режимов ФДТ с различными группами ФС с целью достижения излечения CIN и сохранения анатомической и функциональной целостности органа.
ФДТ с использованием гексилового эфира аминолевулиновой кислоты (АЛК), световой дозы 100–140 Дж/см2 и длины волны лазерного излучения 633 нм позволил достичь регрессии CIN I–II–III в двух третях клинических наблюдений, из которых наибольшую часть составили случаи с минимальной степенью неоплазии [18]. Практически такие же результаты ФДТ с аналогичным ФС получены в другом исследовании, где полная регрессия СIN I зарегистрирована в 100% случаев, СIN II и СIN III – в 50 и 43% соответственно. Изучение фармакокинетики и селективности порфиринов позволило определить оптимальную концентрацию препарата – 10 ммоль/л и время экспозиции препарата – 300–540 мин [19]. ФДТ с 5-АЛК, время экспозиции которой на шейке матки составило 8 ч, привело к положительному результату лечения CIN I–II у 55% женщин при применении световой дозы излучения 100 Дж/см2 [20].
Более высокая частота полной регрессии CIN II–III (93%) достигнута в случаях, где ФДТ выполнена с препаратом фотогем (2 мг/кг, внутривенно) и доза света составила 100–150 Дж/см2. Лечебный эффект с сохранением основных характеристик шейки матки получен за счет селективного разрушения ткани [21].
Изучение оптимального соотношения дозы фотодитазина и светового излучения, путей его подведения и клинической эффективности ФДТ у женщин с фоновой и предопухолевой патологией шейки матки показало целесообразность использования препарата в виде геля (0,5%), плотности энергии в дозе 80–250 Дж/см2, длины волны лазерного излучения 662 нм. Такой методологический подход позволил достичь положительных результатов лечения у 88,9% женщин.
Сравнительный анализ эффективности ФДТ с фотолоном (0,5% раствор, внутривенно) в лечении CIN II–III с традиционными лечебными подходами продемонстрировал перспективность метода. Полная регрессия зарегистрирована у 65% женщин, при этом время экспозиции препарата составило 2,5 ч, длина волны – 662 нм, плотность мощности излучения – 100–300 Вт/см2 [22]. Более высокая частота клинической эффективности ФДТ установлена с фосканом в виде геля (0,1–0,2 мг/кг) в наблюдениях с аналогичными изменениями в цервикальном эпителии (78%). Длина волны лазерного облучения составила 652 нм, доза световой энергии – 10–20 Дж/см2 [23].
Таким образом, анализируя представленные данные литературы по применению ФДТ в гинекологии, можно заключить, что на сегодняшний день разработаны методики светового воздействия на CIN I–II–III без учета вирус-ассоциированного характера этих изменений. Актуальность поиска новых путей эффективных методов лечения ВПЧ-ассоциированной цервикальной патологии очевидна. Необходимо продолжить изучение многих вопросов, связанных с показаниями для ФДТ, выбором ФС, способами введения препаратов и путями подведения светового излучения к патологическому эпителию. Одним из основных направлений в решении данной проблемы является сохранение важнейшего фактора репродуктивного здоровья женского организма – структурно-функциональных характеристик шейки матки.
В отделении онкогинекологии МНИОИ им. П.А. Герцена разработан детализированный подход к выбору режимов фотодинамического воздействия в зависимости от выраженности и локализации ВПЧ-ассоциированных CIN II–III в качестве самостоятельного метода, что явно расширит возможности органосохраняющего лечения. При разработке методологических аспектов ФДТ с отечественными ФС (фотогем, фотосенс) преследовалась цель достижения за счет оптимизации режимов облучения не только излечения, но и противовирусного эффекта.
В основу работы положены результаты лечения 195 женщин, инфицированных высокоонкогенными генотипами ВПЧ, у 25 из которых диагностирована дисплазия II степени, у 120 – дисплазия III степени и у 50 – рак in situ. При характеристике атипических изменений в цервикальном эпителии использованы принятые в отечественной литературе термины дисплазия II и III степени, рак in situ, которые в зарубежной литературе обозначены как CIN II–III, где в CIN III объединены дисплазия III степени и рак in situ.
Разработаны режимы фотодинамического воздействия на шейку матки с учетом степени выраженности цервикальных изменений, их локализации и необходимости воздействия на резервуар репликативно активных вирусов, которое заключалось в облучении цервикального канала на всем его протяжении и всей площади влагалищной порции шейки матки с захватом сводов влагалища. Такой подход к лечению обеспечивает воздействие не только на видимый глазом патологический эпителий, но и клинически не определяемый, а также на латентные и субклинические формы папилломавирусной инфекции.
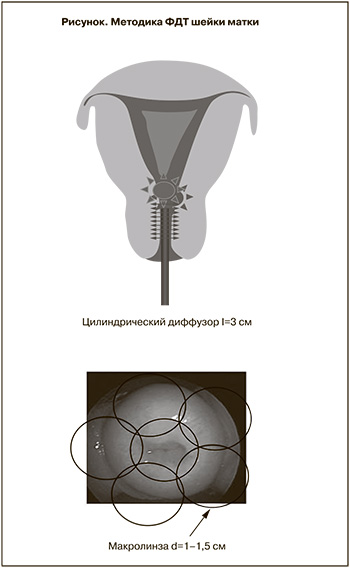
Сеанс лазерного облучения цервикального канала по всей его длине проводили с использованием гибкого кварцевого моноволоконного световода с цилиндрическим диффузором длиной 3 см, дающим матрицу света на 360%. Облучение влагалищной порции шейки матки осуществляли дистанционно с использованием световода с линзой диаметром 1–1,5 см, перпендикулярно подведенного к органу. Применена полипозиционная методика фотодинамического воздействия с диаметром светового пятна от 1 до 1,5 см, когда облучение начинается с области маточного зева одним полем с последовательным перемещением светового пятна вдоль всей поверхности шейки с перекрытием соседних полей на 0,3–0,4 см и захватом здоровых тканей на 0,3–0,5 см (рисунок).
Анализ непосредственных результатов ФДТ в лечении ВПЧ-ассоциированной дисплазии II степени с препаратом фотосенс (0,3 мг/кг, время экспозиции 24 ч, доза световой энергии 100 Дж/см2) показал излечение во всех клинических наблюдениях независимо от локализации патологических изменений в цервикальном эпителии.
В группе женщин с ВПЧ-ассоциированной дисплазии III степени, где ФДТ выполнена с препаратами фотогем (3,0 мг/кг, время экспозиции 72 ч, доза световой энергии 150 Дж/см2) и фотосенс (0,3 мг/кг, время экспозиции 24 ч, дозы световой энергии 150 Дж/см2), полная регрессия предрака достигнута в 92,5%. Отмечена высокая эффективность лечения при поражении экзоцервикса (96,8%) и несколько ниже – экзо-эндоцервикса (90%).
В наблюдениях с раком in situ при проведении ФДТ с фотогемом (3,0 мг/кг) и фотосенсом (0,3 мг/кг) применены световые дозы 200 Дж/см2 и 150 Дж/см2. Полная регрессия достигнута у 80,7% женщин, при этом наиболее часто начальные опухолевые изменения были локализованы в экзоцервиксе (93,9%). Единичные случаи неэффективности лечения диагностированы преимущественно при локализации преинвазивного рака в эндоцервиксе.
О выраженном противовирусном эффекте ФДТ свидетельствуют высокие значения полной эрадикации высокоонкогенных генотипов ВПЧ в 94% случаев, что значительно выше по сравнению с альтернативными методами воздействия (диатермо- и радиокоагуляция, криодеструкция, лазерная вапоризация), где данный показатель составляет от 7 до 77% [24, 25]. Противовирусный эффект лечения не зависел от степени тяжести диспластических изменений и распространенности начального опухолевого процесса, инфицирования одним или двумя и более типами ВПЧ.
Таким образом, ФДТ с отечественными препаратами фотосенс и фотогем является «минимальным вариантом» органосохраняющего лечения ВПЧ-ассоциированной дисплазии II–III ст. и начальной опухолевой патологии шейки матки, сопоставимым с традиционными лечебными воздействиями. Преимуществом ФДТ перед хирургическими и физическими методами лечения (ножевая ампутация, лазерная, электро- и радиоволновая конусовидная эксцизия) является одновременное патогенетическое воздействие на патологический процесс и этиологический фактор цервикального канцерогенеза – ВПЧ. ФДТ может быть рекомендована как альтернативный метод лечения ВПЧ-ассоциированной умеренной и выраженной дисплазии шейки матки, преинвазивного рака с сохранением анатомической и функциональной целостности органа, что немаловажно у женщин репродуктивного возраста. Разработанная методика фотодинамического воздействия за счет селективного и точечного разрушения видимых и невидимых патологических очагов является эффективной в достижении полной регрессии атипических изменений и эрадикации ВПЧ, что также в совокупности ведет к профилактике рецидивов заболевания. ФДТ может быть рекомендована с противовирусной целью на втором этапе лечения после высокой ножевой ампутации, лазерной, электро- и радиоволновой конусовидной эксцизии шейки матки. Низкий процент осложнений во время беременности и родов, не отличающийся от аналогичных показателей в популяции, а также возможность родоразрешения через естественные родовые пути свидетельствуют в целом о сохранении анатомической и функциональной целостности шейки матки после фотодинамического воздействия на орган. Своевременное проведение эффективных лечебных мероприятий на этапе предопухолевой и начальной опухолевой трансформации шейки матки, ассоциированной с высокоонкогенными генотипами ВПЧ, может сделать РШМ теоретически предотвращаемой опухолью, что является реальной вторичной профилактикой развития цервикального рака.



