Гестационный сахарный диабет (ГСД) является наиболее частым нарушением обмена веществ у беременных и по данным метаанализа составляет до 20% в общей популяции [1–3]. Во всем мире распространенность ГСД варьируется от 1 до 22%, в зависимости от генетического фона исследуемой популяции, применяемых диагностических методов, социальных факторов и факторов окружающей среды [1, 4].
Ежегодно отмечается увеличение числа беременных с ГСД, что связано, как с усовершенствованием диагностики, так и ростом этой нозологии [1, 5, 6]. Осложнения беременности и родов у женщин с ГСД достигают 80% [1, 2, 6]. По данным международных популяционных исследований у женщин с ГСД в 8 раз увеличивается риск преэклампсии, аномалий родовой деятельности и макросомии новорожденных, у 50% – развивается диабет 2 типа в последующее время [4].
Выделен ряд факторов риска ГСД [1]. Прегравидарное ожирение является наиболее хорошо документированным модифицируемым предиктором ГСД [5, 7]. Несмотря на это, поиск новых факторов риска ГСД активно ведется [3, 7, 8].
Определена значимость висцеральной жировой массы до наступления беременности в развитии ГСД [3]. Однако не достаточно изучено влияние метаболических нарушений пубертатного периода на развитие осложнений беременности.
Дисфункция гипоталамуса (ДГ) развивается в пубертатном периоде, и регистрируется у 25% девочек-подростков [9–11], при этом доля избыточной массы тела и ожирения у данной когорты достигает 83% [12, 13]. Активное выявление факторов риска ГСД у женщин с ДГ в пубертатном периоде позволит не только прогнозировать данное осложнение во время беременности, но и своевременно применять меры профилактики.
Целью нашего исследования было установить значимые факторы риска развития ГСД у женщин с ДГ и метаболическими нарушениями в пубертатном периоде для прогнозирования неблагоприятных исходов беременности.
Материал и методы исследования
Проведено проспективное обследование 170 девочек-подростков с ДГ в пубертатном периоде.
Из 170 девочек-подростков с ДГ у 66 (38,8%) индекс массы тела (ИМТ) соответствовал избыточной массе тела, у 104 (61,2%) – ожирению и составил 31,1(0,35) кг/м2.
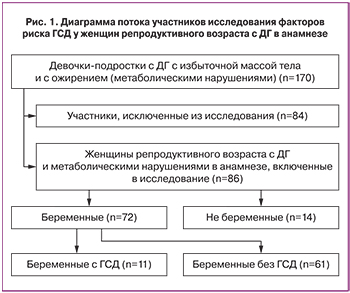 Проспективное исследование проводилось в период с 2000 по 2014 годы, средняя длительность наблюдения составила 4,7(1,7) лет. Из 170 девочек-подростков с ДГ в пубертатном периоде участниками исследования, согласно критериям включения и исключения, в репродуктивном возрасте стали 86 женщин. Оценка факторов риска ГСД проводилась у 72 беременных женщин репродуктивного возраста с ДГ в анамнезе (рис. 1).
Проспективное исследование проводилось в период с 2000 по 2014 годы, средняя длительность наблюдения составила 4,7(1,7) лет. Из 170 девочек-подростков с ДГ в пубертатном периоде участниками исследования, согласно критериям включения и исключения, в репродуктивном возрасте стали 86 женщин. Оценка факторов риска ГСД проводилась у 72 беременных женщин репродуктивного возраста с ДГ в анамнезе (рис. 1).
Критерии включения в исследование в репродуктивном возрасте: возраст старше 18 лет, ДГ (Е 23.3) проявляющаяся нейроэндокринными (избыточная масса тела или ожирение) и нейротрофическими (розовые или белые стрии) нарушениями по данным электроэнцефалографии в пубертатном периоде. Критерии исключения из исследования: трубное бесплодие (N 97.1), женщины репродуктивного возраста, которые не планировали беременность. Исключены из исследования 84 женщины, из них 22 – в связи со сменой места жительства, 13 – с трубным бесплодием (N 97.1), 26 – на момент проведения обследования, не достигшие 18 лет и 23 – беременность не планировали.
Исследование проводили с помощью анкеты-опросника для девочек в пубертатном периоде, созданной на основе анкеты, разработанной в Норвегии университетом г. Берчена (Health Behavior among School-Aged Children). Исследования проводили с учетом требований Хельсинской декларации Всемирной медицинской ассоциации (World Medical Association Declaration of Helsinki, 2008) и Правил клинической практики в Российской Федерации, утвержденных приказом Минздрава РФ от 19.06.2003 г. №266.
Для оценки степени ожирения вычислялся ИМТ по формуле (G.Brey, 1978), у девочек-подростков – с учетом стандартных отклонений и возраста. Согласно рекомендациям Всемирной организации здравоохранения, ожирение у детей и подростков определяли как +2,0 SDS, а избыточную массу тела – от +1,0 до +2,0 SDS.
Содержание глюкозы определяли всем беременным при сроке 7–8 недель и 24–25 недель в сыворотке венозной крови натощак, после 8–12-часового голодания, ферментативным глюкозооксидазным методом с окислением ортотолидина. Пероральный глюкозотолерантный тест включал определение глюкозы в венозной крови натощак и через 120 минут после пероральной нагрузки глюкозой в количестве 75 г. Пороговые значения для диагностики ГСД: уровень гликемии натощак в плазме венозной крови > 5,1<7,0 ммоль/л или через 2 часа >8,5 ммоль/л [1].
Статистическая обработка данных проводилась с помощью программы «Microsoft Excel» и пакета статистических программ «Statistica 6.0» с соблюдением общих рекомендаций для медицинских и биологических исследований. Итоговые результаты анализируемых показателей в каждой выборке представлены в виде М (SD), где М – среднее арифметическое, SD – стандартное отклонение.
Для оценки рисков использовались четырехпольные таблицы сопряженности. Воздействие конкретного фактора оценивали по величине относительно риска (ОР) и 95% доверительного интервала (ДИ). Многофакторный анализ был проведен с использованием моделей логистической регрессии. Результаты моделирования представлялись в виде значений отношения шансов (ОШ) и 95% ДИ для факторов, которые рассматривались как потенциально значимые относительно тестируемых гипотез и для оценки их вклада в реализацию риска.
Результаты исследования и обсуждение
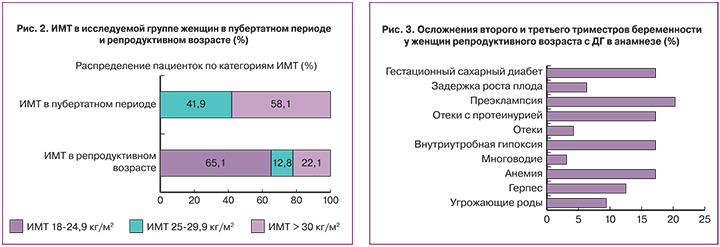
Проспективное исследование девочек-подростков с ДГ через 6,1 (0,46) года позволило оценить репродуктивную функцию у 86 женщин репродуктивного возраста с ДГ и метаболическими нарушениями в анамнезе. Средний возраст женщин составил 21,95 (0,2) года, ИМТ – 24,7 (3,9) кг/м2 (ИМТ соответствовал избыточной массе тела у 36 (41,9%), ожирению – у 50 (58,1%) обследуемых).
При оценке динамики массы тела у 86 женщин репродуктивного возраста с ДГ и метаболическими нарушениями в анамнезе относительно пубертатного периода выявлено, что снижение массы тела (по ИМТ) в репродуктивном возрасте относительно пубертатного периода произошло у значительного числа женщин – 63 (73,3%), при этом из них у 56 (88,9%) – до нормальной массы тела, у 7 (11,1%) – до избыточной массы тела. В исследуемой когорте у 15 (17,4%) женщин репродуктивного возраста ИМТ не претерпел изменений в сравнении с пубертатным периодом и соответствовал избыточной массе тела у 4 (26,7%), ожирению – у 11 (73,3%). Увеличение ИМТ>30,0 кг/м2 в репродуктивном возрасте в сравнении с пубертатным периодом отмечалось у 8 (9,3%) обследуемых. Следовательно, у женщин с ДГ и метаболическими нарушениями в анамнезе в репродуктивном возрасте выявлена нормальная масса тела у 65,1% (95% ДИ: 54,6–74,35), избыточная масса тела – у 12,8% (95% ДИ: 7,29–21,5) и ожирение – у 22,1% (95% ДИ: 14,62–31,94) (рис. 2).
При оценке фертильности установлено, что фертильными были 46 женщин с ДГ в анамнезе (53,5%, 95% ДИ: 43,03–63,66), первично бесплодными – 26 (30,2%, 95% ДИ: 21,54–40,61), вторично бесплодными – 14 (16,3%, 95% ДИ: 9,95–25,49). Беременность наступила у 64 (74,4%) обследуемых женщин после комплексного обследования и лечения бесплодия, включая стимуляцию овуляции и вспомогательные репродуктивные технологии (ВРТ) у каждой четвертой обследуемой – 16 (25,0%).
В первом триместре беременности у 12 (16,7%) беременных женщин с ДГ в анамнезе был диагностирован угрожающий выкидыш (О20.0), у 8 (11,1%) – самопроизвольный (О03), анемия и рвота беременных – у 8 (11,1%) и 6 (8,3%) соответственно. Во втором и третьем триместрах беременности (рис. 3) угрожающие роды (О60.0) были у 6 (9,4%), внутриутробная гипоксия (Р20) и анемия беременной выявлены с одинаковой частотой у 11 (17,2%). С высокой частотой в третьем триместре выставлялся диагноз преэклампсия (О14) у – 13 (20,3%), вызванные беременностью отеки с протеинурией (О12.2) – у 11 (17,2%).
ГСД (О24.4) диагностирован у каждой пятой беременной в исследуемой группе – у 11 (17,2%). Проведена оценка социально-экономических, медико-биологических факторов риска антенатального и пубертатного периодов в развитии ГСД у беременных женщин с ДГ в анамнезе (табл. 1).
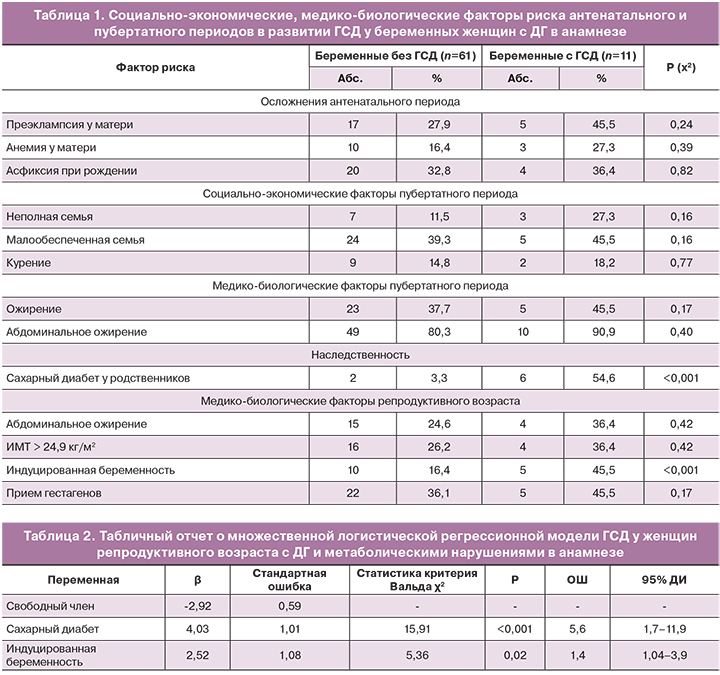
Определено увеличение риска развития ГСД (ОР>1) при проживании в подростковом возрасте в неполной (ОР – 2,3; 95% ДИ: 0,74–7,31) и малообеспеченной семье (ОР – 1,2; 95% ДИ: 0,41–3,67), курении (ОР – 1,2; 95% ДИ: 0,31–4,95), наличии ожирения (ОР – 1,32; 95% ДИ: 0,42–4,12), в том числе абдоминального (ОР – 2,2; 95% ДИ: 0,31–15,7) в пубертатном периоде, осложненном течение беременности у матери – преэклампсии (ОР – 1,9; 95% ДИ: 0,64–5,5), анемии (ОР – 1,7; 95% ДИ: 0,52–5,5), асфиксии при рождении (ОР – 1,14; 95% ДИ: 0,37–3,52). Значимым медико-биологическим фактором риска развития ГСД был сахарный диабет у ближайших родственников (ОР – 9,6; 95% ДИ: 3,7–18,3).
При оценке факторов риска репродуктивного возраста у женщин с ДГ в анамнезе увеличивали риски развития ГСД (ОР>1): окружность талии >80 см (ОР – 1,6; 95% ДИ: 0,52–4,84), ИМТ>24,9 кг/м2 (ОР – 1,5; 95% ДИ: 0,49–4,5). Дополнительно мы оценили воздействие терапии, которая проводилась с целью наступления беременности в развитии ГСД. Значимым фактором ГСД была индуцированная беременность (стимуляция овуляции / ВРТ) (ОР – 3,16; 95% ДИ: 1,11–8,97). Прием гестагенов (вагинальное введение) во время беременности (ОР – 1,4; 95% ДИ: 0,47–4,1) увеличивал риск ГСД, но не был значимым.
Использование гестагенов во время беременности, как прогностический фактор развития ГСД на сегодняшний день широко обсуждается в литературе. В нашем исследовании прием гестагенов во время беременности не значимо увеличивал риск ГСД, что сопоставимо с ретроспективными исследованиями, проводимыми в Хайфе (Израиль) и в Вене, (Австрия). Исследования показали, что ежедневное использование вагинального прогестерона не ассоциировалось с более высокими показателями уровня глюкозы или ГСД [14, 15]. Однако, при исследовании прогестерона, как прогностического фактора риска ГСД, но с учетом пути введения, получена значимая зависимость. Введение инъекционного прогестерона в течение первых 10–12 недель беременности ассоциировалось с двукратным повышенным риском развития ГСД (ОШ 2,28), вагинального прогестерона – не было значимо [8].
На основании проведенного анализа и выделенных факторов ГСД у женщин с ДГ в анамнезе построена модель множественной логистической регрессии. Зависимая переменная – наличие ГСД у женщин с ДГ в анамнезе, все независимые переменные, входящие в модель множественной логистической регрессии, бинарные. Модель множественной логистической регрессии позволила выявить совокупность предикторов (табл. 2), наилучшим образом предсказывающую вероятность ГСД у женщин с ДГ в анамнезе (χ2=22,11, p<0,001): наследственный сахарный диабет у ближайших родственников (ОШ=5,6; 95% ДИ: 1,7–11,9) и индуцированная беременность (ОШ=1,4; 95% ДИ: 1,04–3,9). Правильно классифицированное соотнесение в группу составляет 91,6%.
Таким образом, полученные нами данные подчеркивают важность наследственной предрасположенности, что является достаточно известным фактом и подтверждено многими исследованиями [1, 6, 13]. За последние годы появилось большое количество работ, посвященных изучению роли генетических аномалий, принимающих участие в патогенезе сахарного диабета, их роль не вызывает сомнений [16]. Генетические механизмы или способствуют развитию, или снижают возможности компенсаций различных нарушений [16, 17], примером которых может служить ГСД.
Исследования, касающиеся риска ГСД при стимуляции овуляции, в том числе в программах ВРТ, единичны. M. Ashrafi et al. (2014) в своих исследованиях отмечают двукратное увеличение риска ГСД у пациенток после ВРТ [2]. Европейской ассоциацией перинатальной медицины в 2014 году опубликованы данные ретроспективного исследования женщин, беременность у которых наступила после ВРТ (n=1292) или стимуляции овуляции (n=1988), в которых показано, что оплодотворение in vitro и индукция овуляции являются независимыми факторами риска ГСД (ОР–1,77) [18]. Данные, полученные на основании международных фундаментальных исследований, позволяют предположить развитие не только ГСД у беременной, но и повышенный риск метаболических нарушений у лиц, зачатых путем экстракорпорального оплодотворения [19], что подтверждает необходимость дальнейшего изучения и обсуждения исследований в этом направлении.
Заключение
В проспективном исследовании нами показано, что у женщин с ДГ и метаболическими нарушениями, развившимися в пубертатном периоде, совокупностью предикторов наилучшим образом предсказывающей вероятность развития ГСД является сахарный диабет у ближайших родственников (ОШ=5,6) и индуцированная беременность (ОШ=1,4). В группу риска развития ГСД, по нашему мнению, необходимо включить женщин с ДГ в анамнезе, планирующих лечение бесплодия методами ВРТ и стимуляции овуляции. Ежегодное увеличение числа беременных после ВРТ, с учетом проведенного исследования требует информированности пациенток о возможном развитии осложнений беременности, в частности ГСД.



