В настоящее время официально регистрируются только манифестные формы папилломавирусной инфекции (ПВИ) – аногенитальные (венерические) бородавки. Однако у 40,0–55,0% пациенток с аногенитальными бородавками выявляется вирус папилломы человека (ВПЧ) высокого онкогенного риска (16/18 генотипы) [1], являющийся этиологическим агентом рака шейки матки [2]. Факторы риска инфицирования ВПЧ и развития рака шейки матки во многом совпадают. Клинические проявления и исход ПВИ зависят от генотипа вируса и варианта течения инфекции (транзиторный или персистирующий). Для развития неопластических процессов (цервикальная интраэпителиальная неоплазия (CIN) II–III, carcinomа in situ, инвазивный рак) необходима вирусная персистенция [3–6], при которой у 54,4% женщин регистрируется сочетание различных генотипов ВПЧ с инфекционным индексом 2–6, что в 6,5 раза чаще, чем при транзиторной ПВИ (8,3%) [7].
Для определения степени патологического процесса на доклинической стадии необходим поиск ранних вирусологических маркеров, определение физического статуса ДНК ВПЧ (эписомальная, интегрированная), вирусной нагрузки и молекулярно-биологических критериев прогрессирования дисплазий [8–12]. Интеграция ДНК ВПЧ в клеточный геном – ключевой фактор риска неопластических изменений в эпителии шейки матки, характеризуется встраиванием последовательностей ДНК 16/18 генотипов ВПЧ в хромосому инфицированной клетки, которое сопровождается синтезом онкобелка Е7, иммуносупрессивного агента, ингибирующего антипролиферативную и противовирусную активность интерферонов [13–16]. В настоящее время идентифицировано множество генов, являющихся основными при развитии опухоли. Одним из них является ген p16INK4a, влияющий на процесс пролиферации и дифференцировки клеток, регулирующий активность белка ретинобластомы, являющийся маркером повышенного риска перехода дисплазии в cancer in situ. Универсальным маркером для оценки клеточного цикла является белок Ki67. Одновременная экспрессия Ki67 и р16 в клетках может быть использована как индикатор отмены регуляции контроля клеточного цикла [17, 18]. Прогностическая ценность определения активности вирусного генома (вирусной нагрузки) как критерия клинической значимости инфекции и высокой степени вероятности развития CIN изучается [10, 19, 20]. Для повышения качества диагностики цервикальных поражений на фоне ПВИ и доклинической стадии инфицирования шейки матки (латентной ПВИ), способной стать предвестником заболевания, актуальным является внедрение методов определения онкобелка Е7 ВПЧ и биомаркеров р16 и Ki67 [3].
Цель исследования: оценка экспрессии вирусных онкогенов и вирусной нагрузки при различных вариантах течения урогенитальной ПВИ.
Материал и методы исследования
 Проведено клинико-лабораторное обследование 162 женщин в возрасте от 20 до 65 лет, обратившихся на консультативный прием в ФГБУ Уральский НИИ дерматовенерологии и иммунопатологии Минздрава России. Детекция, дифференциация и количественное определение ДНК ВПЧ высокого канцерогенного риска (ВКР) (16, 18, 31, 33, 35, 39, 45 , 51, 52, 56, 58, 59-го генотипов) выполнялись методом полимеразной цепной реакции с гибридизационно-флуоресцентной детекцией в режиме «реального времени» (АмплиСенс ВПЧ ВКР скрин-титр – FL, ФБУН ЦНИИ эпидемиологии Роспотребнадзора, Москва, ТУ 9398-053-01897593-2008, регистрационное удостоверение № ФСР 2008/02567 от 04.05.2008г, срок действия не ограничен) в образцах эпителиальных клеток цервикального канала. В зависимости от уровня выделяли низкую (малозначимую – 2,9 lg HPV×105 клеток), среднюю (значимую – 3–4,9 HPV×105 клеток) и повышенную (5 и более HPVx105 клеток) вирусную нагрузку.
Проведено клинико-лабораторное обследование 162 женщин в возрасте от 20 до 65 лет, обратившихся на консультативный прием в ФГБУ Уральский НИИ дерматовенерологии и иммунопатологии Минздрава России. Детекция, дифференциация и количественное определение ДНК ВПЧ высокого канцерогенного риска (ВКР) (16, 18, 31, 33, 35, 39, 45 , 51, 52, 56, 58, 59-го генотипов) выполнялись методом полимеразной цепной реакции с гибридизационно-флуоресцентной детекцией в режиме «реального времени» (АмплиСенс ВПЧ ВКР скрин-титр – FL, ФБУН ЦНИИ эпидемиологии Роспотребнадзора, Москва, ТУ 9398-053-01897593-2008, регистрационное удостоверение № ФСР 2008/02567 от 04.05.2008г, срок действия не ограничен) в образцах эпителиальных клеток цервикального канала. В зависимости от уровня выделяли низкую (малозначимую – 2,9 lg HPV×105 клеток), среднюю (значимую – 3–4,9 HPV×105 клеток) и повышенную (5 и более HPVx105 клеток) вирусную нагрузку.
Согласно филогенетической классификации урогенитальные генотипы ВПЧ отнесены к супергруппе А, которая, на основе различий последовательностей генов Е6, Е7, L1, подразделена на 7 филогенетических групп генитальных ВПЧ. С использованием набора реагентов «АмплиСенс ВПЧ ВКР скрин-титр–FL» выявляли ДНК ВПЧ основных филогенетических групп, обладающих высокой трансформирующей активностью и ответственных более чем за 94% случаев тяжелых CIN и рака шейки матки: А7 (18, 39, 45, 59, 68, 70), А9 (16, 31, 33, 35, 52, 58, 67), а также ДНК ВПЧ 51-го (группа А5) и 56-го (группа А6) типов.
Качественное определение p16 ink4α и Ki67 протеинов методом иммуноцитохимии проводили с использованием набора реагентов CINtec Cytology Plus (МТМ laboratories AG, Германия). Приготовленные на стеклах, с повышенной абсорбирующей поверхностью, цитологические препараты фиксировались при 500С в течении двух часов, проводилась высокотемпературная демаскировка антигенов, промывка трис-буфером. Затем цитологические препараты обрабатывались первичными моноклональными антителами (клон Е6Н4 к белку p16 и клон 274-11 АС3 к белку Ki67). Для визуализации реакции антиген-антитело применялись полимеры, конъюгированные с пероксидазой хрена. Ядра окрашивали гематоксилином Карацци. Оценивалась ядерная и цитоплазматическая реакции. Сильный позитивный сигнал на р16 INK4a (сверхэкспрессия) в цитоплазме и ядрах характеризовался коричневым окрашиванием клеток. Кi67 – белок, ассоциированный с пролиферацией, его экспрессия оценивалась по красному окрашиванию ядер. Результат считался положительным, если хотя бы одна диспластическая клетка была позитивна на p16 и Ki67. Одновременная экспрессия Ki67 и р16 расценивалась как молекулярный биомаркер прогностически неблагоприятных диспластических клеток, индикатор отмены регуляции контроля клеточного цикла, индикатор статуса трансформированных клеток.
Результаты исследования и обсуждение
Различные генотипы ВПЧ, в том числе высокого онкогенного риска, диагностированы молекулярно-генетическим методом в соскобах цервикального эпителия у 46 (28,4%) из 162 пациенток. Были сформированы 2 группы исследования: в первую группу вошли 24 женщины в возрасте от 20 до 56 лет (средний возраст 29,8 года) с латентной ПВИ при отсутствии клинических признаков заболевания шейки матки. Вторую группу составили 22 пациентки в возрасте от 21 до 59 лет (средний возраст 33,9 года) с заболеваниями шейки матки. В группу сравнения вошли 20 условно здоровых женщин в возрасте от 20 до 61 года (средний возраст 41,3 года), у которых ВПЧ не был выявлен.
 При бактериоскопическом исследовании отделяемого цервикального канала воспалительная реакция, характеризующаяся выраженным повышением количества полиморфноядерных лейкоцитов (40 и более в поле зрения) выявлена у большинства (86,4%) пациенток с ПВИ и заболеваниями шейки матки, у 29,2% женщин с латентной ПВИ и у 10,0% пациенток контрольной группы (р=0,001). У женщин с ПВИ и заболеваниями шейки матки в 31,3% случаев отмечалась ассоциация с Ur. urealyticum, в 31,3% – с цитомегаловирусом. У пациенток с латентной ПВИ в 58,3% случаев выявлялись условно-патогенные микроорганизмы: Ur. urealyticum (28,6%), G. vaginalis (21,4%), M. hominis (14,3%), Ur. parvum (14,3%), в 21,4% случаев – вирус простого герпеса.
При бактериоскопическом исследовании отделяемого цервикального канала воспалительная реакция, характеризующаяся выраженным повышением количества полиморфноядерных лейкоцитов (40 и более в поле зрения) выявлена у большинства (86,4%) пациенток с ПВИ и заболеваниями шейки матки, у 29,2% женщин с латентной ПВИ и у 10,0% пациенток контрольной группы (р=0,001). У женщин с ПВИ и заболеваниями шейки матки в 31,3% случаев отмечалась ассоциация с Ur. urealyticum, в 31,3% – с цитомегаловирусом. У пациенток с латентной ПВИ в 58,3% случаев выявлялись условно-патогенные микроорганизмы: Ur. urealyticum (28,6%), G. vaginalis (21,4%), M. hominis (14,3%), Ur. parvum (14,3%), в 21,4% случаев – вирус простого герпеса.
При цитологическом исследовании клинического материала из цервикального канала воспалительная картина с реактивными изменениями эпителия (дискариозом) установлена у 62,5% пациенток с ПВИ и заболеваниями шейки матки, у двух женщин (9,1%) диагностирована железистая гиперплазия с атипией I степени. При цитологическом исследовании биоматериала цервикального канала женщин с латентной ПВИ картина воспаления с реактивными изменениями эпителия отмечена у 66,7% пациенток (n=16) (р≥0,05), у одной пациентки (4,2%) выявлена железистая гиперплазия с атипией I степени. При цитологическом исследовании клинического материала из цервикального канала у 65,0% женщин группы сравнения с исключенным ВПЧ получены цитограммы неизмененного эпителия, у трети (35,0%) отмечена воспалительная картина, у 1 (5,0%) дисплазия I степени. Проведенные исследования показывают, что при отсутствии клинических признаков заболевания шейки матки наличие ВПЧ является фактором риска развития морфологических изменений цервикального эпителия.
При оценке активности вирусного генома не было выявлено достоверных различий уровня вирусной нагрузки у пациентов с латентной ПВИ при наличии и отсутствии заболеваний шейки матки (рис. 1). Высокая (5 и более lg HPV на 105 клеток) и значимая (3–5 lg HPV на 105 клеток) вирусная нагрузка определялась у 87,5% пациенток первой группы и 72,7% пациенток второй группы (р≥0,05). Сравнительный анализ верификации различных генотипов ВПЧ показал отсутствие достоверных различий (р≥0,05) по наличию ВПЧ одной (45,8 и 63,6% соответственно) или нескольких (54,2 и 36,4%) филогенетических групп ВПЧ: А7 (18, 39, 45, 59, 68, 70), А9 (16, 31, 33, 35, 52, 58, 67), А5 (51) и А6 (56) при обследовании пациенток с латентной ПВИ и ПВИ в сочетании с заболеваниями шейки матки (рис. 2).
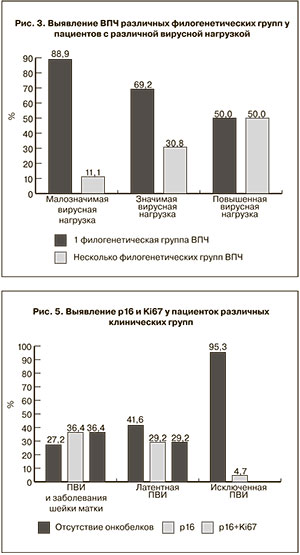
Сочетание генотипов различных филогенетических групп, включая ВПЧ с высоким онкогенным потенциалом, отмечалось в 50,0% случаев при повышенной вирусной нагрузке (5 и более lg HPV на 105 клеток), в 30,8% – значимой и 11,1% – малозначимой вирусной нагрузке (рис. 3). ВПЧ одной филогенетической группы выявлялись у большинства пациентов (88,9%) с малозначимой вирусной нагрузкой.
Иммуноцитохимическое исследование протеинов p16 ink4α и Ki67 в ядрах и цитоплазме клеток эпителия шейки матки (рис. 4 см. на вклейке) позволило установить, что онкобелок р16 ink4α выявлялся в группе пациенток с ПВИ и заболеваниями шейки матки в 36,4% случаев, у трети пациенток (29,2%) с визуально неизмененной шейкой матки (латентная ПВИ), и лишь у 4,7% лиц группы сравнения при исключенной ПВИ (рис. 5). Можно предположить, что это является эпидемиологическим подтверждением клинико-экспериментальных данных о роли ВПЧ в формировании пролиферативной патологии шейки матки и эпидемиологической значимости обнаружения ВПЧ в качестве маркера предопухолевых состояний шейки матки на ранних этапах.
Отсутствие онкобелков р16 и Ki67 в эпителии шейки матки отмечено у 95,3% женщин при исключенной ПВИ, у 41,6% пациенток с латентной ПВИ, у трети пациенток (27,2%) с ПВИ и заболеваниями шейки матки. Сочетанное обнаружение протеинов р16 и Ki67 (рис. 6, 7 см. на вклейке) отмечено в 36,4% случаев в группе пациенток с ПВИ и заболеваниями шейки матки, в том числе при железистой гиперплазии с атипией I степени, у 29,2% женщин с латентной ПВИ. У лиц группы сравнения р16 и Ki67 одновременно не выявлялись.
Проведенный клинико-иммуноцитохимический анализ показал, что экспрессия онкобелков р16 и Ki67 увеличивается прямо пропорционально степени неопластических изменений эпителия шейки матки.
Заключение
Таким образом, проведенный анализ экспрессии вирусных онкогенов p16 и Ki67 и вирусной нагрузки с количественным определением генотипов ВПЧ при различных вариантах течения урогенитальной ПВИ позволил установить зависимость между вариантом течения ПВИ, вирусной нагрузкой, различными генотипами ВПЧ, экспрессией онкобелков p16INK4a и Ki67.
Генотипирование дает возможность дифференцировки персистирующей инфекции от вновь приобретенной, микстинфицирование генотипами ВПЧ снижает скорость элиминации вируса из организма и является неблагоприятным прогностическим признаком.
Использование биомаркеров пролиферации в ранней диагностике диспластических и неопластических процессов шейки матки позволяет увеличить чувствительность выявления начальных морфологических изменений цервикального эпителия и сформировать группы диспансерного наблюдения.



