В мире ежегодно диагностируется более 500 000 случаев рака шейки матки (РШМ), которые в половине случаев заканчиваются летально [1]. В 2012 году в России было зарегистрировано 15 051 новых случаев РШМ [2]. Одной из основных причин заболевания является инфицированность высокоонкогенными типами вируса папилломы человека (ВПЧ) базальных эпителиальных клеток шейки матки, сопровождающееся репликацией вирусной ДНК и синтезом ранних вирусных онкопротеинов Е5, Е6 и Е7, способных подавить клеточную дифференцировку, нарушить нормальные процессы апоптоза и пролиферации, вызвать повреждения хромосом и инициировать гиперпластические процессы в пораженной ткани вплоть до РШМ [3, 4].
В последние годы была показана важная роль в развитии неопластической трансформации и злокачественных опухолей не транслируемых низкомолекулярных РНК – микроРНК [5]. По данным последней версии базы данных miRBase у человека выявлено 2216 зрелых молекул микроРНК, контролирующих функциональную активность более трети генов генома [6].
МикроРНК – короткие одноцепочечные молекулы длиной 20–25 нуклеотидов, осуществляющие регуляцию экспрессии генов на посттранскрипционном уровне. ДНК для микроРНК в геноме организованы или в виде отдельного генного локуса (кластера), содержащего последовательности для десятков часто функционально связанных разных микроРНК, или представлены в виде отдельного участка со своим промотором и регуляторной областью [7]. Кроме того, последовательности для микроРНК могут находиться внутри других генов, обычно в их интронных участках. Механизм регуляторного действия микроРНК осуществляется путем комплементарного узнавания специфического участка на 3’-конце матричной РНК (мРНК) и последующей ее деградации или торможения синтеза белковой молекулы [8]. Каждая микроРНК может иметь до сотен различных мРНК-мишеней, и наоборот, мРНК могут иметь сайты узнавания для множества разных микроРНК. МикроРНК участвуют в регуляции большинства фундаментальных биологических процессов развития организма: делении клеток, смене фаз клеточного цикла, апоптозе, клеточной миграции и инвазии, ангиогенезе, формировании иммунного ответа [7]. На сегодняшний день имеется множество исследований, в которых было показано повышение или снижение экспрессии определенных микроРНК при патологических процессах в организме, в том числе и в доброкачественных и злокачественных гиперплазиях клеток и тканей [9, 10].
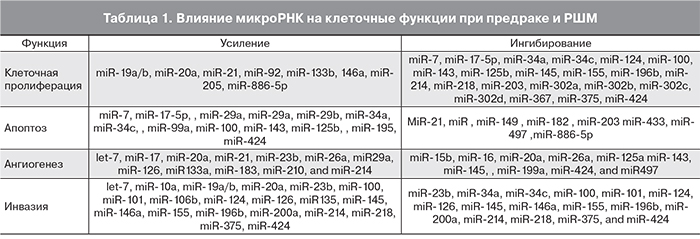
Развитие опухолевых процессов сопровождается повышением экспрессии так называемых проонкогенных микроРНК, усиливающих пролиферативную активность клеток, способствующих их метастазированию и инвазии, активирующих локальный ангиогенез. Одновременно снижается синтез противоонкогенных микроРНК, обеспечивающих функцию апоптоза, тормозящих миграцию, инвазию и ангиогенез. В табл. 1 приведена функциональная роль различных микроРНК при неопластических изменениях в шейке матки [11, 12].
В активации клеточной пролиферации участвуют по крайней мере 8 микроРНК, подавляют пролиферацию 21 микроРНК. Аналогично в усилении или подавлении апоптоза участвуют, соответственно, 13 и 8 микроРНК; в усилении или подавлении ангиогенеза – соответственно 12 и 10 микроРНК; а в усилении или подавлении инвазивности и склонности к метастазированию – 20 и 16 микроРНК.
Так как микроРНК могут иметь множество генов-мишеней, они могут участвовать в регуляции одновременно нескольких функций. Экспрессия miR-21 значительно повышена практически при всех видах опухолей и регулирует функцию ряда генов-мишеней, участвующих в развитии неопластического процесса, в том числе и при цервикальном раке [13]. Инактивируя мРНК генов РТЕN (phosphatidylinositol-3,4,5-trisphosphate 3-phosphatase) и PDCD4 (программированная клеточная смерть 4), miR-21 активирует репликацию геномной ДНК и ингибирует апоптоз [14]. Подавление функции генов-мишеней – тропомиозина 1 и Маспина сопровождается повышением продукции металлопротеаз и, соответственно, возникновением в клетках способности к инвазии и метастазированию [15]. Экспрессия miR-34a снижена как при цервикальном раке, так и при других злокачественных опухолях. Подавляя функцию генов Bcl-2, Survivin, CDK4 и CDK miR-34a поддерживает апоптоз и ингибирует пролиферацию [16]. Подавление инвазивных и миграционных свойств клеток miR-34a осуществляется благодаря ингибированию функции LEF1 [17].
На сегодняшний день установлено более 50 микроРНК, уровень экспрессии которых меняется в процессе перехода от нормы к цервикальной интраэпителиальной неоплазии (ЦИН) 1 и далее к ЦИН 2, ЦИН 3 и цервикальному раку [18]. В табл. 2 представлены микроРНК, повышение или снижение экспрессии которых при интраэпителиальной неоплазии и цервикальном раке было выявлено, по крайней мере, в двух независимых исследованиях [18–20]. Обращает на себя внимание тот факт, что развитие неопластического процесса от ЦИН 1 до рака сопровождается значительным изменением профиля экспрессии микроРНК, на каждой стадии активируются новые проонкогенные микроРНК и снижается экспрессия противоонкогенных микроРНК.
Исследование динамики изменения микроРНК на разных стадиях развития цервикальной гиперплазии позволяет разработать маркеры ранней диагностики заболевания. В работе Gocze и соавт. [21] показано, что экспрессия miR-27а в фиксированных формалином образцах ткани из шейки матки значительно выше при ЦИН 2/3, чем в норме или ЦИН 1; при РШМ значительно выше, чем при ЦИН 2/3. Наоборот, уровень экспрессии miR-34а в норме и ЦИН 1 значительно выше, чем при ЦИН 2/3, а при ЦИН 2/3 значительно выше, чем при РШМ. Эти различия становятся более выраженными у курящих и носителей ВПЧ 16. Прогрессивное снижение экспрессии от ЦИН 2/3 к РШМ по сравнению с нормальной тканью было показано для miR-21, miR-24 miR-27а, miR-29a, miR-99a, miR-143, miR-145, miR-195, miR-203, miR-218, miR-375 и miR-100. Наоборот, прогрессивное повышение экспрессии (норма → ЦИН 2, 3 → РШМ) характерно для miR-15, miR-16, miR-25, miR-92а, miR-93, miR-106b, miR-146, miR-155, miR-210, miR-224, miR-378, и miR-424.
Комплексную формулу, позволяющую дифференцировать разные стадии цервикальной неоплазии по профилю экспрессии микроРНК, предложили X. Wang и соавт. [22]. В результате проведенных ими исследований были отобраны 4 микроРНК (miR-25, miR-92а, miR-22, miR-29а), из которых экспрессия двух прогрессивно повышалась (miR-25 и miR-92) и еще двух прогрессивно снижалась (miR-22, miR-29а) независимо от тканевой специфичности и типа высокоонкогенного вируса, которым были инфицированы клетки кератоцитов. С высокой степенью достоверности было отмечено, что отношение среднего значения уровней экспрессии miR-25/miR-92а к среднему значению экспрессии miR-22/miR-29а в инфицированных высокоонкогенными ВПЧ тканях положительно коррелировало со степенью тяжести поражения шейки. Более того, наиболее значительное различие было отмечено при сравнении отношений экспрессии между ЦИН 1+2 и нормой, что позволяет проводить раннюю диагностику заболевания.
При использовании технологии переноса в клетки белок-продуцирующих рекомбинантных векторов, установлена роль вирусных онкопротеинов – Е5, Е6 и Е7 в развитии гиперпластических процессов в пораженной ткани. Онкопротеин Е5 ингибирует экспрссию miR-324-5р, miR-203, мишенью для которых являются гены CDH2, CTNNB1 и р61, регулирующие свойства клеток к миграции. Кроме того Е5 специфически ингибирует экспрессию miRNA-196a, мишенью для которой является ген HoxB8, регулирующий клеточный апоптоз и пролиферацию [23]. В то же время белок Е5 повышает экспрессию miR-146а, ингибирующий функцию гена ZNF813 в свою очередь обеспечивающий адгезивность клеток и торможение клеточного деления [23, 24].
Онкопротеин Е6, разрушая контролирующий апоптоз белок р53, подавляет экспрессию miR-34, что сопровождается усилением пролиферативной активности клеток [25]. Деградация р53 приводит также и подавлению экспрессии miR-23b, что усиливает экспрессию активатора плазминогена урокеназного типа и индуцирует этим миграционную активность клеток цервикальной карциномы [26]. Онкопротеин Е6 высокоонкогенного вируса (ВПЧ-16), но не низкоонкогенного (ВПЧ-6) ингибирует экспрессию miR-218 [27].
Мишенью для miR-218 является мРНК гена ламинина (LAMB3), в экспериментальных условиях стимулирующего миграционные и туморогенные свойства клеток.
Вирусный онкопротеин Е7 активирует экспрессию клеточных проонкогенных микроРНК miR-15а, miR-15b, miR-16, miR-25, miR-92а и miR-378, но ингибирует экспрессию антионкогенных микроРНК miR-203, miR-22, miR-27а, miR-29а, miR-100 и miR-34а [22].

Вирусный белок L2 не считается онкопротеином, однако было показано, что трансфекция гена L2 в составе плазмиды в клетки NIH 3T3 подавляет экспрессию противоонкогенной miR-125b, уровень которой обычно значительно снижен при многих видах опухолей, в том числе и РШМ [22].
Особый интерес представляет анализ экспрессии микроРНК в плазме крови, позволяющий минимально травматично диагностировать наличие как доброкачественной, так и злокачественной неоплазии, оценивать прогноз и эффективность терапевтических мероприятий. Исследования Wang и соавт. [28] показали, что содержание miR-146*, miR-542-3р и miR-664 повышено в сыворотке больных с РШМ, и снижается после оперативного лечения. Summerer c coавт. показали исчезновение из плазмы специфических для РШМ циркулирующих микроРНК miR-425-5p, miR-93-5p после проведенной химиотерапии [29]. Значительное снижение в сыворотке циркулирующей miR-218 характеризует позднюю стадию цервикальной аденокарциномы и накопление метастазов в лимфатических узлах [30]. У больных с РШМ повышенный уровень miR-20а, miR-203, miR1246, miR-2392, miR-3147 и miR-4484 ассоциируется с переходом заболевания в стадию метастазирования в лимфатические узлы [31, 32]. Больные с повышенным уровнем miR-224 в биопсийном материале РШМ чаще имеют метастазы в лимфатических узлах и плохой прогноз выживаемости [33].
Наоборот, низкий уровень экспрессии miR-145 в тканях цервикального рака показал себя как независимый прогностический фактор более агрессивного течения заболевания и короткого срока жизни [34].
Исследования на клеточных культурах показали, что повышение концентрации miR-218 усиливает радиочувствительность опухолевых клеток [35]. Эффект обусловлен способностью miR-218 усиливать апоптоз на фоне повышенной репарационной активности, индуцированной облучением. В экспериментах на мышах было показано, что эта же микроРНК повышает хемочувствительность к кисплатину [36]. Наоборот, miR-181 при внесении к культуральным клеткам или введении экспериментальным мышам снижает терапевтический эффект кисплатина [37].
Специфичность изменения профиля экспрессии микроРНК при опухолевых заболеваниях позволяет на основе их синтетических аналогов (прямых или комплементарных) создавать новый класс препаратов для таргентной терапии рака. Введение синтетического аналога miR-34 в составе липосом в кровь мышей с гепатоцеллюлярной карциномой привело к остановке роста опухоли, ингибированию образования новых метастазов и значительно удлинило срок жизни [38]. Аналогичные результаты были получены при доклинических испытаниях синтетических аналогов let-7, miR-10b, miR-221 и miR-21 [39, 40] В настоящее время препарат на основе miR-34 (MRX34) проходит 1-ю фазу клинических испытаний. Применение препаратов на основе микроРНК в качестве противоопухолевого средства позволит добиться существенных преимуществ по сравнению с традиционной терапией. Каждая микроРНК участвует в регуляции одновременно множества разных функционально связанных генов, что позволяет целенаправленно влиять на измененные функции трансформированной клетки. Использование комбинации нескольких микроРНК позволить целенаправленно останавливать пролиферацию опухолевых клеток, восстанавливать в них функцию апоптоза, ингибировать метастазирование.
Заключение
Неопластическая трансформация тканей шейки матки от нормы к ЦИН 1 и далее к ЦИН 2, ЦИН 3 и РШМ сопровождается изменением профиля экспрессии более 50 микроРНК, контролирующих процессы клеточной пролиферации, апоптоза, инвазии, миграции и локального ангиогенеза. Изменение профиля экспрессии вызывается как инфицированием самим ВПЧ, так и вирусными онкопротеинами – Е5, Е6, Е7 и L2. Оценка уровня экспрессии отдельных микроРНК в пораженной ткани (miR-34а, miR-145, miR-27а, miR-29a и др.) позволяет с высокой эффективностью дифференцировать ранние стадии цервикальной неоплазии от нормы и цервикальный рак от предраковых состояний. Более того, количественное определение микроРНК в соскобах из цервикального канала или в крови может характеризовать тяжесть заболевания. У больных с РШМ повышеный уровень miR-20а, miR-203, miR1246, miR-2392, miR-3147 и miR-4484, наоборот, сниженный уровень miR-218 ассоциируется с переходом РШМ в стадию метастазирования. Больные с повышенным уровнем экспрессии miR-224 или низким уровнем miR-145 в биопсийном материале цервикального рака чаще имеют метастазы в лимфатических узлах, более агрессивное течение заболевания и плохой прогноз выживаемости. Уровень экспрессии определенных микроРНК может служить маркером эффективности терапии заболевания. МикроРНК miR-146*, miR-542-3р и miR-664 специфически выявляются в сыворотке больных с РШМ, исчезают после оперативного лечения. Успешно проведенная химиотерапия сопровождается исчезновением из плазмы специфических для РШМ циркулирующих микроРНК miR-425-5p, miR-93-5p. Уровень экспрессии микроРНК позволяет оценивать эффективность новых лекарственных средств при лечении РШМ. Более того, синтетические молекулы на основе микроРНК открывают новые возможности таргентной терапии как предраковых, так и раковых заболеваний.



