По данным ВОЗ, вклад герпетической инфекции (ГИ) в формирование здоровья населения постоянно нарастает [1]. Это связано с высоким уровнем инфицированности вирусом простого герпеса (ВПГ) 1, 2 типов, вирусами герпесгруппы, в том числе ростом рецидивирующих форм ГИ (РГИ) и разнообразием клинических проявлений, способностью вызывать патологию беременности, плода и тяжелые заболевания новорожденных [2–4].
Рецидивы ГИ во время беременности сопровождаются провоспалительным состоянием, напряжением адаптивного и супрессией врожденного иммунитета, патологической альтерацией цитокинами, активированными иммуноцитами, антителами и циркулирующими иммунными комплексами эмбрио(фето)плацентарной системы с ранних сроков беременности [5–7]. Учитывая патогенетические механизмы, связанные с РГИ, актуальным является поиск высокоэффективных методов профилактики рецидивов герпеса, отвечающих принципам перинатальной фармакологии [8–10].
Механизм действия отечественного препарата цитокиноподобного пептида с противогерпетической активностью «Аллокин-альфа»(Аллоферон) обусловлен стимулирующим воздействием на систему естественных киллеров, интерфероновый статус и систему Т-клеточного иммунитета, усилением распознавания вирусных антигенов и инфицированных клеток натуральными киллерами, нейтрофилами и другими эффекторными системами естественного иммунитета, ответственными за элиминацию вируса [11]. Именно такой механизм действия особенно актуален при лечении РГИ. В отличие от известных индукторов интерферонов (ИНФ), длительное применение которых при постоянно рецидивирующих инфекциях может приводить к формированию вторичных иммунодефицитов, негативным отдаленным онкопоследствиям, препарат «Аллокин-альфа» выступает в качестве кофактора, позволяя продуцирующим ИНФ лейкоцитам эффективно реагировать на вирусный антиген [12]. Это дает возможность сфокусировать эффект препарата в месте размножения вируса и избежать избыточной реакции лейкоцитов за пределами очага инфекции [13]. Препарат, за счет своего механизма действия, обеспечивает эффективное иммуноопосредованное подавление вирусной инфекции, в том числе гирпетической, доступен для населения.
Цель исследования – оценить эффективность противовирусной иммуномодулирующей терапии на прегравидарном и антенатальном этапах при РГИ средней и тяжелой степени в отношении реализации гестационных и перинатальных осложнений.
Материалы и методы
В проспективное исследование были включены 414 женщин с РГИ средней и тяжелой степени тяжести с высоким риском внутриутробного инфицирования (ВУИ) плода ВПГ, планирующих беременность, и их новорожденные. В 1-ю группу (основную) вошли 112 женщин, которым профилактика рецидивов осуществлялась в два этапа по схеме: на прегравидарном этапе за 4–6 месяцев до планируемой беременности в период рецидива ГИ назначали препарат «Аллокин-альфа» (ООО «Аллоферон», Россия, рег. № Р N002829/01 от 16.01.2009) п/к 1 мг 1 раз в 48 ч № 6 и препарат «Ацикловир»(ООО «Кировская Фармацевтическая Компания», Россия, рег. № ЛС-002612 от 23.03.2012) по 200 мг 5 раз в день per os 10 дней; через 1 месяц после первого курса лечения аллофероном проводили клинико-лабораторный контроль – при необходимости препарат «Аллокин-альфа» назначался повторно (с 1-го дня цикла) п/к 1 мг 1 раз в 48 ч, № 6; на антенатальном этапе в 24–26 недель беременности применялся препарат человеческий рекомбинантный «Интерферон альфа-2b» (ООО «Ферон», Россия, рег. № P N000017/01 от 06.10.2010) по 1 свече – 500 000 МЕ 2 раза в день каждые 12 ч per rectum, курс 5 дней; в 32–34 недели беременности проводили контроль показателей неспецифического и специфического иммунитета – при отклонении лабораторных показателей назначали повторный курс. Во 2-ю группу (сравнения) включили 164 женщины, которым в прегравидарном периоде и во время беременности проводили только местную и/или эпизодическую системную химиотерапию препаратом «Ацикловир» в период рецидива герпеса. В 3-ю группу (сравнения) были включены 138 женщин, которые отказались от проведения каких-либо лечебно-профилактических мероприятий во время беременности, при этом до беременности в период рецидива ГИ проводилась местная и/или эпизодическая системная противовирусная химиотерапия препаратом «Ацикловир». Группу контроля составили 30 здоровых женщин с физиологическим течением гестации.
Критерием включения в группы исследования являлось наличие у женщин РГИ средней и тяжелой степени тяжести, диагностированной с учетом анамнеза рецидивов ГИ и подтвержденной клинически и лабораторно с исследованием крови, мазка из цервикального канала методами полимеразной цепной реакции (ПЦР) и иммуноферментного анализа (ИФА). Критерии исключения: тяжелая экстрагенитальная патология, врожденные и генетические заболевания, специфические инфекции и инфекции, передающиеся половым путем, вследствие их схожего с ГИ влияния на течение беременности и плод. В связи с потерями беременности на ранних сроках, на фоне рецидивов ГИ, из исследования после I триместра выбыли: во 2-й группе – 38 (23,1%) женщин и в 3-й группе – 34 (24,6%) женщины. Следовательно, под наблюдением во II и III триместрах находились 342 беременные с РГИ (1-я группа – 112 женщин, 2-я – 126, 3-я – 104). Результаты оценки медико-социальных факторов показали, что характеристика акушерского анамнеза, менструальной функции, частота экстрагенитальной и гинекологической патологий, возраст, профессиональная принадлежность, социальный статус и тяжесть клинического течения РГИ у женщин трех групп сравнения были сходными. Это позволило считать группы сравнения сопоставимыми.
Эффективность противорецидивной терапии оценивали путем контроля частоты рецидивов ГИ, течения беременности, состояния фетоплацентарного кровотока (ФПК), оценки соматического здоровья новорожденных. Для диагностики плацентарной недостаточности (ПН) и степени ее тяжести применяли комплексную балльную шкалу оценки степени тяжести ПН с расчетом итогового показателя [14]. Комплексную оценку специфического (иммуноглобулины (Ig) IgM, IgG к предранним белкам (IgGр), IgG к поздним белкам (IgGп) и их авидность), неспецифического (сыв. ИНФ, спон. ИНФ, индуц. ИНФ-α, индуц. ИНФ-γ, фактор некроза опухоли альфа (ФНОα), ИЛ-10) иммунитета у женщин групп сравнения осуществляли на прегравидарном этапе и в III триместре беременности (32–34 недели). Использованы тест-системы «Вектор ВПГ-IgG, ВПГ-IgM» (АО «Вектор-Бест», РФ), ООО «Цитокин» (РФ), «Диатех-ЭМ» (РФ), «МедБиоСпектр» (РФ).
Все дети, родившиеся от женщин групп сравнения, по результатам исследования специфического иммунитета (ПЦР, ИФА), были распределены на пять групп: 1-ю группу составили 111 новорожденных без ВУИ от матерей, получавших противовирусную иммуномодулирующую терапию; 2-ю – 101 новорожденный без ВУИ от матерей, получавших местную и эпизодическую системную терапию препаратом «Ацикловир»; 3-ю – 67 новорожденных без ВУИ от матерей, отказавшихся от проведения антенатальных профилактических мероприятий; 4-ю – 46 новорожденных с ВУИ ВПГ; 5-ю – 17 новорожденных с внутриутробной реализацией ГИ. Состояние здоровья новорожденных оценивали путем анализа историй развития новорожденного (форма N 097/у).
Статистический учет собранного материала проводили с помощью электронной таблицы Microsoft Office Excel. Обработку результатов осуществляли с применением программы IBM SPSS Statistics 25 (USA, лицензия № 5725-А54). Изучаемые в работе количественные признаки (частота рецидивов, показатели неспецифического иммунитета) имели распределение, отличающееся от нормального, поэтому описательные статистики представлены в виде медианы (Ме) и межквартильного интервала [25–75 квартиль]. Для сравнения независимых групп использовали дисперсионный анализ Краскела–Уоллиса с последующими межгрупповыми сравнениями по критерию Манна–Уитни с поправкой Бонферрони. Для сравнения зависимых групп (до и после лечения) применяли парный критерий Вилкоксона. Для исследования взаимосвязей применяли корреляционный анализ Спирмена. Качественные показатели представлены как в абсолютных, так и относительных величинах. Для расчета статистической значимости различий качественных признаков применяли критерий хи-квадрат Пирсона (χ2), в случае четырехпольной таблицы – с поправкой Йетса. Оценку результативности профилактических мероприятий проводили путем расчета показателей размера эффекта: ЧИЛ – частота исходов в группе превентивного лечения (А/А+В); ЧИК – частота исходов в группе сравнения (С/С+D); ОР – относительный риск (ЧИЛ/ЧИК); СОР – снижение относительного риска ((ЧИЛ–ЧИК)/ЧИК); САР – снижение абсолютного риска (ЧИЛ–ЧИК); ЧБНЛ – число больных, которым необходимо проводить превентивное лечение, чтобы предотвратить неблагоприятный исход у одного пациента (1/САР). Рассчитывался 95% доверительный интервал (95% ДИ). Во всех случаях результаты считали статистически значимыми при р<0,05 [15].
Дизайн исследования, проводимые превентивные мероприятия, статистическая обработка данных одобрены биоэтическим комитетом и центром доказательной медицины при ГБОУ ВПО СамГМУ МЗ РФ (протокол № 126 от 21.11.2012 г.).
Результаты и обсуждение
Под наблюдением в периконцепционном периоде находились 414 женщин с часто рецидивирующей ГИ. По данным анамнеза установлено, что у всех 414 обследованных женщин наблюдалась рецидивирующая форма ГИ в течение последнего года до включения в исследование (от 4 до 12 эпизодов обострений), что соответствует среднетяжелой (от 4 до 6 рецидивов в год) и тяжелой (свыше 6 рецидивов в год) ГИ – соответственно у 43 (38,4%) и 69 (61,6%) женщин в 1-й группе, 67 (40,9%) и 97 (59,1%) женщин во 2-й группе, 59 (42,8%) и 79 (57,2%) женщин в 3-й группе.
Результаты обследования женщин на маркеры ГИ за 4–6 месяцев до беременности и через 1 месяц после первого курса превентивной терапии препаратами «Аллокин-альфа» и «Ацикловир» представлены в табл. 1.

Из табл. 1 следует, что рецидивирующее течение ГИ до беременности наблюдалось у 100% обследованных женщин, о чем свидетельствует выявление IgG к предранним белкам (IgGр). Лабораторно подтвержденный рецидив ГИ на момент обследования (обнаружение ДНК ВПГ и IgМ, высокие (1:1600) титры поздних IgGп) наблюдался у 112 (100%) женщин в 1-й группе до лечения, у 104 (63,4%) женщин во 2-й группе и у 97 (70,3%) женщин в 3-й группе. Индекс авидности у всех женщин был более 60%, что свидетельствовало о хроническом течении ГИ. В 1-й группе после первого курса превентивной терапии препаратами «Аллокин-альфа» и «Ацикловир» уровень титров поздних IgG (IgGп) снизился (≤1:800), показатель IgM был отрицательным, ДНК вируса не определялась.
Ретроспективно, по результатам наблюдения за весь период беременности, было выявлено, что рецидивы ГИ в 1-й группе наблюдались только у 3 (2,7%) женщин, во 2-й – у 126 (100%) женщин, в 3-й – у 104 (100%) женщин. При этом частота рецидивов в 1-й группе не превышала одного случая за весь период беременности и характеризовалась быстрым купированием клинических проявлений. Во 2-й и 3-й группах частота рецидивов за весь период беременности составила 4 (3–6) и 4 (3–7) эпизода соответственно (статистическая значимость различий с 1-й группой по критерию Манна–Уитни p1-2<0,001, p1-3<0,001), с наиболее частым обострением ГИ в I триместре (во 2-й группе – 2 (1–2) и в 3-й группе – 2 (1–2) эпизода) и в III триместре (во 2-й группе – 2 (1–3) и в 3-й группе – 2 (2–3) эпизода) беременности.
Частота осложнений гестации на ранних и поздних сроках у женщин основной группы и групп сравнения представлена в табл. 2.
У беременных 2-й и 3-й групп в 10,3% (13/126) и 11,5% (12/104) наблюдений имел место антифосфолипидный синдром (АФС), сопровождающийся клинической картиной тяжелой преэклампсии (ПЭ) – у 23,1% (3/13) и 33,3% (4/12), прогрессирующей декомпенсированной (III степени тяжести) и критической формой (IV степени тяжести) ПН – у 53,8% (7/13) и 41,7% (5/12), преждевременной отслойкой нормально расположенной плаценты (ПОНРП) – 23,1% (3/13) и 25% (3/12) соответственно.
Анализ гестационных осложнений показал отсутствие в 1-й группе такой патологии, как самопроизвольный аборт, тяжелая ПЭ, хроническая гипоксия плода, маловодие, многоводие, ПОНРП, статистически значимое снижение частоты раннего токсикоза среднетяжелой степени, угрозы прерывания беременности, умеренной ПЭ, ПН, задержки роста плода (ЗРП), преждевременных родов, предлежания плаценты, преждевременного излития околоплодных вод, что подтверждает благоприятное влияние этапной противовирусной иммуномодулирующей терапии на эмбрио(фето)плацентарный комплекс и организм беременной в целом. Низкая частота акушерской патологии у женщин 1-й (основной) группы объясняет статистически значимое снижение оперативного родоразрешения путем операции кесарева сечения (КС; 17,9% против 75,4% (χ21-2=78,61; p1-2<0,001) и 73,1% (χ21-3=66,6; p1-3<0,001)). Осложнения беременности во 2-й и 3-й группах, на наш взгляд, связаны с рецидивирующим течением ГИ средней и тяжелой степени тяжести и напряжением адаптивного иммунитета, несостоятельностью интерферонового звена, высокой активностью провоспалительных цитокинов до и во время беременности (рис. 1).
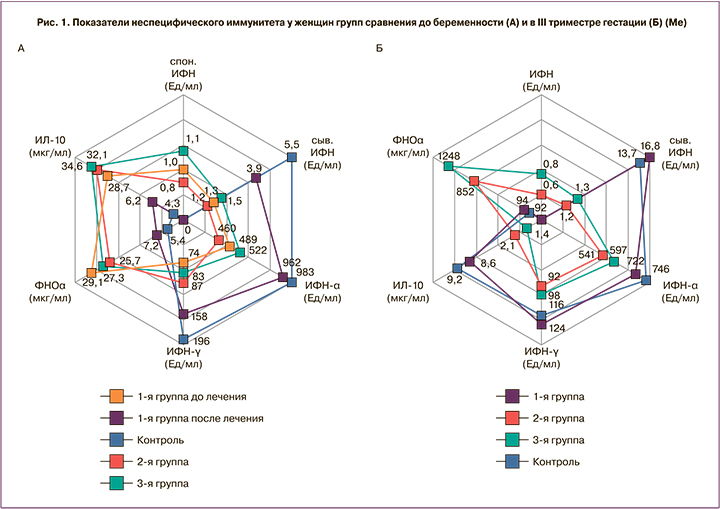
На рис. 1 в сравнительном аспекте представлены изменения ИФН-статуса у женщин групп сравнения на прегравидарном этапе и в III триместре беременности в зависимости от подходов к профилактике рецидивов ГИ. В 1-й (основной) группе отмечена положительная динамика после применения противовирусной иммуномодулирующей терапии на прегравидарном этапе – значения показателей ИФН-α (962 [741–1182] Ед/мл), ИФН-γ (158 [104–268] Ед/мл), сыв. ИФН (3,9 [3,1–6,2] Ед/мл) повысились относительно данных, зафиксированных до лечения (ИФН-α (489 [317–587] Ед/мл; p=0,002), ИФН-γ (74 [46–92] Ед/мл; p=0,003), сыв. ИФН (1,3 [0,8–1,7] Ед/мл; p<0,001), в III триместре уровни ИФН-α (772 [654–948] Ед/мл), ИФН-γ (124 [92–215] Ед/мл), сыв. ИФН (16,8 [8,4–19,7] Ед/мл) статистически значимо не различались с контрольными значениями (ИФН-α (746 [654–1016] Ед/мл; p1-к=0,54), ИФН-γ (116 [98–201] Ед/мл; p1-к=0,69), сыв. ИФН (13,7 [6,2–17,9] Ед/мл; p1-к=0,97), что свидетельствует о нормализации показателей неспецифического иммунитета при проведении этапной превентивной терапии по разработанному методу. Во 2-й и 3-й группах в прегравидарном периоде регистрировались более низкие значения показателей интерферонового статуса, по сравнению с контролем: ИНФ-α (460 [312–580] Ед/мл и 522 [394–637] Ед/мл соответственно 2-й и 3-й группам против 983 [743–1125] Ед/мл в контрольной группе – p2-к<0,001; p3-к=0,002), ИНФ-γ (87 [62–114] Ед/мл и 83 [58–108] Ед/мл соответственно против 196 [116–237] Ед/мл; p2-к<0,001; p3-к<0,0010,03) и сыв. ИНФ (1,2 [0,6–2,1] Ед/мл и 1,5 [0,8–1,9] Ед/мл соответственно против 5,5 [2,5–7,4] Ед/мл; p2-к<0,001; p3-к<0,001), при этом в крови обнаруживался спон. ИФН (0,8 [0,4–1,1] Ед/мл и 1,1 [0,8–1,7] Ед/мл соответственно 2-й и 3-м группам), который в норме не определяется. В III триместре гестации уровни исследованных ИНФ были значительно ниже, чем в 1-й группе и группе контроля: ИНФ-α (541 [443–638] Ед/мл и 597 [478–682] Ед/мл соответственно 2-й и 3-м группам; p1-2=0,004, p1-3=0,005; p2-к=0,007; p3-к=0,008), ИНФ-γ (92 [76–128] Ед/мл и 98 [79–124] Ед/мл соответственно; p1-2=0,01; p1-3=0,01; p2-к=0,03; p3-к=0,03) и сыв. ИНФ (1,2 [0,7–2,1] Ед/мл и 1,3 [0,9–2,4] Ед/мл соответственно; p1-2<0,001; p1-3<0,001; p2-к<0,001; p3-к<0,001), при этом в крови обнаруживался спон. ИФН (0,6 [0,2–0,9] Ед/мл и 0,9 [0,4–1,6] Ед/мл соответственно 2-й и 3-й группам). Полученные данные по 2-й и 3-й группам свидетельствуют об исходной дефектности системы ИФН при наличии персистирующей инфекции и нарастании иммунодефицита у беременных женщин с рецидивирующим течением ГИ к концу беременности. Высокие показатели прои противовоспалительных цитокинов до беременности напрямую влияют на развитие ранних гестационных осложнений, а их дисбаланс в III триместре беременности способствует формированию поздних осложнений.
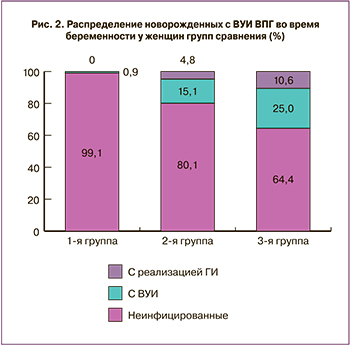 Обследование новорожденных на предмет ВУИ ВПГ показало, что в 1-й группе инфицирование без клинической реализации врожденного герпеса имело место в 1 (0,9%) наблюдении, во 2-й группе – в 19 (15,1%), в 3-й группе – в 26 (25%): χ21-2=13,72; p1-2<0,001; χ21-3=26,49; p1-3<0,001; χ22-3=3,56; p2-3=0,06. Клиническая картина неонатального герпеса наблюдалась во 2-й группе у 6 (4,8%) новорожденных, в 3-й группе – у 11 (10,6%), в 1-й группе – ни в одном из наблюдений (χ21-2=3,7; p1-2=0,055; χ21-3=10,39; p1-3=0,002; χ22-3=2,03, p2-3=0,16). Высокая частота инфицирования плода во 2-й (25/126 – 19,9%) и 3-й (37/104 – 35,6%) группах связана с частыми рецидивами герпеса во время беременности (положительная сильная корреляционная связь: r от 0,81 до 0,94, при p<0,001) и повреждающим действием вируса на плаценту, что способствует снижению ее защитных свойств, а следовательно, ВУИ и, в ряде случаев, внутриутробной реализации ГИ. Распределение новорожденных с ВУИ ВПГ во время беременности у женщин групп сравнения представлено на рис. 2.
Обследование новорожденных на предмет ВУИ ВПГ показало, что в 1-й группе инфицирование без клинической реализации врожденного герпеса имело место в 1 (0,9%) наблюдении, во 2-й группе – в 19 (15,1%), в 3-й группе – в 26 (25%): χ21-2=13,72; p1-2<0,001; χ21-3=26,49; p1-3<0,001; χ22-3=3,56; p2-3=0,06. Клиническая картина неонатального герпеса наблюдалась во 2-й группе у 6 (4,8%) новорожденных, в 3-й группе – у 11 (10,6%), в 1-й группе – ни в одном из наблюдений (χ21-2=3,7; p1-2=0,055; χ21-3=10,39; p1-3=0,002; χ22-3=2,03, p2-3=0,16). Высокая частота инфицирования плода во 2-й (25/126 – 19,9%) и 3-й (37/104 – 35,6%) группах связана с частыми рецидивами герпеса во время беременности (положительная сильная корреляционная связь: r от 0,81 до 0,94, при p<0,001) и повреждающим действием вируса на плаценту, что способствует снижению ее защитных свойств, а следовательно, ВУИ и, в ряде случаев, внутриутробной реализации ГИ. Распределение новорожденных с ВУИ ВПГ во время беременности у женщин групп сравнения представлено на рис. 2.
Интересные результаты получены при ретроспективном анализе течения беременности, состояния ФПК у наблюдаемых женщин, дети которых были распределены на 5 групп сравнения в зависимости от результатов этапной противорецидивной профилактики в прегравидарном и антенатальном периодах. Данные о частоте осложнений беременности и патологии ФПК у матерей новорожденных групп сравнения представлены в табл. 3.
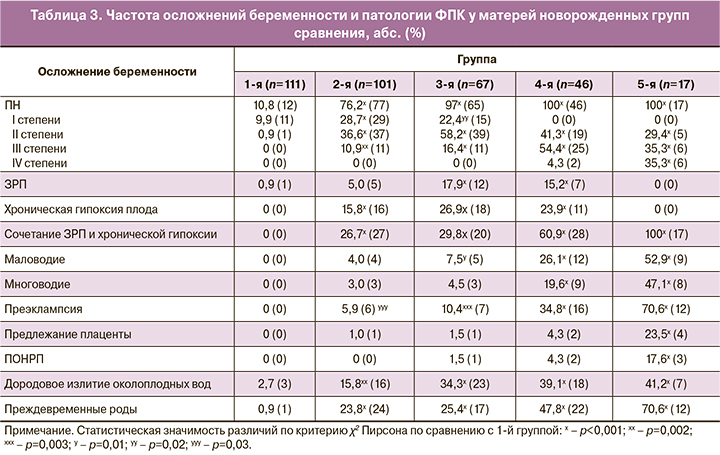
Анализ данных табл. 3 показывает высокую частоту поздних гестационных осложнений, ПН, в том числе ассоциированной с тяжелыми формами ПН патологии плода, во 2-й, 3-й, 4-й и 5-й группах новорожденных. В 1-й группе наблюдались единичные случаи ПН – 10,8% (в основном дисфункция плаценты – 9,9%, 1 (0,9%) наблюдение – ЗРП I степени), преждевременных родов – 0,9%, что связано с благоприятным течением гестации на фоне этапной противорецидивной терапии. Все 3 наблюдения дородового излития околоплодных вод в 1-й группе беременных с РГИ не сопровождались ВУИ плода и реализацией ГИ.
Исходя из данных табл. 3, очевидна связь ВУИ новорожденных 4-й группы и врожденного герпеса у новорожденных 5-й группы с тяжелыми формами гестационной патологии, развившейся на фоне частых рецидивов ГИ среднетяжелой степени тяжести. По сравнению с неинфицированными новорожденными 1-й, 2-й, 3-й групп, у беременных, дети которых пострадали от ВУИ и врожденной ГИ, тяжелые формы ПН диагностированы чаще в 2,8 (100% против 35,5%; p<0,001) раза, ЗРП в сочетании с ХГП – в 4,3 (71,4% против 16,8%; p<0,001) раза, патология функции амниона – в 11,2 (60,3% против 5,4%; p<0,001) раза, аномалии положения и прикрепления плаценты – в 15,9 (17,5% против 1,1%; p<0,001) раза, ПЭ – в 9,4 (44,4% против 4,7%; p<0,001) раза, преждевременные роды – в 3,6 (54,0% против 15,1%; p<0,001) раза, дородовое излитие околоплодных вод – в 2,6 (39,7% против 15,1%; p<0,001) раза. Полученные данные подтверждают патогенетические механизмы реализации гестационной патологии при РГИ средней и тяжелой степени тяжести (иммунный, системный и внутриклеточный воспалительный ответ, оксидативный и эндоплазматический ретикулярный стресс, метаболические, эндотелиально-гемостазиологические, гемодинамические, нарушение апоптоза и пролиферативной активности, плацентарного энергообмена, альтерация ФПК) и позволяют рассматривать тяжелые осложнения беременности и патологию плода в качестве факторов риска ВУИ плода ВПГ.
У новорожденных, матери которых получали этапную профилактическую терапию по разработанному методу, отмечалось снижение частоты развития такой патологии, как нарушение адаптации (10,8% против 78,2%, 95,5%, 100%, 100% соответственно 2-й, 3-й, 4-й, 5-й группам; p<0,001), гипотрофия (0,9% против 14,9%, 14,9%, 100%, 100% соответственно; p<0,001), перинатальное поражение ЦНС (0,9% против 45,5%, 58,2%, 100%, 100%; p<0,001), анемия (8,1% против 36,7%, 31,1%, 100%, 100%; p<0,001). Доказана высокая положительная корреляционная связь между частотой осложнений гестации у герпес-инфицированных женщин и развитием соматической патологии у новорожденных (r от 0,74 до 0,89, при p<0,05). Такие патологии, как кисты сосудистых сплетений, кальцинаты головного мозга, энцефалит, гидроцефалия, хориоретинит, герпетическая экзема, отмечались у детей с подтвержденным ВУИ и отнесены к герпес-ассоциированной патологии в связи с высокой специфичностью в отношении ГИ (более 90%).
Для оценки результативности превентивного лечения рассчитывали показатели размера эффекта с применением четырехпольной таблицы, где сравнивались 1-я и 3-я группы в отношении развития ПН, как наиболее частого гестационного осложнения: A – 13 женщин 1-й группы с ПН, B – 99 женщин без ПН, С – 102 женщины 3-й группы с ПН, D – 2 женщины без ПН; в отношении ВУИ ВПГ: A – 1 ребенок из 1-й группы с ВУИ, B – 111 детей без ВУИ, С – 37 детей 3-й группы с ВУИ, D – 67 детей без ВУИ. При сравнении 2-й и 3-й групп в отношении развития ПН: A – 102 женщины 2-й группы с ПН, B – 24 женщины без ПН, С – 102 женщины 3-й группы с ПН, D – 2 женщины без ПН; в отношении ВУИ ВПГ: A – 25 детей из 2-й группы с ВУИ, B – 101 ребенок без ВУИ, С – 37 детей 3-й группы с ВУИ, D – 67 детей без ВУИ.
Показатели размера эффекта разработанного метода профилактики в отношении реализации ПН и ВУИ плода представлены в табл. 4.
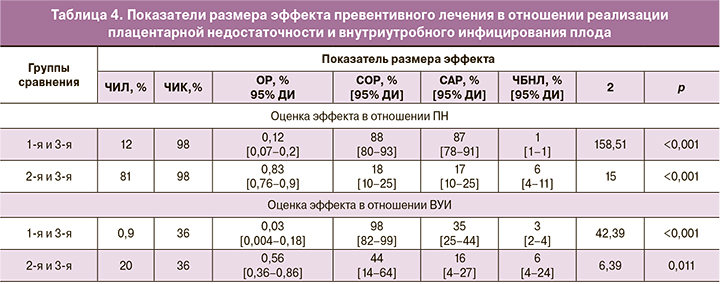
Размер эффекта профилактического лечения в 1-й группе по сравнению со 2-й группой в отношении ПН выше по показателю ЧБНЛ в 6 раз, по показателю ОР – в 6,9 раза; в отношении внутриутробного инфицирования – выше по показателю ЧБНЛ в 2 раза, по показателю ОР – в 18,7 раза. Ключевые показатели размера эффекта объективизируют преимущества метода этапной профилактики с применением противовирусной иммуномодулирующей терапии по снижению гестационной и перинатальной патологии при часто рецидивирующем герпесе, по сравнению с противовирусной эпизодической системной химиотерапией.
Заключение
Таким образом, рецидивирующее течение ГИ во время беременности способствует структурно-функциональным нарушениям в эмбрио(фето)плацентарной системе с ранних сроков беременности, развитию поздних гестационных и фетальных осложнений, что предопределяет характер течения постнатального периода.
Периконцепционное противорецидивное действие препарата «Аллокин-альфа» за счет нивелирования клинико-лабораторного обострения герпеса на прегравидарном этапе нормализует ключевые гестационные процессы (нидация, инвазия, плацентация), что подтверждается отсутствием ранних репродуктивных потерь и снижением частоты ранних гестационных осложнений, определяя последующее течение беременности; дополнительная антенатальная коррекция активности ГИ усиливает эффективность по снижению реализации поздних гестационных и перинатальных осложнений, что подтверждает механизмы фетопротекции предлагаемого этапного метода профилактики.
На основании полученных результатов можно констатировать, что разработанный этапный метод профилактики гестационной и перинатальной патологий, ВУИ плода ВПГ у женщин с часто рецидивирующей ГИ, предусматривающий прегравидарные и антенатальные курсы превентивного лечения, показал высокую эффективность по сравнению со стандартным способом противогерпетической химиотерапии. Представленные подходы к предикции и превенции у беременных с рецидивирующим течением ГИ отвечают требованиям модели «4П-медицины».



