По определению Всемирной Организации Здравоохранения (ВОЗ), доброкачественная дисплазия молочной железы (ДДМЖ), синонимом которой является фиброзно-кистозная мастопатия (ФКМ) – это дисгормональный гиперпластический процесс в молочной железе, характеризующийся широким спектром пролиферативных и регрессивных изменений с нарушением соотношения эпителиального и соединительнотканного компонентов (ВОЗ, 1984 г.).
Регуляция нормального роста, развития и функции ткани молочной железы происходит под влиянием комплексного взаимодействия половых стероидов, гормонов гипофиза, в том числе фолликулостимулирующего гормона, лютеонизирующего гормона, пролактина, гормонами надпочечников, щитовидной железы и т.д. [1, 2]. Молочная железа – своеобразный интракринный, гормонально-зависимый орган, в котором есть все необходимые ферменты для локального синтеза и метаболизма стероидных гормонов [3]. Тканевой гомеостаз в молочной железе поддерживается за счет процессов пролиферации, дифференцировки и апоптоза. Избыточная и/или атипическая пролиферация эпителиальных клеток, считается в настоящее время важнейшей характеристикой фиброзно-кистозной болезни, имеющей прогностическое значение. Полагают, что клинические проявления мастопатии встречаются у 60%, а гистологические трансформации у 90% женщин старше 30 лет [1, 4].
Впервые в 2017 г. согласно NCCN (National Comprehensive Cancer Network) в глобальные факторы риска развития РМЖ (женский пол, возраст, семейная история РМЖ в молодом возрасте, раннее менархе и поздняя менопауза, поздние первые роды, длительная менопаузальная гормональная терапия, лучевая терапия грудной клетки в анамнезе, повышенная маммографическая плотность, генетические мутации – BRCA 1/2) включены доброкачественные пролиферативные заболевания молочной железы. Таким образом, очевидно, что своевременная диагностика и патогенетическое лечение доброкачественной дисплазии молочной железы может снизить риск развития РМЖ [5–7].
Клинические проявления ДДМЖ весьма разнообразны – болевой синдром в молочной железе, чувство распирания, увеличение объема. Повышение плотности и неоднородности структур ткани способствуют формированию узловых пролифератов и кист. Уплотнения и узловые образования, самопроизвольные выделения из соска, а также общие проявления, такие как раздражительность, повышенная нервная возбудимость, чувство страха варьируют в течение менструального цикла и нередко усиливаются в предменструальном периоде [8].
В основе патогенеза мастопатии лежит нарушение центральной регуляции функций гипоталамо-гипофизарной системы, яичников, надпочечников и щитовидной железы, приводящее к изменению соотношения уровня эстрогенов и прогестерона.
В настоящее время целью патогенетически обоснованного подхода к лечению ДДМЖ считается устранение дисбаланса эстрогенов и прогестерона. Нарушение соотношения эстрадиола и прогестерона в ткани молочной железы приводит к развитию функциональных нарушений, а в дальнейшем и к морфологическим изменениям, причем ведущая роль в возникновении фиброзно-кистозной болезни принадлежит не столько абсолютному увеличению эстрогенов, сколько относительной гиперэстрогении, вследствие недостатка продукции прогестерона во второй фазе менструального цикла.
Гормональный дисбаланс в ткани молочной железы в сторону дефицита прогестерона вызывает морфофункциональную перестройку, сопровождается отеком и гипертрофией внутридольковой соединительной ткани. Избыточная пролиферация эпителия при сохраненной секреции протоков, приводящая к их обструкции, увеличивает объем альвеол и формирует кистозные полости [4, 6, 7].
К сожалению, большинство традиционных подходов к лечению мастопатии не учитывает патогенетические особенности дисплазии молочной железы и ограничивается назначением средств симптоматического действия.
Препаратов патогенетического действия для лечения мастопатии, воздействующих на факторы риска рака молочной железы, сегодня немного.
Одним из них является трансдермальный микронизированный прогестерон.
Он является абсолютным аналогом эндогенного прогестерона, вырабатываемого яичниками и применяется трансдермально в виде геля. При нанесении на кожу молочной железы препарат корректирует относительную гиперэстрогению и нормализует локальные дисгормональные нарушения, с таргетной доставкой действующего вещества непосредственно к ткани молочной железы, не оказывая системного эффекта [2, 9, 10]. Благодаря этому терапевтический уровень прогестерона достигается с использованием минимального количества препарата, не оказывающего влияния на общий профиль половых стероидов, позволяет избежать нежелательных побочных эффектов [10–13].

Прогестерон снижает экспрессию рецепторов эстрогенов в ткани молочной железы, уменьшает локальный уровень активных эстрогенов посредством стимуляции продукции ферментов (17бета-гидроксистероиддегидрогеназы и эстронсульфотрансферазы), окисляющих эстрадиол в менее активный эстрон, и затем, связывая последний, трансформирует его в неактивный эстронасульфат. Таким образом, прогестерон ограничивает пролиферативное действие эстрогенов, нормализует соотношение их метаболитов в ткани молочной железы. Также прогестерон обладает небольшим натрийуретическим эффектом за счет угнетения канальцевой реабсорбции и увеличения клеточной фильтрации, тем самым предотвращая задержку жидкости при секреторных преобразованиях железистого компонента ткани молочной железы и последующего развития болевого синдрома (масталгии или мастодинии). Наряду с этим, трансдермальный способ введения гестагена позволяет воздействовать на состояние железистого эпителия и сосудистой сети, в результате чего снижается проницаемость капилляров, следовательно, уменьшается степень отека и исчезают симптомы масталгии [9, 14, 15].
При трансдермальном способе применения действие Прожестожеля максимально приближено к ткани молочной железы, не разрушаясь в печени и не оказывая неблагоприятных системных эффектов на организм. Исследование сывороточной концентрации пролактина, эстрадиола и прогестерона при лечении прожестожелем показало, что через час после нанесения препарата, когда наблюдается его максимальное всасывание в ткани, уровень гормонов практически не меняется и позволяет уменьшить применяемую дозу препарата при высокой концентрации в зоне действия (в 10 раз выше, чем в системном кровотоке) [2, 9, 11].
 По результатам ряда ранее проведенных исследований была доказана эффективность применения препарата прожестожель при различных формах мастопатии.
По результатам ряда ранее проведенных исследований была доказана эффективность применения препарата прожестожель при различных формах мастопатии.
Для получения новых данных в отношении применения микронизированного прогестерона в рутинной клинической практике с целью терапии фиброзно-кистозной мастопатии было проведено многоцентровое наблюдательное исследование БРЕСТ. Цель данного исследования – оценить динамику регрессии симптомов фиброзно-кистозной мастопатии при применении монотерапии гелем прожестожель в непрерывном режиме в течение 3 и 6 месяцев в условиях рутинной клинической практики.
Материалы и методы
В многоцентровое наблюдательное исследование БРЕСТ включено 1044 пациенток 34,8±0,2 лет с диагнозом диффузной мастопатии с преобладанием железистого компонента и диффузной фиброзно-кистозной мастопатии с преобладанием кистозного компонента. Все пациентки получали терапию трансдермальным гелем микронизированного прогестерона (препаратом прожестожель) при наличии соответствующих показаний, описанных в инструкции по медицинскому применению лекарственного препарата. Наблюдение за пациентами велось в 96 исследовательских центрах России.
Критериями включения в исследование служили: пациентки в возрасте старше 18–45 лет с сохраненной менструальной функцией; жалобы на циклические боли и/или напряжение в молочной железе; диагноз диффузной мастопатии с преобладанием железистого компонента (аденоз) или диффузной фиброзно-кистозной мастопатии с преобладанием кистозного компонента подтвержден клинически и ультразвуковым исследованием и/или маммографией; отсутствие применения гормональных средств не менее чем за 3 месяца до включения в программу; пациентки, подписавшие форму информированного согласия; решение врача о назначении препарата прожестожель принималось независимо до включения пациентки в исследование.
Критерии невключения в исследование: противопоказания, перечисленные в инструкции по медицинскому применению препарата прожестожель.
Наблюдение за пациентками проводилось в течение всего исследования. Каждая пациентка проходила 3 последовательных визита исследования: Визит 1 (включение в исследование), Визит 2 (через 3 месяца), Визит 3 (через 6 месяцев). В ходе исследования фиксировались данные общего и медицинского анамнеза пациенток, оценивались данные относительно динамики симптомов фиброзно-кистозной мастопатии: выполнялся клинический осмотр молочной железы, проводилось ультразвуковое и маммографическое исследование, оценка по шкале BI-RADS. Также проводилась оценка интенсивности болевых ощущений в динамике с использованием визуально-аналоговой шкалы боли. Лечащими врачами оценивалась динамика симптомов с помощью шкалы общего клинического впечатления. Все выполняемые медицинские процедуры в рамках проведения исследования являлись рутинными, используемыми в повседневной клинической практике, что определило неинтервенционный (наблюдательный) характер исследования.
Первичной конечной точкой (на основании которой оценивалась эффективность проводимой терапии) являлась выраженность боли, связанной с фиброзно-кистозной мастопатией по визуально-аналоговой шкале боли (ВАШБ) на первичном визите, через 3 и 6 месяцев лечения. Безопасность оценивалась по анализу всех нежелательных явлений (НЯ) и серьезных нежелательных явлений (СНЯ), начиная с момента подписания участницей исследования информированного согласия до момента окончания участия в исследовании.
Статистический анализ данных выполнялся с использованием программ IBM SPSS 23 и MS Excel 2016. Демографические данные, данные исходного состояния рассчитывались в виде частот или процентного отношения, или при помощи среднего значения (стандартного отклонения), медианы (межквартильного размаха), минимума и максимума, в зависимости от типа переменной. Для проверки гипотезы об исходной однородности групп исследования было проведено тестирование нулевых гипотез при помощи парного t-критерия Стьюдента (для количественных показателей между зависимыми выборками с нормальным распределением в исследуемой популяции), критерия Уилкоксона для связанных выборок (для ординальных показателей или для интервальных показателей с распределением, отличающимся от нормального). Для сравнительного анализа данных о нежелательных явлениях были подвергнуты анализу следующие параметры: количество, выраженность и длительность НЯ/СНЯ на фоне применения препарата исследования (на основании случаев НЯ, зафиксированных в формах отчета о НЯ в ИРК).
Результаты исследования и их обсуждение
Демографические, антропометрические и клинико-анамнестические характеристики пациенток, принявших участие в исследовании БРЕСТ представлены в таблице 1.
Клинический осмотр молочных желез проводился до включения пациенток в исследование (на визите 1), данные представлены в таблице 2 в виде относительных значений количества наблюдаемых характеристик.
Следуя поставленным задачам исследования, после 3-х и 6 месяцев монотерапии препаратом прожестожель, пациентки с ДДМЖ приглашались на повторный визит с целью проведения клинико-инструментального обследования. Основной акцент был поставлен на объективную оценку динамических изменений ткани молочной железы по данным УЗИ и маммографии (УЗИ и маммографическое исследование молочных желез проводилось пациенткам 3 раза в течение исследования на каждом визите). Уже через 3 месяца непрерывного применения препарата прожестожель при УЗИ отмечено уменьшение числа выявленных участков уплотненной структуры, в том числе размерами 1–2 см и более 2 см (гиперплазированные дольки, кисты). На третьем визите (через 6 месяцев терапии) по результатам УЗИ прослежено дальнейшее уменьшение общего числа локальных изменений структуры в молочной железе размерами 1–2 см и более 2 см. Выявление анэхогенных структур через 6 месяцев монотерапии прожестожелем возросло с 66,5% до 78,4%, доля гипоэхогенных, гиперэхогенных снизилась в разы до 16,7% (при первом визите отмечена в 24,1%) и до 1,2% (при первом визите отмечена в 6,6%) соответственно. Аваскулярные структуры и нормальная васкуляризация отмечены у всех пациенток к третьему визиту. Признаков злокачественных новообразований ни у одной пациентки выявлено не было (табл. 3).
Через 6 месяцев терапии ДДМЖ пациенткам произведен маммографический контроль эффективности лечения. Аналогично результатам УЗИ, регистрировалась положительная динамика, благодаря чему перераспределилась доля выявленных рентгенологических изменений. Согласно анализу маммографических заключений доля жировой инволюции изменилась с 9,1% до 1,3%, очагового фиброза снижались с 12,9% до 5,3%; доля пациенток ДФКМ с преобладанием кистозного компонента сократилась на 22,4% (с 56,6% до 34,2%).
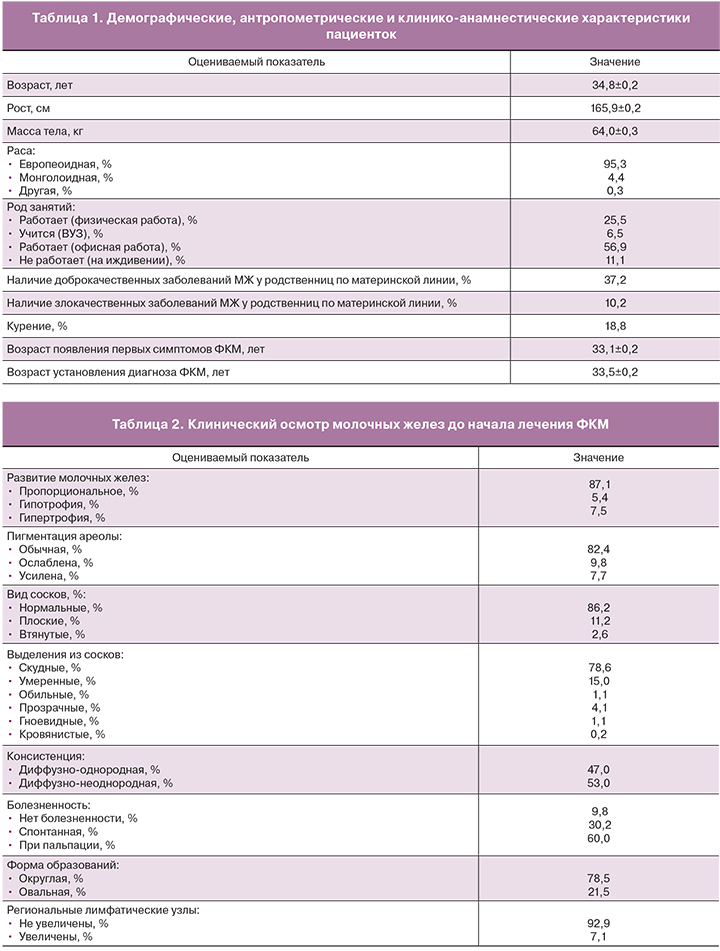
Существенное улучшение течения заболевания демонстрирует также динамика изменений по шкале Bi-RADS (рис. 1). До лечения по Bi-RADS 1 оценивались 23,5%, по Bi-RADS 2 – 76,5% пациенток, тогда как через 3 и 6 месяцев лечения наблюдалось достоверное изменение: Bi-RADS 1 – 34,3% и 48,3%, Bi-RADS 2 – 65,7% и 51,7% соответственно (p<0,05), что свидетельствует об эффективности проводимой терапии.
Оценка интенсивности боли в молочной железе оценивалась в динамике в баллах с помощью визульно-аналоговой шкалы боли. Полученные результаты демонстрируют достижения первичной конечной точки. Средний балл по ВАШБ достоверно уменьшался в динамике и составил: до лечения (визит 1) 62,22±0,84 балла – через 3 месяца (визит 2) 27,33±0,70 балла (p<0,001), через 6 месяцев (визит 3) 9,33±0,46 балла (p<0,001).
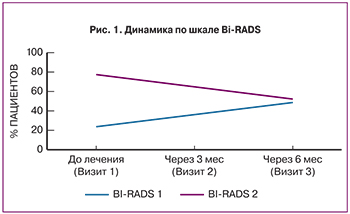
Динамика изменения симптомов заболевания, оцениваемая лечащими врачами с помощью шкалы общего клинического впечатления (ШОКВ), показала высокие оценки в достижении терапевтического эффекта, что также свидетельствовало об эффективности проводимой терапии (рис. 2).
Также в исследовании была доказана безопасность проводимой терапии, оцениваемая по анализу всех нежелательных явлений (НЯ) и серьезных нежелательных явлений (СНЯ), начиная с момента подписания участницей исследования информированного согласия до момента окончания участия в исследовании.
Заключение
В настоящем исследовании эффективность лечения ДДМЖ 1% гелем прогестерона оценивалась не только по субъективным ощущениям пациенток, но и по динамике объективных данных УЗИ и маммографии.
Снижение количества гипоэхогенных и гиперэхогенных структур молочной железы на фоне монотерапии трансдермальным прогестероном, уменьшение частоты очагового фиброза и кистозной трансформации, зарегистрированных при УЗИ и маммографии, являются клиническим подтверждением антипролиферативного эффекта трансдермального прогестерона, доказанного ранее морфологическими исследованиями.
Свойство трансдермального геля прогестерона подавлять избыточную пролиферацию тканей молочной железы выделяет его из множества препаратов, традиционно применяемых для лечения ДДМЖ, эффекты которых ограничиваются лишь симптоматическим действием.
Поскольку пролиферативные формы мастопатии достоверно повышают риск рака молочной железы, выбор патогенетической терапии ДДМЖ, уменьшающей действие факторов риска, представляется принципиально важным в свете задачи снижения заболеваемости раком молочной железы.



