Рак яичников занимает лидирующие позиции по уровню летальности от онкогинекологических заболеваний (20,9:100 000 населения) [1]. До 70% в структуре новообразований яичников составляет серозный гистотип высокой степени злокачественности (high grade) [2]. Активное выявление рака яичников возросло за 10 лет с 9,2 до 19,1 на 100 000 населения [3, 4], однако в 2018 г. лишь 37,4% пациентов подлежали радикальному хирургическому, 62,5% – комбинированному методам лечения [3]. По разным данным, в возрастной структуре пациентов с диагностированным злокачественным новообразованием яичника от 3 до 14% составляют женщины репродуктивного периода, причем более чем у 80% из них – распространенная стадия заболевания [5, 6]. В то время как популяционный скрининг экономически нецелесообразен, выявление более ранних стадий (I–II стадии по международной классификации Международной федерации гинекологов и акушеров – FIGO) заболевания ассоциировано с улучшением исходов, однако сопряжено с существенными сложностями в связи с асимптомным или малосимптомным течением, в связи с чем рак яичников диагностируется на поздних стадиях, выживаемость при которых не превышает 44%, что практически в 2 раза ниже по сравнению с 90% пятилетней выживаемостью после радикального лечения заболевания, выявленного на ранней стадии [1, 7, 8]. К сожалению, на сегодняшний день отсутствуют адекватные способы высокоточной ранней и предоперационной дифференциальной диагностики рака яичников, поэтому очевидна необходимость разработки новых и усовершенствования имеющихся неинвазивных методов объективной диагностики.
Современные методы анализа, такие как высокоэффективная жидкостная хроматография с масс-спектрометрическим детектированием (ВЭЖХ-МС), позволяют получать детальную информацию о молекулярном составе биологических образцов, что может быть использовано для выявления опухоли и оценки степени ее злокачественности уже в предоперационном периоде.
Процессы, сопряженные с канцерогенезом эпителиальных новообразований яичников, приводят к изменениям метаболома, в том числе липидного профиля сыворотки крови [1, 9]. К наиболее изученным относятся лизофосфолипиды (лизофосфатидилэтаноламин, лизофосфатидилинозитол) [1].
Рядом авторов была показана взаимосвязь молекулярных механизмов канцерогенеза и изменений липидома, которая может быть изучена с позиций как диагностики, так и предикции течения и исходов рака яичников высокой степени злокачественности. Более 95% случаев high-grade серозного рака яичника обусловлено мутацией гена-супрессора опухолевого роста р56 [10]. Белок, закодированный геном р53, взаимодействует с белками, связывающими стерол-регуляторные элементы, а также гуанидиноацетат-N-метилтрансферазой, что приводит к повышению экспрессии ферментов биосинтеза жирных кислот и холестерола и ингибированию окисления жирных кислот, что потенцирует анаболизм жирных кислот, рецидивирование и прогрессирование опухолевого процесса [11, 12].
ВЭЖХ-МС-анализ липидома плазмы крови пригоден не только для диагностики заболеваний [13], но и позволяет осуществлять мониторинг эффективности проводимого лечения [9], а также на предоперационном этапе прогнозировать риски рецидива заболевания, поскольку 25% всех случаев сопровождается резистентностью к лечению препаратами платины, отмечается высокий риск рецидивирования и прогрессирования [14].
Цель исследования: провести дифференциальную диагностику злокачественных и пограничных серозных новообразований яичников, а также исследовать наличие изменений липидома сыворотки крови после различных этапов лечения при помощи метода ВЭЖХ-МС.
Материалы и методы
В исследование включены 53 пациента с серозным раком яичников высокой степени злокачественности (РЯ ВСЗ) и серозными пограничными опухолями (ПОЯ), получившие хирургическое лечение в отделении инновационной онкологии и гинекологии ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России, и 10 наблюдаемых группы контроля. Группу диагностики составили пациенты, у которых ранее не было оперативных вмешательств на органах малого таза (n=33), группы мониторинга – пациенты после трех курсов неоадъювантной химиотерапии (НАХТ, n=7) по схеме «паклитаксел + карбоплатин», а также после нерадикального хирургического лечения (биопсия или резекция яичника, органосохраняющий объем оперативного вмешательства при устойчивом желании женщины реализовать репродуктивную функцию при отсутствии верификации злокачественного процесса, при несогласии на удаление единственного яичника), которые обратились для выполнения повторного оперативного вмешательства в связи с данными планового гистологического исследования (n=13) (рис. 1).
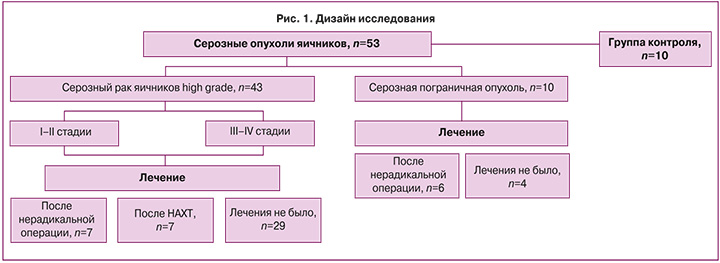
Критерии невключения: первично-множественный опухолевый процесс, эндометриоидная, серозные опухоли яичников, отличающиеся от пограничных и от опухолей high grade (светлоклеточная, герминогенная, гепатоидная, муцинозная и доброкачественная опухоли, опухоли низкой степени злокачественности – low grade), рак маточной трубы или первичный рак брюшины, наличие BRCA-мутации, сопутствующая патология (сахарный диабет, острый или хронический инфекционно-воспалительный процесс), беременность на момент взятия крови.
В группу контроля вошли женщины сопоставимого возраста, по данным скрининго-лабораторных методов диагностики, у которых не было получено данных о сопутствующей патологии.
Исследование было одобрено локальными этическими комитетами ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России и ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России. Перед включением в исследование пациенты подписывали информированное добровольное согласие.
С помощью модифицированного метода Фолча [15] из сыворотки экстрагировали липиды. Молекулярный состав образцов определяли с помощью ВЭЖХ-МС на жидкостном хроматографе Dionex UltiMate 3000 (Thermo Scientific, Германия), соединенном с масс-анализатором Maxis Impact qTOF (Bruker Daltonics, Германия). Разделение осуществлялось методом обращенно-фазовой хроматографии на колонке Zorbax C18 (150×2,1 мм, 5 мкм, Agilent, США). Использовали линейный градиент от 30 до 90% элюента В (раствор ацетонитрил/изопропанол/вода, 90/8/2 об./об./об., с добавлением 0,1% муравьиной кислоты и 10 ммоль/л формиата аммония) за 20 минут. В качестве элюента А использовали раствор ацетонитрил/вода (60/40, об./об.) с добавлением 0,1% муравьиной кислоты и 10 ммоль/л формиата аммония. Скорость потока элюирования была 35 мкл/мин, для анализа вводили 3 мкл образца. Масс-спектры получали в режиме положительных ионов в диапазоне m/z 100–1700 со следующими установками: напряжение на капилляре 4,1 кВ, давление распыляющего газа 0,7 бар, скорость потока осушающего газа 6 л/мин, температура осушающего газа 200°C. Для идентификации липидов выполняли тандемную масс-спектрометрию в режиме зависимого сканирования с шириной окна 5 Да.
Исходные файлы, полученные в результате ВЭЖХ-МС-анализа, конвертировали с помощью программы msConvert из пакета Proteowizard 3.0.9987 [16] в открытый формат MzXml, содержащий информацию о масс-спектре в любой момент времени, и в формат ms2, содержащий информацию о тандемных масс-спектрах в заданный момент времени. Также использовали программу MzMine [17] для выделения пиков, нормирования на полный ионный ток и создания таблицы, содержащей информацию о массе иона, площади его хроматографического пика и времени выхода. Идентификация липидов производилась средствами скриптов LipidMatch [18]. Номенклатура липидов соответствует LipidMaps [19].
Статистический анализ
Для статистической обработки результатов использовали скрипты, написанные на языке R версии 3.3.3 [20], и программу RStudio 1.383 [21].
Обработку многомерных масс-спектрометрических данных выполняли с помощью многофакторного анализа OPLS-DA (дискриминантный анализ с помощью ортогональных проекций на скрытые структуры) [22]. Анализ OPLS-DA реализован с использованием библиотеки «ropls» [23]. OPLS-DA является модификацией метода главных компонент, разработанной для создания моделей с обучением. С помощью OPLS-DA были созданы модели для классификации образцов по принадлежности к той или иной группе. В качестве независимых переменных в моделях рассматривали идентифицированные липиды. В качестве зависимой переменной выступала принадлежность пациентки к одной из исследуемых групп. Качество разработанных моделей определяли путем построения ROC-кривой, определения площади под ROC-кривой и расчета чувствительности и специфичности. Качество OPLS-DA-моделей также оценивали по их способности описывать дисперсию анализируемых данных (R2) и прогнозировать возможные новые данные (Q2). Параметр Q2 рассчитывали путем 7-кратной кросс-валидации. При Q2≥0,4 модель может быть использована для отнесения анализируемых образцов к той или иной клинической подгруппе. Кроме того, OPLS-DA использовали для выявления липидов, которые являются наиболее значимыми для классификации. Это делается путем анализа влияния переменной на проекцию (variable influence on projection, VIP). К потенциальным липидам-маркерам были отнесены липиды, у которых VIP>1 [24]. Cтатистическую значимость отличия уровней липидов между исследуемыми группами проводили с помощью теста Манна–Уитни с поправкой Бенджамини–Хохберга. Для описания количественных данных использовали медиану (Me) и квартили Q1 и Q3 в формате Me (Q1;Q3). Величину порогового уровня значимости p принимали равной 0,05.
Визуализацию результатов анализа осуществляли с помощью графиков рассеяния для большого массива данных (вулканная диаграмма), которые позволяют наглядно представить статистическую значимость и величины различия уровней липидов в группах, а также с помощью графика счетов для представления качества OPLS-DA-моделей и их способности группировать образцы по анализируемым клиническим признакам. Точки на графиках рассеяния соответствуют отдельным липидам, по оси ординат откладывают значение отрицательного десятичного логарифма p-value с поправкой Бенджамини–Хохберга, а по оси абсцисс – значение логарифма по основанию 2 от кратности изменения уровня соответствующего липида между группами (log2 FC).
Результаты
Для исследования были отобраны образцы сыворотки крови 63 пациентов, в которых суммарно было идентифицировано 345 липидов.
I. Злокачественные и пограничные серозные опухоли яичников.
При проведении попарного межгруппового сравнения липидного профиля сыворотки крови пациентов, у которых не было оперативного вмешательства и химиотерапевтического лечения в анамнезе, при ранних (I–II, n=5) и распространенных (III–IV, n=23) стадиях рака яичников и пограничных опухолях (n=4), а также пациентов группы контроля (n=13) обнаружены статистически значимые различия (табл. 1–3) и разработаны дискриминантные OPLS-модели (табл. 4).



Уровни 103 липидов образцов сыворотки пациентов при ранних стадиях статистически значимо снижены в 2–4 раза по сравнению с уровнем липидов сыворотки крови пациентов группы контроля (рис. 2).

В результате OPLS-анализа масс-спектрометрических данных, полученных в режиме положительных ионов, наиболее существенными были 108 из 345 идентифицированных липидов, что также позволило кластеризировать анализируемые клинические группы (характеристики модели: R2=0,97, Q2=0,86).
При OPLS-анализе липидома сыворотки крови пациентов с распространенными стадиями заболевания и пациентов группы контроля также выявлены статистически значимые различия и получена кластеризация данных групп (характеристики модели: R2=0,87, Q2=0,8).
При этом распределение характерных липидов было следующим: из 148 статистически значимо измененных липидов сыворотки крови 40 были повышены (примерно в 2,0–2,25 раза) и 108 снижены (примерно в 2,0–77,4 раза) у пациентов с наличием распространенных стадий заболевания.
При сравнении липидных профилей крови здоровых добровольцев и пациентов с пограничными опухолями яичников, которые впервые подверглись хирургическому лечению по поводу имеющегося у них новообразования яичников (n=4), было выявлено 109 специфичных липидов, 25 из которых оказались значимыми при построении моделей. При этом 23 из 25 были статистически значимо повышены примерно в 32,5–64 раза, 2 из 25 – снижены (рис. 3).
Несмотря на различия между группами, выявленные с помощью теста Манна–Уитни, параметры OPLS-модели не достигли классификационной значимости (R2=0,91, Q2=0,36), что может быть обусловлено малой выборкой пациентов, составивших данную группу.
Профиль крови пациентов с пограничными опухолями отличим от такового при наличии серозного рака яичника high grade как ранних, так и распространенных стадий.
При попарном сопоставлении липидного профиля клинических групп пациентов I–II стадий рака яичников и профиля пациентов с пограничными опухолями получены данные о точности построенной модели (R2=0,88, Q2=0,66; рис. 4). Наибольший вклад в создание модели внесли 111 липидов. При пограничных опухолях отмечено значимое повышение 52 липидов.

Модель, характеризующая отличия пациентов с поздними III–IV стадиями рака яичников и пограничными опухолями (R2=0,79, Q2=0,27), построена на основании 114 липидов. Зарегистрировано значимое повышение 41 липида и снижение 7.
Несмотря на различия между группами, выявленные с помощью теста Манна–Уитни, точность OPLS-модели не достигла классификационной значимости, что может быть обусловлено низкой выборкой пациентов с пограничными опухолями яичников, а также преобладанием у них III стадии заболевания (у трех из пяти пациентов).
В крови пациентов с серозными опухолями яичников высокой степени злокачественности (РЯ ВСЗ) I–IV степени наблюдались максимальные показатели VIP для 12 липидов, 7 из которых были необходимы для построения моделей, дифференцирующих образцы сыворотки пациентов с пограничными опухолями (ПОЯ) от группы контроля (табл. 5).

II. Изменение липидома в процессе лечения.
1. Были исследованы образцы крови пациентов, которым было проведено первичное и повторное (после нерадикальной операции) хирургическое лечение по поводу РЯ ВСЗ (n=29 и n=7 соответственно) и ПОЯ (n=4 и n=6 соответственно).
При проведении OPLS-анализа различий в группах хирургического лечения получено не было.
Отсутствие значимых изменений липидома крови после нерадикального оперативного вмешательства по поводу РЯ ВСЗ и ПОЯ может быть объяснено коротким периодом времени между первым и вторым оперативными вмешательствами (в среднем менее 3 месяцев).
2. Были исследованы образцы крови пациентов с РЯ ВСЗ III–IV стадии, которым перед оперативным вмешательством было проведено 3 курса НАХТ. Липидный профиль данных образцов (n=7) был сопоставлен с профилем пациентов с РЯ ВСЗ III–IV стадии, которым первым этапом было решено выполнить хирургическое лечение (n=24). При проведении OPLS-анализа различий липидного профиля сыворотки крови пациентов с III–IV стадиями РЯ ВСЗ после НАХТ и пациентов в группе первичного хирургического лечения получены статистически значимые различия (R2>0,5, Q2=0,4; рис. 5).
3. В результате наблюдения за пациентами с РЯ ВСЗ IIb–IVb стадий в течение 12 месяцев после окончания комбинированного лечения (операция + химиотерапия) были зарегистрированы ранние исходы: достигнута стабилизация заболевания (n=16) или выявлен рецидив (или прогрессирование) процесса (n=9).
Для оценки наличия изменений липидома крови перед оперативным вмешательством и зарегистрированным исходом была создана статистическая модель. Полученная модель характеризуется низким коэффициентом оценочных параметров (R2=0,62, Q2=-0,49).
При прицельном рассмотрении липидов, продемонстрировавших статистическую значимость отличий в анализируемых группах (n=122), были получены данные о повышении OxLPC(22:2(OO)) и PEtOH(20:1_20:1)-H в группе пациентов с зарегистрированным неблагоприятным исходом.
Можно отметить тенденцию к рецидиву заболевания в группе пациентов с РЯ ВСЗ, у которых отмечается повышение в крови данных липидов. Возможность прогнозирования клинического исхода проводимого лечения на основании изменений липидома сыворотки крови, обнаруженного до начала лечения, является перспективной задачей и требует проведения дополнительных исследований в будущем.
Обсуждение
ВЭЖХ-МС-анализ экстрактов липидов позволил сравнить относительное содержание различных классов липидов, включая фосфатидилхолины, фосфатидилэтаноламины, церамиды, ди- и триглицериды и др. OPLS-DA анализ полученных масс-спектрометрических данных выявил отличия липидного профиля сыворотки крови в исследуемых группах.
В исследование были включены пациенты, у которых на основании данных анкетирования, опроса, клинических и лабораторных анализов не были получены данные о наличии экстрагенитальной патологии, требующей регулярного приема медикаментов, а также опухолевого процесса на момент исследования или ранее в анамнезе, поскольку, по данным ряда авторов [9], каждый онкологический процесс сопровождается определенным характерным изменением липидного профиля, в связи с чем изучить закономерности сочетания гетерогенного «химерного» набора не представлялось возможным особенно при работе с малыми выборками больных, и в связи с наличием конфаундеров 27 пациентов не были включены в проведенное исследование.
Первой выдвинутой гипотезой в данном исследовании было предположение наличия различий липидного профиля сыворотки крови здоровых добровольцев и пациентов с пограничными опухолями и различными стадиями РЯ ВСЗ. Данное утверждение нашло подтверждение в ряде проведенных исследований. M.F. Buas et al. провели исследование «случай–контроль», в процессе которого проанализировали по 50 образцов плазмы крови пациентов, подвергшихся оперативному лечению по поводу серозного рака или доброкачественных серозных опухолей яичника (группа контроля). Образцы были исследованы с помощью ВЭЖХ-МС. Было обнаружено, что 34 метаболита из 372 обнаруженных статистически значимо различались в группах. Авторы пришли к выводу, что выявленные отличия метаболического профиля могут способствовать повышению точности дифференциальной диагностики доброкачественных и злокачественных заболеваний яичников [25].
R.J. Niemi et al. изучили изменения липидома при ранних стадиях серозного рака яичников (n=138), пограничных (n=25) и доброкачественных (n=191, группа контроля) опухолях яичников. Было проанализировано 354 образца плазмы и сыворотки крови женщин как пре-, так и постменопаузального возраста. Получены идентичные изменения 39 липидов в образцах пациентов независимо от стадии заболевания (ранняя или поздняя) и возраста пациентов. Более того, на примере 23 липидов была показана аналогичная тенденция изменений при сравнении жидкостей при опухолях различных локализаций и гистологических типов [26]. Полученные ими данные свидетельствуют о некоторой однотипности изменений, но в то же время авторы говорят о том, что анализ липидома повышает диагностическую ценность исследования СА-125 при ранних стадиях рака яичников, а также не исключают возможности липидов выступать в роли метаболически-активной терапевтической мишени, что, однако, заслуживает продолжения исследований. В представленном исследовании была проанализирована сыворотка крови женщин репродуктивного возраста. В группе пациентов с I–II стадиями чувствительность определения индекса ROMA достигла 77,5%, расчет индекса для пациентов с III–IV стадиями рака яичников – 99,9% (ROMA=83,36%; СА-125=856,43 ЕД/мл, HE4=398,42 пмоль/л). Полученные данные о высокой информативности созданных статистических моделей подтверждают возможность применения обнаруженного перечня липидов для повышения чувствительности и специфичности рутинных методов неинвазивной предоперационной диагностики.
Не менее важным является выявление пациентов с распространенными стадиями серозного рака яичников, встречаемость которых в общей структуре заболевания превышает 70%. P. Knapp et al. была определена концентрация сфинголипидов плазмы крови (C16-Cer, C18:1-Cer и C18-Cer) у 74 пациентов с III–IV стадиями РЯ ВСЗ с помощью ВЭЖХ-МС. Причем при превышении установленных пороговых значений вероятность злокачественного типа опухоли была выше (C16-Cer>311,88 нг/100 мкл (AUC: 0,76, p=0,0261); C18:1-Cer>4,75 нг/100 мкл (AUC: 0,77, p=0,0160) и C18-Cer>100,76 нг/100 мкл (AUC: 0,77, p=0,0136)), чем у пациентов группы контроля. Аналогичная тенденция была отмечена при исследовании образцов опухолевой ткани: 5 липидов были значимо повышены в образцах исследуемой группы (C16-Cer, C18:1-Cer, C18-Cer, C24:1-Cer, C24-Cer). В отличие от представленного нами исследования в исследование P. Knapp et al. были включены пациенты исключительно с поздними стадиями злокачественного процесса, что может быть ограничением при проведении дифференциальной диагностики [27].
В нашем исследовании представлены данные сравнения липидных профилей крови пациентов с пограничными опухолями яичников и пациентов с РЯ ВСЗ и здоровых добровольцев. Учитывая экстремально малую выборку в данном фрагменте исследования, а также противоречивые результаты статистического анализа (выход образцов за пределы эллипсов Хоттелинга на визуальной диаграмме, показатели оценочных параметров (R2=0,91, Q2=0,36)) позволяют лишь наметить тенденции изменения метаболизма липидов при наличии пограничной опухоли яичников, что потенциально может повлиять на повышение качества предоперационной диагностики данной «особенной» группы пациентов, – большинство женщин на момент установления диагноза находится в репродуктивном периоде (согласно критериям STRAW+10) и заинтересованы в сохранении фертильности. Соответственно в каждом случае тактика и возможность выполнения оперативного вмешательства в органосберегающем объеме должна быть согласована с пациентом на этапе предоперационного планирования, – для принятия взвешенного решения также необходимо обсуждать компетенции активно развивающихся вспомогательных репродуктивных технологий [28]. Наряду с этим усовершенствование диагностических возможностей на предоперационном этапе требует проведения дальнейших исследований.
Предположение о возможности выявить предикторы неблагоприятного исхода при РЯ ВСЗ было изучено на примере пациентов, получивших комбинированное лечение и проходивших наблюдение в НМИЦ АГП им. В.И. Кулакова в течение года после его окончания. Несмотря на отсутствие значимых различий при проведении OPLS-анализа, были получены данные о значимом изменении нескольких липидов, и в дальнейшем планируется изучение их биомаркерной ценности.
Заключение
В представленном исследовании посредством метода ВЭЖХ-МС был проведен многокомпонентный анализ изменений липидома при различных клинических ситуациях, сопряженных с наличием серозных опухолей яичников.
Выявлены статистически значимые отличия липидного профиля сыворотки крови пациентов с ранними и распространенными стадиями рака яичников от липидома крови пациентов с пограничными опухолями, а также наблюдаемыми группы контроля. Наибольшая значимость при построении дифференциально-диагностических моделей, кластеризирующих пациентов с различными стадиями РЯ ВСЗ и ПОЯ, была отмечена для фосфатидилхолинов и глицеролипидов. Данные могут быть использованы для усовершенствования предоперационных методов дифференциальной диагностики серозных опухолей яичников данных двух типов.
При изучении системного изменения липидома после проведенной нерадикальной операции по поводу опухолей яичников (РЯ ВСЗ и ПОЯ) статистически значимых различий от липидома крови ранее не оперированных пациентов выявлено не было, что может быть обусловлено кратким периодом времени между двумя оперативными вмешательствами или истинным отсутствием влияния.
При сравнении пациентов с распространенными стадиями РЯ ВСЗ после НАХТ и пациентов, которым первым этапом была выполнена циторедуктивная операция, были получены различия липидных профилей, указывающие на влияние проводимой химиотерапии на изменение липидома крови. В дальнейшем планируется проведение аналогичного исследования на связанных выборках пациентов.
При изучении наличия прогностической значимости изменений липидного профиля были проанализированы исходы пациентов в течение одного года после окончания комбинированного лечения. Повышение в сыворотке крови производных лизофосфатидилхолинов [OxLPC(22:2(OO))] и глицерофосфолипидов [PEtOH(20:1_20:1)-H] пропорционально вероятности развития неблагоприятных ранних онкологических исходов (рецидив или прогрессирование заболевания).
Таким образом, представленные данные свидетельствуют о клинической и научной ценности проведения исследований липидома для усовершенствования диагностики и ведения пациентов со злокачественными новообразованиями яичников.
Ограничения
В ряде случаев при малой выборке пациентов были получены данные о наличии различий между исследуемыми группами на основании непараметрического Т-критерия знаковых рангов Уилкоксона, при которых оценочные параметры многофакторного анализа OPLS не достигли пороговых значений. В данных случаях необходимо проведения исследований на выборках, включающих большее число пациентов.



