Преэклампсия – специфическое осложнение второй половины беременности, которое изначально развивается как мультисистемное поражение и характеризуется генерализованной сосудистой дисфункцией.
Одним из органов-мишеней, которые поражаются при преэклампсии и эклампсии, является головной мозг. До недавнего времени считалось, что перенесенная эклампсия и тяжелая преэклампсия не оказывают долговременных последствий, и после родоразрешения все клинические симптомы исчезают. Однако множество последних опубликованных данных свидетельствуют об обратном. Описывается целая группа цереброваскулярных осложнений преэклампсии, в которую включают синдром задней обратимой энцефалопатии (posterior reversible encephalopathy syndrome, PRES), синдром обратимой церебральной вазоконстрикции (reversible cerebral vasoconstriction syndrome, RCVS), геморрагический и ишемический инсульт, поражение мелких сосудов головного мозга, вплоть до сосудистой деменции [1–4].
Сложность изучения церебральных нарушений при преэклампсии обусловлена многими факторами, к примеру, тем, что преэклампсия является уникальным осложнением беременности только у человека, часто отсутствует возможность провести методы нейровизуализации, ограничена применимость моделей in vitro в клинической практике и другими.
Острые цереброваскулярные нарушения, включая PRES, RCVS, ишемический и геморрагический инсульт, тромбоз венозного синуса головного мозга, представляют собой наиболее тяжелые осложнения преэклампсии, которые могут привести к инвалидности или даже смерти матери. Риск развития перечисленных осложнений у беременных с преэклампсией достигает 1 на 500 родов, в то время как общий риск подобных осложнений во время беременности составляет примерно 30 случаев на 100 000 родов [5].
Согласно опубликованным данным, доля ишемических инсультов в структуре причин материнской смертности составляет около 12% [6]. Частота инсультов во время беременности в 2–3 раза выше, чем в общей популяции (около 30 случаев на 100 000 родов) [7], особенно высок риск в III триместре и в первые 6–12 недель после родоразрешения [8]. У беременных с гипертензивными расстройствами риск развития инсульта возрастает еще в 4–5 раз по сравнению со здоровыми беременными [9].
Этиология и патофизиология церебральных осложнений преэклампсии и эклампсии не совсем понятна, но считается, что эти состояния – результат нарушения цереброваскулярной регуляции, приводящей в основном к вазогенному и, отчасти, к цитотоксическому отеку преимущественно в теменно-затылочных областях головного мозга. Возможный механизм – церебральная вазоконстрикция, нарушение ауторегуляции с форсированной дилатацией мозговых артерий и эндотелиальная дисфункция [10].
Неврологическая симптоматика тяжелой преэклампсии и эклампсии (головная боль, нарушения зрения, изменение сознания, судорожный синдром, реже – очаговые неврологические нарушения) по сути соответствует клиническим критериям PRES [11, 12]. Считается, что акушерский PRES вызван тяжелой гипертензией с нарушением проницаемости гематоэнцефалического барьера (ГЭБ) и развитием вазогенного (обычно симметричного) отека мозга в теменных и затылочных долях, который в большинстве случаев при адекватном лечении полностью регрессирует. Однако в некоторых случаях при проведении КТ и МРТ, помимо вазогенного отека, обнаруживаются инфаркты в субкортикальных зонах белого вещества и смежных с ними зонах коры мозга [13], что может способствовать прогрессированию PRES и повреждению паренхимы головного мозга с остаточным неврологическим дефицитом.
Первоначальная концепция причины PRES, концепция церебральной вазоконстрикции, предложенная еще в конце прошлого века, базировалась на результатах ангиографии, которая показала сужение диаметра мозговых артерий при эклампсии. Предполагалось, что вазоконстрикция церебральных артерий возникает в ответ на артериальную гипертензию с последующим включением компенсаторных механизмов ауторегуляции мозгового кровотока. Эти изменения приводят к гипоксии, эндотелиальной дисфункции и далее к развитию вазогенного и цитотоксического отека мозга [14].
Однако в настоящее время научное сообщество больше придерживается другой концепции – потери (срыва) церебральной ауторегуляции и гиперперфузии мозга.
Современная теория, объясняющая потерю ауторегуляции мозгового кровотока, основана на паралитической дилатации мозговых сосудов со снижением церебрального сосудистого сопротивления в ответ на повышение системного артериального давления (АД). Дилатация мозговых артерий приводит к увеличению мозгового кровотока, повышению давления на стенку сосуда, что, в свою очередь, и вызывает вазогенный отек головного мозга [10, 15]. Однако этот процесс может происходить только тогда, когда достигнут верхний предел ауторегуляции мозгового кровотока (при АД ≥170–180 мм рт. ст.), что не всегда наблюдается у женщин с эклампсией и преэклампсией [16]. Причина срыва ауторегуляции мозгового кровотока при тяжелой преэклампсии и эклампсии у беременных с АД в пределах нормального диапазона или с умеренной гипертензией, изучена плохо.
Одним из последствий нарушения ауторегуляции мозгового кровотока является повышенная проницаемость ГЭБ, которая может привести к отеку мозга [17].
Во время беременности в ГЭБ также происходя адаптационные изменения. Еще в 2012 г. Cipolla M.J. et al. обнаружили, что сыворотка крови беременных животных, нанесенная непосредственно на срез гиппокампа, вызывает повышенную возбудимость нейронов и судорожную активность, а также морфологические изменения в микроглии, характерные для ее активации [18]. Однако увеличения проницаемости ГЭБ в эксперименте авторами не выявлено. Сделан вывод о том, что ГЭБ играет важную роль в защите мозга от различных нейровоспалительных субстанций, циркулирующих в кровотоке у здоровых беременных.
При таких осложнениях как тяжелая преэклампсия, эклампсия, HELLP-синдром, сопровождающихся неврологической симптоматикой, проницаемость ГЭБ нарушена, что имеет решающее значение в развитии отека мозга и судорог у беременных [19]. Повышение проницаемости ГЭБ у беременных с указанными осложнениями, по-видимому, обусловлено наличием в циркулирующей крови большого числа факторов повреждения эндотелия, в том числе эндотелиального компонента ГЭБ. Интересны результаты Amburgey O.A. et al., которые показали, что экспериментальное воздействие плазмой крови пациенток с преэклампсией на мозговые сосуды крыс мало влияет на реактивность церебральных артерий, но значительно увеличивает проницаемость ГЭБ (в 18 раз по сравнению с плазмой крови здоровых беременных) [20]. Немаловажен тот факт, что применение ингибитора сосудисто-эндотелиального фактора роста (VEGF) предотвращало это повышение проницаемости ГЭБ.
Молекулярные механизмы, которые приводят к судорожной активности и возникновению эклампсии, также до конца не изучены. Многими авторами немаловажное значение в развитии судорог придается активации микроглии головного мозга. Клетки микроглии по сути являются резидентными макрофагами, которые широко распределены в паренхиме головного мозга и первыми реагируют на патологические раздражители. Активация микроглии характеризуется рядом особенностей, включая морфологическую трансформацию и выработку провоспалительных цитокинов (к примеру, TNFα) [21], которые затем через ГАМК-рецепторы воздействуют на нейроны, изменяя их состояние возбудимости.
В связи с неоднозначным состоянием проблемы цереброваскулярных нарушений при тяжелой преэклампсии и эклампсии, целью нашего исследования явилось изучение особенностей повреждений головного мозга при указанных осложнениях беременности с использованием аутопсийного материала.
Материалы и методы
Проведен ретроспективный анализ медицинской документации (в том числе, патологоанатомических протоколов), а также иммуногистохимическое исследование тканей головного мозга у 10 женщин, умерших от тяжелой преэклампсии (n=5) и эклампсии (n=5), которые составили основную группу. Из исследования исключены пациентки с указаниями на повреждения мозга, не связанные с преэклампсией (травматические, опухолевые, инфекционные, токсические, нейродегенеративные, лекарственные и др.).
К сожалению, мы не имели возможности сравнить изменения, описанные при патоморфологическом исследовании и прижизненной нейровизуализации, так как аутопсийный материал был предоставлен нам ФГБУ «НИИ морфологии человека» РАМН (исследование проведено в лаборатории патологии женской репродуктивной системы под руководством д.м.н., профессора А.П. Милованова).
Основные клинические данные пациенток основной группы представлены в таблице.

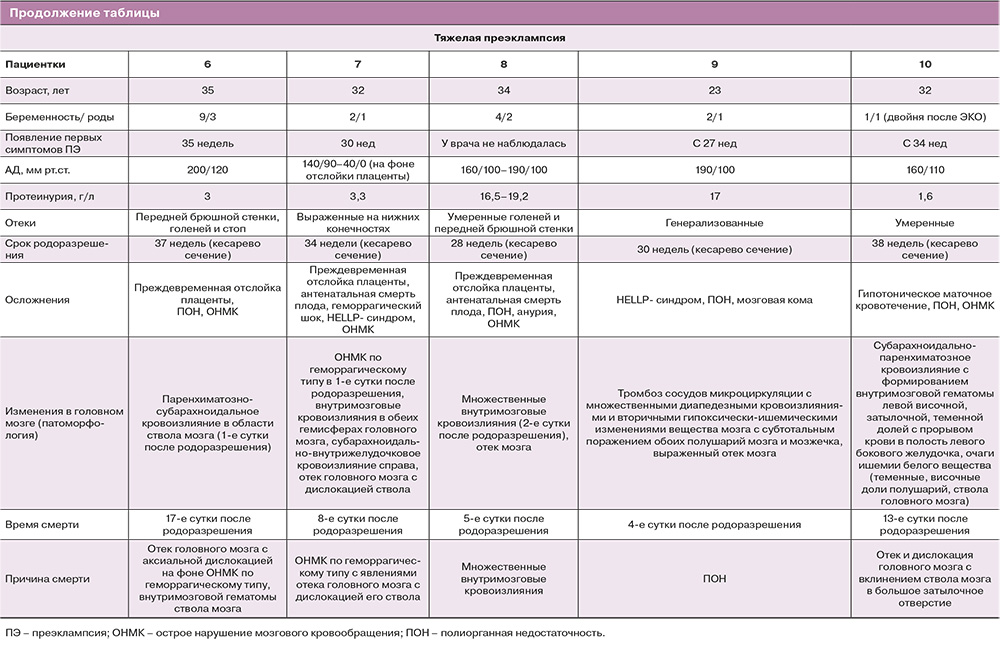
Группу сравнения составили 3 умершие пациентки без преэклампсии. Причины смерти: разрыв матки с развитием геморрагического шока на 38-й неделе беременности (38 лет, 6-я беременность, 4-е роды); анафилактический шок на введение кетамина с остановкой сердца (33 года, 3-я беременность, 2-е роды); острый лимфобластный лейкоз с тяжелым геморрагическим синдромом на 32-й неделе беременности (39 лет, 2-я беременность, 2-е роды).
Аутопсийный материал фиксировался в нейтральном 10% формалине, проводился по обычной схеме, заливался в парафин. На микротоме готовили срезы толщиной 3–5 микрон и окрашивали их гематоксилином и эозином. После первого просмотра микропрепаратов отбирали те из них, которые были перспективны для иммуногистохимического исследования. После депарафинизации срезов их укладывали на предметные стекла, покрытые специальным полилизиновым покрытием. Использовали следующие антитела фирмы Novocastra (Германия), используемые для депарафинизированных срезов: 1) γ-NSE (γ-нейроспецифическая енолаза, клон 5Е2) – маркер нейронов и нейроэндокринных клеток; 2) CD-34 (клон QBend/10) – маркер эндотелиоцитов сосудов. После депарафинирования срезов их инкубировали с вышеуказанными первичными антителами в течении 15 мин при температуре 25°С. Применена единая система детекции Kit (NCL-RTV) по стандартной технологии.
Результаты
Исследование ткани мозга в группе сравнения
При рутинном патоморфологическом исследовании выявлены отек и набухание в области коры головного мозга, в подкорковых центрах и в мозжечке, выраженный периваскулярный отек, множественные очаги ишемических повреждений (рис. 1а), что подтверждает роль шока в танатогенезе.

При иммуногистохимическом исследовании с применением маркера эндотелиоцитов CD34 в тканях коры головного мозга визуализировалась достаточно высокая плотность распределения капиллярной сети (рис. 1б). На рисунке 1б наглядно представлена церебральная артериола, которая выходит из мягкой мозговой оболочки и разветвляется на густую сеть капилляров.
Для более подробной оценки состояния нейронов проведено иммуногистохимическое исследование ткани мозга с применением нейроспецифической енолазы (NSE) – маркера зрелых дифференцированных нейронов. В группе сравнения NSE отчетливо визуализировалась в цитоплазме крупных нейронов, подчеркивая контуры сохранившихся ядер. NSE определялась также вокруг нейронов, в густой сети нейрональных отростков (дендритов и аксонов) (рис. 2). Однако изучение распределения NSE показало патологические изменения нейронов: краевая мембрана нечеткая, в цитоплазме отсутствует тигроидное вещество Ниссля – скопление цистерн гранулярной эндоплазматической сети (рис. 2), что свидетельствует о выраженном нарушении процессов синтеза различных нейробелков в этих клетках. Астроциты, олигодендроциты и другие клетки ненейронального (нейроэпителиального) происхождения были NSE-негативны.

Таким образом, описанные изменения головного мозга в группе сравнения явно свидетельствуют о тяжелой прогрессирующей гипоксически-ишемической энцефалопатии на фоне шока. Несмотря на деструктивные изменения некоторых нейронов, их общее количество сохранено, сеть мозговых капилляров достаточно распространенная, что подтверждает сохранную васкуляризацию коры головного мозга вплоть до развития шокового состояния.
Представленные патологические нарушения в зоне коры головного мозга отражают механизмы танатогенеза в группе сравнения и не являются непосредственной причиной смерти этих пациенток.
Исследование ткани мозга при преэклампсии и эклампсии
Результаты патоморфологического исследования коры головного мозга женщин, умерших от преэклампсии и эклампсии, во многом пересекались с результатами в группе сравнения и свидетельствовали о тяжелой гипоксически-ишемической энцефалопатии, однако были более выражены.
Макроскопически в 100% изученных микропрепаратов обнаружен резко выраженный отек головного мозга, в 60% микропрепаратов – ишемические очаги разного размера, также в 60% микропрепаратов имели место субарахноидальные и внутримозговые кровоизлияния.
Рутинное микроскопическое исследование с окраской гематоксилином и эозином позволило выявить крупные зоны периваскулярного и перицеллюлярного отека с вакуольной дегенерацией нейронов. В отличие от группы сравнения, обнаружено уменьшение количества нейронов во всех зонах неокортекса (особенно в V слое), что свидетельствует о гибели довольно большого объема этих клеток вследствие ишемии (рис. 3). В 60% микропрепаратов выявлен тромбоз сосудов микроциркуляции с множественными ишемическими изменениями в окружающих тканях.
Изучение особенностей васкуляризации коры головного мозга женщин, умерших от преэклампсии/эклампсии, с использованием маркера CD34 показало существенные отличия с группой сравнения. Так, выявлено резкое уменьшение плотности распределения мозговых капилляров во всех слоях коры (особенно в I, II и III слоях) (рис. 4а). В некоторых исследуемых полях визуализировались только единичные мелкие капилляры.
По-видимому, данным фактом обусловлены обнаруженными нами особенности клеточного состава коры головного мозга. Так, с помощью маркера NSE выявлены еще более тяжелые ишемические повреждения моторных нейронов и других клеток практически во всех слоях коры. I слой коры головного мозга (поверхностный молекулярный) утолщен (рис. 4б – 1). Количество мелких пирамидных клеток во II (наружном зернистом) слое уменьшено (рис. 4б – 2), выявляются лишь безъядерные контуры пирамидных клеток с некоторым накоплением NSE в перикарионе. Во III и IV слоях, слое пирамидальных нейронов (рис. 4б – 3) и внутреннем зернистом (рис. 4б – 4), визуализируются единичные пирамидные и зернистые клетки со слабой иммуноэкспрессией NSE в виде мелкогранулярных скоплений. В V слое (внутреннем пирамидном, ганглионарном) (рис. 4б – 5) также определяются лишь единичные крупные нейроны (клетки Беца) с разветвленными аксонами. Учитывая, что аксоны клеток Беца дают коллатерали, посылающие тормозящие импульсы в кору, то столь резкое «обеднение» коры мозга двигательными нейронами может быть одним из механизмов возникновения судорожного синдрома.
При большом увеличении (рис. 4в) прослежены разные этапы гибели моторных нейронов – потеря четкости контуров клеток, разная интенсивность экспрессии NSE (от слабой до полного ее отсутствия), вакуолизация перикариона вплоть до гибели отдельных нейроцитов. NSE-положительный материал из поврежденных нейронов свободно определялся в матриксе коры в виде гранул.
Отмечались также выраженные ишемические повреждения в астроцитах и олигодендроцитах в виде просветления цитоплазмы, отсутствия четких контуров их ядер.
Важным фактом стало обнаружение большого числа NSE-положительных включений в дендритных массах и эндотелиоцитах мозговых капилляров в этой группе (рис. 2). При этом на фоне выраженного периваскулярного отека вокруг большинства капилляров и утолщения их базальной мембраны была отмечена избыточная концентрация NSE в десквамированном эндотелии (рис. 5а, б). При большом увеличении, помимо десквамации эндотелиоцитов от базальной мембраны, нами выявлены и другие признаки тяжелого эндотелиоза мозговых капилляров – набухание и вакуолизация эндотелиальных клеток, выбухание отечных эндотелиоцитов в просвет капилляров вплоть до их смыкания с клетками противоположной стенки сосудов (рис. 5б). Подобных изменений не было в группе сравнения.

Изучение особенностей распределения NSE в тканях головного мозга позволило констатировать факт «прорыва» ГЭБ у пациенток, умерших от тяжелой преэклампсии и эклампсии. Выявлена более интенсивная концентрация NSE в поврежденном эндотелии мозговых капилляров по сравнению с окружающими пирамидными нейронами (рис. 5б), что свидетельствует о повреждении базальной мембраны капилляров, которые являются важной составляющей ГЭБ. NSE в норме локализована только в нейронах. Определение данного маркера вне этих клеток возможно в случае некроза нейронов и выхода NSE из внутриклеточного компартмента нейронов коры в окружающий матрикс. Далее, NSE проходит через поврежденную базальную мембрану мозговых капилляров и накапливается в эндотелиоцитах.
Таким образом, при тяжелой преэклампсии и эклампсии имеет место «прорыв» ГЭБ с проникновением нейроспецифических белков из гибнущих нейронов в матрикс коры и накоплением их в тотально поврежденном эндотелии. В данной ситуации возможен дальнейший выход NSE в направлении мозг – кровь с последующей активацией иммунной системы матери в ответ на собственные мозговые белки, к которым отсутствует иммунологическая толерантность.
Обсуждение
Как свидетельствуют недавние клинические исследования, истинная частота церебральных нарушений при преэклампсии гораздо выше, чем мы привыкли предполагать. МРТ, выполненная у пациенток с преэклампсией в первые 48 ч после родоразрешения, позволила выявить наличие признаков PRES у каждой четвертой (в 26,6%) из них даже при отсутствии выраженных симптомов преэклампсии, в группе с эклампсией признаки PRES зарегистрированы у 86,7% [22]. Своевременное лечение могло бы привести к быстрому регрессу морфологических изменений, свойственных PRES, и уменьшить риск ее долговременных неврологических последствий.
Многие опубликованные данные показали, что даже через 5–15 лет после перенесенной преэклампсии на МРТ определяется повышенная гиперинтенсивность белого вещества головного мозга, которая является маркером поражения мелких церебральных сосудов и прямо коррелирует с повышенным риском инсульта, когнитивных нарушений и деменции в более позднем возрасте [3, 23]. Кроме того, стало понятно, что PRES не всегда ограничивается задними областями головного мозга и может регистрироваться в теменных или лобных областях [24].
Повреждение головного мозга, обычно описываемое патоморфологами при эклампсии, включает массивный отек мозга и изменения белого вещества, характерные для синдрома задней обратимой лейкоэнцефалопатии, а также обширные очаги некроза [25].
Считается, что морфологические признаки повреждения мозговой ткани не являются строго специфичными для преэклампсии. Сходные изменения описаны и при других патологических состояниях, протекающих с признаками генерализованного системного повреждения эндотелия сосудов (тромботической микроангиопатии, атипичном гемолитико-уремическом синдроме, антифосфолипидном синдроме и др.) [26].
Наше исследование показало, что в целом морфологическая картина головного мозга в группе женщин, умерших от преэклампсии/эклампсии, соответствует крайне тяжелой гипоксически-ишемической энцефалопатии (резко выраженный отек головного мозга, ишемические очаги, субарахноидальные и внутримозговые кровоизлияния).
Микроскопическое исследование позволило выявить большие зоны периваскулярного и перицеллюлярного отека как в белом, так и в сером веществе мозга, тромбоз сосудов микроциркуляции с множественными ишемическими изменениями. Выявлен значительно больший объем ишемического некроза нейронов, астроцитов и олигодендроцитов во всех слоях коры мозга по сравнению с пациентками группы сравнения. Отчасти это отражает патофизиологические механизмы нарушения ауторегуляции церебрального кровотока, отчасти – процесс танатогенеза. Гибель нейронов и других клеток коры головного мозга при тяжелой преэклампсии и эклампсии, резкое снижение плотности распределения мозговых капилляров может носить долгосрочный характер с изменением когнитивных функций в последующей жизни пациентки, вплоть до сосудистой деменции, описанной в литературе.
Недавние исследования других авторов косвенно подтверждают выявленные нами изменения клеточного состава коры головного мозга. Так, Raman M.R. et al. показали уменьшение объема серого вещества в задних отделах головного мозга у женщин с преэклампсией в анамнезе, названное ими кортикальной атрофией [27].
Применение специальных методов морфологического исследования с использованием специфических маркеров показало еще более глубокий характер поражения головного мозга в основной группе женщин.
Иммуногистохимическое исследование с маркером эндотелиоцитов (CD34) в группе сравнения выявило относительно сохранную васкуляризацию коры головного мозга с распространенной капиллярной сетью. В основной группе, напротив, выявлено резкое уменьшение плотности распределения капиллярной сети в I, II и III слоях коры, в отдельных полях визуализировались лишь единичные мелкие капилляры. Эти изменения, с одной стороны, обусловлены массивным отеком головного мозга, с другой, по-видимому, – длительным антиангиогенным состоянием, характерным для преэклампсии, на фоне повышенных уровней таких антиангиогенных факторов, как sFlt-1.
Отек мозга при преэклампсии и эклампсии, как показывают результаты нашего исследования, носит сочетанный характер – вазогенного и цитотоксического. Первый обусловлен повреждением ГЭБ и последующим выходом воды из мозговых сосудов в межклеточное пространство. Цитотоксический отек связан с увеличенным поступлением воды в клетки мозга через аквапориновые каналы, что приводит к отеку и набуханию клеток. Целостность ГЭБ в этом случае не нарушена.
Важным результатом нашего исследования стало обнаружение крайней степени деструктивного эндотелиоза сосудов мозга при преэклампсии и эклампсии: большинство мозговых капилляров окружены зоной периваскулярного отека, их базальные мембраны отечные, утолщены, отмечена десквамация эндотелиоцитов от базальной мембраны. При большом увеличении визуализируется выбухание отечных, вакуолизированных эндотелиоцитов в просвет капилляров, вплоть до полной окклюзии просвета сосудов.
Эндотелиальная дисфункция в современном понимании – это системное патологическое состояние эндотелия, характеризующееся потерей его физиологического ответа на вазодилататоры и вазоконстрикторы, как эндотелиального, так и неэндотелиального генеза [28].
Генерализованное повреждение эндотелия сосудов всех органов, включая мозг, является центральным звеном патогенеза преэклампсии. При этом эндотелиальные клетки мозговых сосудов – один из ключевых компонентов ГЭБ. Фенотип эндотелиоцитов ГЭБ отличается от фенотипа периферических эндотелиоцитов, поскольку они экспрессируют большое количество белков плотных контактов, трансмембранных переносчиков и метаболических ферментов. Образуя плотные межклеточные контакты (tight junction), они ограничивают проницаемость ГЭБ, поэтому их повреждение вполне объяснимо приводит к потере целостности ГЭБ, наблюдаемой при преэклампсии/эклампсии.
Обнаруженные нами особенности распределения маркера нейронов NSE c наиболее интенсивной иммуноэкспрессией в поврежденном эндотелии капилляров, а не в окружающих нейронах, свидетельствуют о повреждении базальной мембраны церебральных микрососудов в составе ГЭБ с проникновением NSE в периферических кровоток. Подобных изменений не визуализировалось в группе сравнения.
Эти результаты иммуногистохимического исследования позволили проследить цепочку событий патогенеза: тяжелое гипоксическое повреждение нейронов вплоть до их некроза – выход нейроспецифических белков (NSE) из нейронов в окружающие ткани – проникновение NSE через поврежденный ГЭБ и накопление в эндотелии мозговых капилляров – определение NSE в периферическом кровотоке. Однако нейроспецифические белки в норме лоцируются только в мозговой ткани и отделены от иммунной системы ГЭБ с периода внутриутробного онтогенеза, в связи с чем к ним отсутствует физиологическая иммунная толерантность. Проникновение нейробелков в кровоток запускает иммунные реакции по элиминации чужеродных антигенов, усиливая провоспалительный дисбаланс при преэклампсии.
Таким образом, полученные нами данные свидетельствуют о «прорыве» ГЭБ у пациенток с тяжелой преэклампсией и эклампсией, что является неблагоприятным прогностическим фактором в отношении исходов беременности при данном осложнении.
Недавние исследования других авторов согласуются с нашими данными о повышении проницаемости ГЭБ для мозговых белков при преэклампсии, причем эти изменения сохраняются до года после родоразрешения [29].
И все же истинная причина повышенной проницаемости ГЭБ при преэклампсии достоверно не изучена. Как полагают, источником факторов, повреждающих эндотелиоциты мозговых капилляров в составе ГЭБ, является ишемизированная плацента. В подтверждение этой гипотезы Warrington et al. [30] сообщили о повышении проницаемости сосудов головного мозга у беременных крыс с индуцированной ишемией плаценты. Авторы сделали вывод о том, что факторы, высвобождаемые из ишемической плаценты, могут повышать чувствительность сосудов головного мозга к изменениям АД и приводить к изменению проницаемости ГЭБ.
Возможный механизм повышенной проницаемости ГЭБ – повышенные уровни провоспалительных цитокинов при преэклампсии, описанные многими авторами [30–32], влияние некоторых ангиогенных и других факторов [33–36].
Последний факт позволяет нам предположить, что превентивный эффект сульфата магния в отношении эклампсии отчасти может быть связан со стабилизацией ГЭБ. В экспериментальной модели было показано, что сульфат магния действительно способствует снижению проницаемости ГЭБ, уменьшению нейровоспалительной реакции и модулирует активность возбуждающих ГАМК-рецепторов [37].
Повышенная проницаемость ГЭБ может приводить не только к выходу нейропептидов из мозговой ткани в периферический кровоток, но и к проникновению опасных компонентов крови (белки, цитокины, антитела, компоненты комплемента и др.) в паренхиму головного мозга с развитием нейровоспалительной реакции, судорожного синдрома и других тяжелых неврологических осложнений.
По-прежнему остается открытым вопрос о возможности развитии эклампсии при умеренной гипертензии или даже у нормотензивных пациенток [38]. Стоить отметить, что мы ни разу не наблюдали судорожного приступа на фоне нормального АД, однако в литературе имеются подобные сообщения. По-видимому, срыв ауторегуляции мозгового кровотока при более низком АД происходит на фоне нарушенного ремоделирования церебральных сосудов с первичным повреждением их эндотелия, в связи с неадекватной реакцией сосудов мозга на высокие или резкие подъемы АД, повышенной проницаемостью ГЭБ, возможным проникновением в мозговую ткань компонентов плазмы. Ишемическая энцефалопатия с тяжелыми повреждениями нейронов коры и глиальных клеток, несомненно, вносит свой вклад в регуляцию гомеостаза головного мозга.
Тяжелой васкулопатией (с деструктивным эндотелиозом) мозговых сосудов в совокупности с тромбоцитопенией и резкими изменениями АД во многом обусловлена и высокая частота внутримозговых кровоизлияний при тяжелой преэклампсии/эклампсии (по некоторым данным до 92% [1]).
Таким образом, срыв ауторегуляции мозгового кровотока, тяжелые повреждения эндотелия церебральных сосудов и нарушение целостности ГЭБ, а возможно, и нейровоспаление – тесно взаимосвязанные патофизиологические механизмы цереброваскулярных осложнений преэклампсии и эклампсии.
Заключение
Церебральные осложнения преэклампсии по-прежнему остаются значимой причиной материнской заболеваемости и смертности во всем мире. Для достижения 5-й цели ВОЗ, направленной на снижение материнской смертности, несомненно, существует необходимость междисциплинарного подхода по расширению знаний о сосудистых изменениях головного мозга при преэклампсии/эклампсии, требуются фундаментальных научные и клинические исследования в этой области.
Важное значение имеют изучение и разработка инструментов прогнозирования цереброваскулярных осложнений при преэклампсии, которые в настоящее время отсутствуют.
Накопленные данные, подтверждающие повышенный риск развития цереброваскулярных заболеваний в последующей жизни у женщин с преэклампсией/эклампсией в анамнезе, диктуют необходимость разработки стратегий их профилактики.



