Самопроизвольная потеря беременности до 22 недель (выкидыш) представляет собой распространенное акушерское осложнение, возникающее примерно в 15–25% случаев клинически подтвержденных беременностей [1]. Около 80% всех случаев спорадических потерь беременности происходят в I триместре. При этом частым фактором риска является предшествующая потеря беременности. У 2–4% супружеских пар наблюдается привычная потеря беременности [1]. В настоящее время найдена взаимосвязь данной патологии с позитивностью на некоторые аутоантитела, прежде всего на антифосфолипидные антитела (аФЛ) [2]. Показано, что с наличием аФЛ ассоциируются от 7 до 25% случаев необъяснимого привычного выкидыша (ПВ) [3].
Антитела к кардиолипину (КЛ) и β2-гликопротеину-I (β2-ГП-I) классов M и G и волчаночный антикоагулянт представляют лабораторные классификационные критерии антифосфолипидного синдрома (АФС), принятые в настоящее время, одним из клинических проявлений которого является ПВ до 10-й недели гестации [4]. Скрининг этих классических аФЛ проводится в установленном порядке при обследовании женщин с ПВ [2]. Однако у значительной части женщин с клиническими признаками акушерского АФС выявляются отрицательные результаты в тестах на классические аФЛ. В связи с этим в случаях серонегативного АФС важное значение приобретают исследования широкого спектра аФЛ, не включенных в лабораторные критерии АФС [5]. Высокая распространенность так называемых «некритериальных» аФЛ продемонстрирована у больных АФС по сравнению с контрольной группой [6].
Большая часть исследований фокусировалась на изучении аФЛ классов M и G. В немногочисленных работах, посвященных изучению клинического значения IgA-антител к КЛ и β2-ГП-I, были получены противоречивые результаты [7]. Эти антитела не были включены в классификационные критерии АФС 2006 г. из-за отсутствия необходимых доказательств; однако позже рабочая группа XIII Международного конгресса по аФЛ рекомендовала проведение тестирования на IgA-антитела к β2-ГП-I серонегативных пациентов с клиническими признаками АФС [5].
При серонегативном АФС часто выявляются «некритериальные» аФЛ (в 58,3% случаев), в том числе в 30,5% случаев обнаруживаются антитела к фосфатидилэтаноламину (аФЭ) [8]. Показана выраженная ассоциация привычной потери беременности с кининоген-зависимыми аФЭ [9]; аФЭ, как и антитела к комплексу фосфатидилсерин/протромбин (ФС/ПТ), могут быть единственными найденными аФЛ у больных с клиническими проявлениями АФС [10].
Особый научный интерес представляют исследования антител к компоненту комплемента C1q, который является пусковой молекулой классического пути активации системы комплемента, относится к семейству коллектинов, широко распространен в плаценте и играет регуляторную роль в поддержании беременности [11]. В недавнем исследовании показана распространенность анти-C1q антител у женщин с необъяснимой привычной потерей беременности [12].
Кроме того, антитела к гормонам беременности, а именно к хорионическому гонадотропину человека (ХГЧ) и прогестерону (ПГ), рассматриваются как возможный фактор риска привычного невынашивания беременности [13].
Однако в настоящее время описанные выше тесты на «некритериальные» аФЛ, антитела к C1q и ПГ не применяются в рутинной лабораторной практике; продолжается исследование взаимоотношений между антителами разной специфичности и их значений для диагностики акушерской патологии.
В связи с вышеизложенным, цель настоящего исследования – определить диагностическое значение аутоантител и факторы риска угрожающего выкидыша у женщин с ранними потерями беременности.
Материалы и методы
Исследуемую группу составили 80 женщин с потерями беременности на ранних сроках, обратившихся в научно-поликлиническое отделение НМИЦ АГП им. академика В.И. Кулакова и прошедших клиническое и лабораторно-инструментальное обследования, а также получивших стационарное лечение в Центре по поводу угрожающего выкидыша в I триместре; из них: 31 (38,8%) женщина вне беременности и 49 (61,3%) беременных, из которых были сформированы две подгруппы: подгруппа 1, включающая 29 (59,2%) женщин с угрожающим выкидышем в I триместре беременности; подгруппа 2, включающая 20 (40,8%) женщин без угрозы прерывания на ранних сроках. Средний возраст женщин составлял 31,5 (5,6) года. В анамнезе у женщин наблюдалось 2,3 (1,3) случая потерь беременности в сроке 7,5 (1,4) недели гестации.
К критериям исключения относили наличие пороков развития половых органов, беременности после программ вспомогательных репродуктивных технологий, носительство хромосомных перестроек, генетические аномалии у плода, выраженные эндокринные нарушения, тяжелую соматическую и аутоиммунную патологию, острые инфекционные заболевания.
Протокол исследования одобрен Комиссией по этике биомедицинских исследований НМИЦ АГП им. В.И. Кулакова. До включения в исследование от всех пациенток было получено письменное информированное согласие на участие в исследовании и использование их биологического материала.
В сыворотке крови женщин с помощью иммуноферментного анализа (ИФА) определяли антитела классов A, M и G к КЛ (аКЛ) и β2-ГП-I (аβ2-ГП-I), антитела классов M и G к ФС (аФС), аФЭ, комплексу ФС/ПТ (аФС/ПТ), IgG-антитела к компоненту комплемента C1q (аC1q) с использованием наборов ORGENTEC Diagnostika и IBL International (Германия). Определение данных антител проводили в соответствии с инструкциями, прилагаемыми к наборам. IgM- и IgG-антитела к ХГЧ (аХГЧ) и ПГ (аПГ) определяли с использованием препаратов высокоочищенного ХГЧ и конъюгата ПГ 3-(O-карбокси-метил) оксим-БСА (Sigma-Aldrich, США), моноклональных антител против IgM, IgG человека, меченных пероксидазой хрена (ХЕМА, Россия), с помощью ранее описанных модификаций ИФА [14, 15]. Для проведения анализа и измерения оптической плотности (ОП) применяли автоматический анализатор Alegria (ORGENTEC, Германия) или фотометр Multiskan EX (Thermo Electron (Shanghai) Instrument Co, Китай).
Статистический анализ
Статистический анализ полученных результатов проводили с помощью пакетов прикладных программ Microsoft Office Excel 2010, MedCalc v. 12 и IBM SPSS Statistics v. 26. С использованием тестов Колмогорова–Смирнова и Шапиро–Уилка определяли нормальность распределения значений в выборках. Количественные данные представляли при нормальном распределении в виде среднего арифметического (М) и стандартного отклонения (SD) в формате М (SD), при отклонении от нормального распределения – медианы (Me) и интерквартильного размаха в формате Me (Q1; Q3). Оценивали статистическую значимость различий между частотными показателями с помощью χ2-теста, между непрерывными величинами – U-теста Манна–Уитни. Различия считали статистически значимыми при уровне значимости P<0,05. Наличие связи между переменными определяли путем расчета коэффициента корреляции Пирсона, между независимыми переменными и зависимой бинарной переменной – путем проведения ROC-анализа (Receiver Operating Characteristics). Связь между фактором риска и исходом оценивали по величине показателя отношения шансов (ОШ).
Результаты и обсуждение
 С помощью ИФА у женщин с невынашиванием беременности были обнаружены аФЛ классов M и G суммарно у 37/80 (46,3%) женщин, а антитела к гормонам – у 50/80 (62,5%) женщин (P=0,04). аХГЧ и аПГ выявлялись у 36/80 (45%) и 32/80 (40%) женщин соответственно. Среди аФЛ наиболее часто обнаруживались аФЭ (27/80 (33,8%)), аβ2-ГП-I (22/80 (27,5%)), аКЛ (22/80 (27,5%)) и аФС (20/80 (25%)). аФС/ПТ выявлялись реже (у 9/80 (11,3%)), чем антитела к гормонам и аФЛ другой специфичности, частота выявления которых указана выше (P<0,05).
С помощью ИФА у женщин с невынашиванием беременности были обнаружены аФЛ классов M и G суммарно у 37/80 (46,3%) женщин, а антитела к гормонам – у 50/80 (62,5%) женщин (P=0,04). аХГЧ и аПГ выявлялись у 36/80 (45%) и 32/80 (40%) женщин соответственно. Среди аФЛ наиболее часто обнаруживались аФЭ (27/80 (33,8%)), аβ2-ГП-I (22/80 (27,5%)), аКЛ (22/80 (27,5%)) и аФС (20/80 (25%)). аФС/ПТ выявлялись реже (у 9/80 (11,3%)), чем антитела к гормонам и аФЛ другой специфичности, частота выявления которых указана выше (P<0,05).
Наиболее часто выявлялись IgM-аХГЧ (21/80 (26,3%)), аПГ (17/80 (21,3%)), аФЭ (16/80 (20%)), аКЛ (16/80 (20%)), аβ2-ГП-I (16/80 (20%)) и аФС (15/80 (18,8%)) (рис. 1А); при этом IgM-аФС/ПТ были найдены реже (6/80 (7,5%) женщин) указанных выше IgM-антител другой специфичности (P<0,05).
IgG-аХГЧ (26/80 (32,5%)) и аПГ (25/80 (31,3%)) обнаруживались чаще, чем IgG-аКЛ (11/80 (13,8%)), аФС (9/80 (11,3%)), аФС/ПТ (7/80 (8,8%)) (рис. 1Б). Выявлена сильная прямая корреляционная связь между уровнями антител классов M и G к КЛ, ФС и β2-ГП-I (r>0,9; P<0,001), а также между уровнями IgM-аХГЧ и аПГ (r=0,74; 95% ДИ 0,56–0,85; P<0,001).
Результаты изучения клинико-анамнестических данных беременных женщин с ранними потерями беременности, представленные в таблице 1, показали, что женщины обеих подгрупп были сопоставимы по возрасту, акушерскому анамнезу, гинекологической патологии, соматическим и аллергическим заболеваниям, заболеваниям ЛОР-органов; однако у всех беременных в подгруппе 1 в I триместре был диагностирован ранний угрожающий выкидыш, в отличие от беременных подгруппы 2, беременность которых протекала без угрозы прерывания.

Сравнительная оценка уровня антител у беременных с угрожающим выкидышем и без угрозы прерывания выявила в подгруппе 1 значимо более высокие медианные уровни IgG-аКЛ, аβ2-ГП-I, аФС, аФС/ПТ, а также IgG-аПГ и аХГЧ и IgM-аПГ, чем в подгруппе 2 (табл. 2).
В подгруппе 1 наблюдалась более высокая частота выявления IgG-аКЛ (8/29 (27,6%)), аβ2-ГП-I (10/29 (34,5%)), аФЭ (11/29 (37,9%)) и IgM- и IgG-а ПГ (9/29 (31%) и 10/29 (34,5%)) по сравнению с частотой выявления аналогичных антител в подгруппе 2 (1/20 (0,05%)); при этом значения χ2 составляли соответственно 3,9 (P=0,047), 5,8 (P=0,02), 6,8 (P=0,01), 4,8 (P=0,03) и 5,8 (P=0,02). Высокие значения ОШ были получены для IgG-аβ2-ГП-I (ОШ=10; 95% ДИ 1,2–86,0; P=0,04), IgG-аФЭ (ОШ=11,6; 95% ДИ 1,36–99,3; P=0,03), IgM-аПГ (ОШ=19; 95% ДИ 1,04–348,4; P=0,047) и IgG-аПГ (ОШ=10; 95% ДИ 1,2–86,0; P=0,04), что подтверждает наличие выраженной ассоциации данных антител с ранним угрожающим выкидышем у женщин с невынашиванием беременности.,
Особый интерес представляло исследование распространенности у женщин с невынашиванием беременности аФЛ класса A. IgA-аβ2-ГП-I обнаруживались чаще (у 13/80 (16,3%) женщин), чем IgA-аКЛ (у 5/80 (6,3%) женщин) (P=0,046). аКЛ класса A во всех случаях выявлялись в сочетании с IgA-аβ2-ГП-I. IgA-аβ2-ГП-I были обнаружены у 11 беременных женщин (11/49 (22,4%)) и у 2 небеременных (2/31 (6,5%)) (P=0,06), в том числе были найдены у 8/29 (27,6%) женщин с угрозой прерывания беременности на ранних сроках. Следует отметить, что у 4/49 (8,2%) беременных IgA-аβ2-ГП-I были единственными обнаруженными аФЛ. Между уровнями IgA- и IgG-а КЛ и аβ2-ГП-I была обнаружена умеренная прямая корреляционная связь (r=0,49; 95% ДИ (0,27–0,67); P=0,001); r=0,34; 95% ДИ (0,09–0,55); P=0,01); между уровнем IgA-антител двух специфичностей наблюдалась прямая корреляционная связь средней силы (r=0,58; 95% ДИ (0,38–0,73); P<0,001).
Полученные результаты согласуются с данными литературы, демонстрирующими у больных АФС более частое обнаружение изолированных IgA аβ2-ГП-I, чем IgA аКЛ, и плохую корреляцию изолированной позитивности на IgA аКЛ с клиническими проявлениями АФС [16]. У больных АФС описана более высокая распространенность IgA-а β2-ГП-I по сравнению с IgM-аβ2-ГП-I и аКЛ, относящимися к классификационным критериям АФС [16, 17].
В нашем исследовании медианные уровни IgA-аКЛ и аβ2-ГП-I у беременных с угрозой прерывания на ранних сроках составляли 1,4 (1; 120) APL-Ед/мл и 3,4 (1,4; 100) Ед/мл, а у беременных без угрозы прерывания – 1,1 (1; 3,7) APL-Ед/мл и 1,7 (0,5; 9,6) соответственно (рис. 2). Медианный уровень IgA-а β2-ГП-I был значимо выше в подгруппе 1, чем в подгруппе 2.

Обращает на себя внимание тот факт, что наряду с аКЛ и аβ2-ГП-I в сыворотке крови у женщин с невынашиванием беременности с высокой частотой выявлялись аФЭ (суммарно у 27/80 (33,8%) женщин). Важно отметить, что у 8/80 (10%) женщин присутствовали только аФЭ без аФЛ другой специфичности. У женщин, позитивных на аФЭ, наблюдались ранние потери беременности в анамнезе или угроза прерывания в I триместре во время настоящей беременности. Отмечалась тенденция к повышению уровня IgG-аФЭ у беременных с угрозой прерывания на ранних сроках по сравнению с беременными без угрозы (P=0,05).
По данным некоторых авторов, аФЭ ассоциируются с риском потери беременности на ранних сроках. Недавно показано, что у женщин с длительно персистирующими аФЭ частота выкидышей значимо выше (40,7%), чем у женщин с транзиторными антителами (20,0%; P=0,02) [18]. Предполагается, что длительно персистирующие аФЭ являются патогенными.
Хотя аФС/ПТ выявлялись у женщин с невынашиванием беременности значимо реже, чем антитела к гормонам и β2-ГП-I, КЛ и ФЭ, однако у 3/80 (3,8%) женщин IgG-аФС/ПТ были единственными найденными аФЛ; их обнаружение способствовало более полному выявлению пациенток с АФС. Наши результаты согласуются с данными Zigon P. et al. (2015), согласно которым аФС/ПТ ассоциируются с ПВ на ранних сроках [19]. В международном мультицентровом исследовании показано, что IgG аФС/ПТ обнаруживаются как при сосудистом, так и при акушерском АФС и могут играть роль дополнительного маркера АФС [10].
Mekinian A. et al. недавно продемонстрировали эффективность проведения терапии АФС для снижения частоты потери беременности у женщин, серопозитивных на «некритериальные» аФЭ и аФС/ПТ [20]. Тест на аФС/ПТ предлагается для обследования женщин с привычной потерей беременности [21]. Проведение терапии, применяемой при АФС, у пациенток с привычным невынашиванием и изолированной позитивностью на «некритериальные» антитела способствует значительному увеличению частоты рождения живых детей [22].
Установлено и экспериментально доказано, что в развитии акушерской патологии при АФС важную роль играет активация системы комплемента по классическому пути, которая инициируется связыванием компонента комплемента C1q с иммунными комплексами [23]. При АФС описано образование аC1q, способных усиливать активацию комплемента, нарушать биологическую функцию C1q, связанную с удалением иммунных комплексов и апоптотических клеток, и тем самым содействовать развитию аутоиммунитета [11, 23]. В связи с этим особый интерес представляло исследование у женщин с ранними потерями беременности и угрожающим выкидышем не только антител к фосфолипидам и гормонам, но и малоизученных аC1q.
IgG-аC1q были обнаружены у 8/80 (10%) пациенток: у 6/49 (12,2%) беременных, в том числе у 5/29 (17,2%) женщин с ранним угрожающим выкидышем, и у 2/31 (6,5%) женщин вне беременности. Медианный уровень IgG-аC1q у женщин с угрожающим выкидышем (2,4 (1,0; 91,5) Ед/мл) был значимо выше медианного уровня антител у беременных без угрозы прерывания (1,9 (1,0; 3,4) Ед/мл) (рис. 2). аC1q выявлялись в разных сочетаниях с аФЛ и антителами к гормонам; при этом у женщин, позитивных на аC1q, отмечался повышенный уровень аβ2-ГП-I, аФЭ, аПГ и аХГЧ в трех случаях из пяти (рис. 3). Следует отметить, что между уровнями IgG-а C1q и аПГ была выявлена прямая корреляционная связь средней силы (r=0,57; 95% ДИ 0,37–0,72; P<0,001).
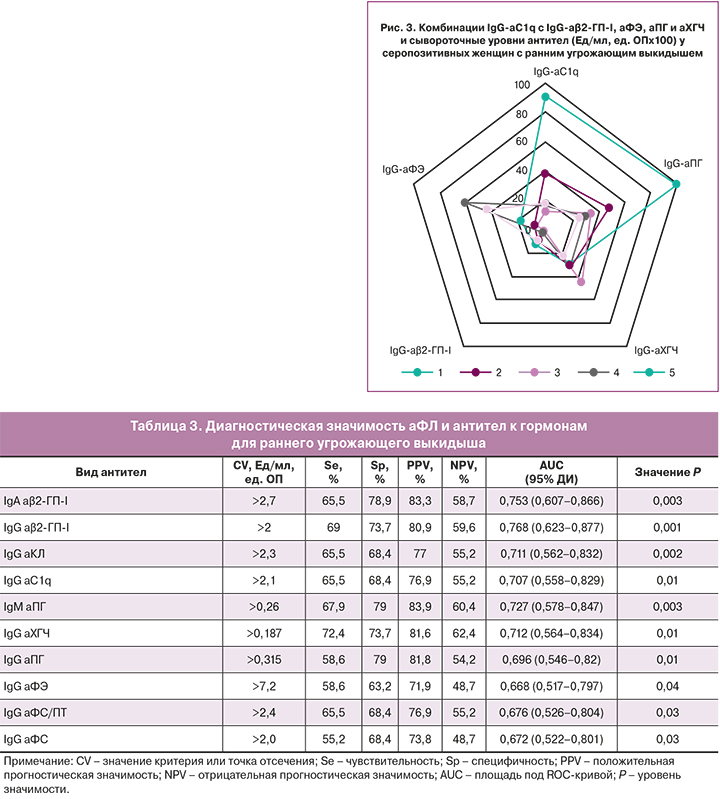
Полученные результаты согласуются с данными о более высокой распространенности аC1q при первичном АФС [23], а также у пациенток с необъяснимыми привычными потерями беременности [12]. Предполагается, что аC1q усиливают активацию комплемента и местное повреждение тканей, взаимодействуя с молекулами C1q, связанными с иммунными комплексами, апоптотическими клетками и непосредственно с анионными фосфолипидами, экспонированными на поверхности клеток, в частности трофобласта и эндотелия [24]. Высокие титры аC1q могут усиливать повреждение плацентарной ткани, приводя к потере плода или задержке роста плода, особенно у пациенток с привычной потерей беременности и акушерским АФС [12].
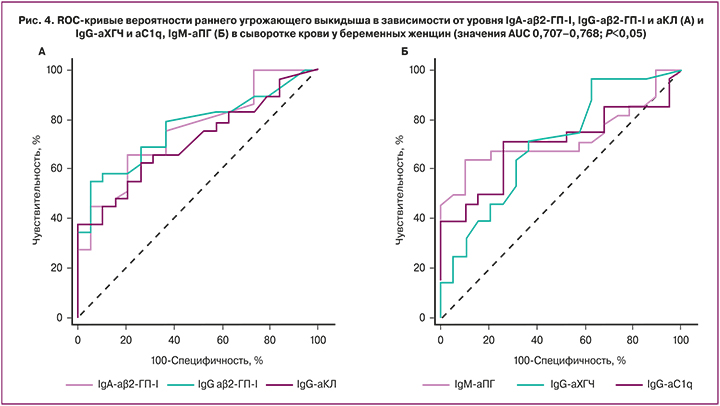
По данным ROC-анализа, определение IgG- и IgA-аβ2-ГП-I, IgG-аКЛ, аХГЧ и аC1q, IgM-аПГ характеризовалось высокими показателями чувствительности, специфичности, AUC и положительной прогностической значимости в отношении раннего угрожающего выкидыша (табл. 3); показатели точности тестов составляли от 60% до 67%. Следует отметить, что, по данным ряда авторов, определение IgA-аβ2-ГП-I характеризуется более высокой чувствительностью для диагностики АФС, чем определение классических IgM-аβ2-ГП-I и аКЛ [16, 17].
ROC-кривые позволяли эффективно дифференцировать пациенток с ранним угрожающим выкидышем и беременных без угрозы прерывания по уровню IgG- и IgA-аβ2-ГП-I, IgG-аКЛ, аХГЧ и аC1q, IgM-аПГ; при этом предсказательная способность модели оценивалась по значениям AUC >0,7 как хорошая (рис. 4).
При определении IgG-аβ2-ГП-I в комбинации с IgA-а β2-ГП-I значение AUC возрастало до 0,788 (95% ДИ 0,646–0,842; P=0,003); при этом точность тестов достигала 70,8%. Комбинация тестов на IgA- и IgG-аβ2-ГП-I с тестом на IgG-аХГЧ была наиболее эффективной для диагностики раннего угрожающего выкидыша по сравнению с другими тестами; при этом значение AUC составляло 0,858 (95% ДИ (0,727–0,942); P<0,001), точность тестов повышалась до 77,1%.
Заключение
Таким образом, для женщин с ранними потерями беременности характерно повышенное образование широкого спектра аутоантител, включающего антитела к гормонам ХГЧ и ПГ и аФЛ, как классические классов M и G к КЛ и β2-ГП-I, отнесенные к критериям АФС, так и «некритериальные» IgA-аКЛ и аβ2-ГП-I, аФЭ, аФС/ПТ, аC1q. аC1q часто выявляются в комбинации с аβ2-ГП-I,а ФЭ, аПГ и аХГЧ. IgA- и IgG-аβ2-ГП-I, IgG-аКЛ, аC1q и аХГЧ, IgM-аПГ имеют высокое диагностическое значение для раннего угрожающего выкидыша. Выявление «некритериальных» аФЭ, аФС/ПТ и IgA-аβ2-ГП-I способствует повышению эффективности диагностики акушерского АФС. IgG-аβ2-ГП-I, аФЭ, IgM- и IgG-аПГ являются возможными факторами риска раннего угрожающего выкидыша.



