Гипотиреоз является одним из наиболее частых проявлений заболеваний щитовидной железы, затрагивает 3–5% беременных женщин и представляет серьезную проблему как для матери, так и для плода. Дефицит гормонов щитовидной железы у беременной повышает риск развития осложнений беременности, преждевременных родов, отслойки плаценты, преэклампсии, пороков развития плода [1].
Поэтому во время беременности крайне важна своевременная диагностика этого состояния и поиск предикторов его развития.
Ведущим патогенетическим фактором гипотиреоза является аутоммунный процесс, в котором значительную роль играет генетический фактор [2]. На сегодняшний день установлена связь заболевания с антигенными вариантами локуса главного комплекса гистосовместимости HLA-DR, играющего важную роль в представлении как чужих, так и собственных антигенов [3, 4]. Среди других генов, участвующих в регуляции иммунного ответа, для некоторых популяций показана ассоциация аутоиммунного гипотиреоза с полиморфизмом генов CD40, CD25, BTG1, CTLA4, PTPN22 [2, 5]. Генетические факторы определяют только риск развития заболевания, который может значительно повышаться от внешних факторов: популяционные особенности, стиль жизни, диета, содержание йода в рационе, инфекции и др. Известно, что беременность может являться фактором, провоцирующим реализацию скрытых и обострение хронических заболеваний. Поэтому можно было ожидать, что у беременных будет более выраженная ассоциация генетических полиморфизмов с заболеванием, тем более что беременность является существенным фактором, повышающим шанс проявления гипотиреоза [6, 7].
 Однако работ, посвященных роли генетических факторов в развитии данного заболевания при беременности, на сегодняшний день нет. Поэтому целью настоящей работы было исследование ассоциаций полиморфизмов генов цитотоксического Т-лимфоцит-ассоциированного белка 4 (СТLА-4) и белка тирозин фосфатазы 22 (PTPN-22) с гипотиреозом у беременных российской популяции.
Однако работ, посвященных роли генетических факторов в развитии данного заболевания при беременности, на сегодняшний день нет. Поэтому целью настоящей работы было исследование ассоциаций полиморфизмов генов цитотоксического Т-лимфоцит-ассоциированного белка 4 (СТLА-4) и белка тирозин фосфатазы 22 (PTPN-22) с гипотиреозом у беременных российской популяции.
Материал и методы исследования
В исследование были включены 179 женщин с одноплодной беременностью. В основную группу вошли 66 женщин с субклиническим или манифестным гипотиреозом. Контрольную группу составили 113 беременных, не имеющих тяжелой экстрагенитальной патологии, эндокринопатий, акушерских и гинекологических осложнений.
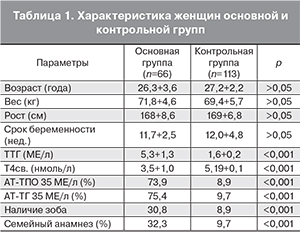
Женщины, включенные в исследование, были в возрасте от 19 до 41 года в обеих группах. Средний возраст, массо-ростовые показатели и срок беременности основной и контрольной групп не различались (табл. 1).
 Определение тиреотропного гормона (ТТГ), свободного тироксина (Т4св.), антител к тиреопероксидазе и антител к тиреоглобулину проводили иммуноферментным методом с использованием коммерческих наборов фирмы SIEMENS: IMMULITE 1000 Rapid TSH, IMMULITE®1000 Free T4, IMMULITE 2000 Anti-TPO Ab и IMMULITE 2000 ANTY-TG Ab.
Определение тиреотропного гормона (ТТГ), свободного тироксина (Т4св.), антител к тиреопероксидазе и антител к тиреоглобулину проводили иммуноферментным методом с использованием коммерческих наборов фирмы SIEMENS: IMMULITE 1000 Rapid TSH, IMMULITE®1000 Free T4, IMMULITE 2000 Anti-TPO Ab и IMMULITE 2000 ANTY-TG Ab.
Определение полиморфизма генов СТLА-4 и PTPN-22 проводили методом аллель-специфической полимеразной цепной реакции (ПЦР) с использованием флуоресцентно меченного олигонуклеотидного зонда и анализа кривой плавления [8].
Характеристика полиморфизмов генов СТLА-4 и PTPN-22 приведена в табл. 2.
ПЦР и определение температуры плавления олигонуклеотидных проб проводили с использованием праймеров, наборов реактивов и детектирующего амплификатора ДТ-96, разработанных в ООО «НПО ДНК-Технология», Россия.
 Статистическую обработку проводили с использованием программ Statistica 8 и WinPepi version 11.39.
Статистическую обработку проводили с использованием программ Statistica 8 и WinPepi version 11.39.
Результаты исследования
Основным лабораторным критерием диагностики гипотиреоза является уровень ТТГ, который достоверно различался в группах (табл. 1). Определение тироидного статуса проводилось в конце 1-го – начале 2-го триместра беременности (10–16 недель). Критерием для постановки диагноза являлся уровень ТТГ более 2,5 МЕ/л, нормальный или сниженный уровень Т4св. Референсный интервал для ТТГ составил 0,1–2,5 МЕ/л. Следует отметить, что в исследование включены женщины, у которых диагноз гипотиреоза был поставлен впервые при беременности. Субклинический гипотиреоз имел место у 59 (90,8%) женщин основной группы. Уровень Т4св. был у них нормальным или находился на нижней границе референсных значений. Манифестный гипотиреоз характеризовался повышением уровня ТТГ и снижением Т4св. и был диагностирован у 6 (9,2%) женщин основной группы.
У женщин обеих групп исследовался также уровень антител к тканям щитовидной железы. Достоверно чаще повышение титра АТ-ТПО и АТ-ТГ встречалось у женщин основной группы в 73,9 и в 75,4% соответственно по сравнению с контрольной группой, где эти показатели составили 8,9 и 9,7%, что указывает на высокую вероятность аутоиммунного характера возникновения гипотиреоза.
Увеличение объема щитовидной железы – зоб 1-й и 2-й степени (по классификации ВОЗ) наблюдалось у 30,8% беременных женщин с гипотиреозом и у 8,9% в контрольной группе (р<0,001).
Данные семейного анамнеза показали, что встречаемость заболеваний щитовидной железы у ближайших родственников пациенток основной группы была значительно выше, чем среди родственников женщин контрольной группы. У 16,9% беременных основной группы в семейном анамнезе имелись указания на наличие других аутоиммунных заболеваний (сахарный диабет, ревматоидный артрит, антифосфолипидный синдром, миастения).
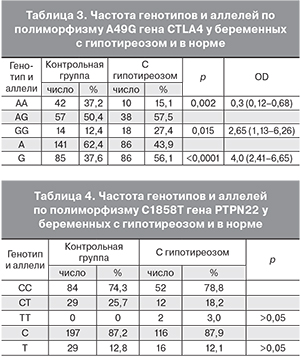
Проведенные в настоящей работе данные генотипирования исследуемых групп в отношении полиморфизма A49G в гене СTLA4 показали (табл. 3), что в основной группе достоверно чаще, чем в контрольной выявлялись беременные с генотипом GG – 27,4 и 12,4%, соответственно (р=0,015). Вычисление отношения шансов показало, что у носителей генотипа GG почти в 3 раза повышен риск развития гипотиреоза (OR=2,65, 95% Cl=1,13–6,26). Наоборот, носительство генотипа АА ассоциируется с более низким риском заболевания гипотиреоза у беременных (OR=0,3, 95% Cl=0,12–0,68). Частота аллеля G в гомозиготном или гетерозиготном варианте в группе беременных с гипотиреозом также была достоверно выше, чем в контрольной группе. Отношение шансов составило 4,0 (95% Cl=2,41–6,65).
В то же время исследуемые группы практически не различались по частоте полиморфизма С1858Т гена PTPN22 (табл. 4).
Обсуждение полученных результатов
Аутоиммунная причина возникновения гипотиреоза в большинстве случаев не вызывает сомнений. Согласно данным генеалогических исследований большинство больных с аутоиммунным тиреоидитом имеют отягощенную наследственность как по этому заболеванию, так и по другим аутоиммунным нарушениям (системная красная волчанка, ревматоидный артрит, тромбоцитопения, гемолитическая анемия, сахарный диабет и др.) [2, 5]. В литературе широко обсуждается семейная предрасположенность к заболеваниям щитовидной железы. Так еще в 1960 г. R. Hall и J. Stanbury [9] показали, что у 33% братьев и сестер пациентов с гипо- или гипертиреозом развиваются аутоиммунные заболевания щитовидной железы. M. Dittmar и соавт. в своем исследовании указывают на 16-кратное увеличение риска у детей от пациентов с уже имеющейся аналогичной патологией [10].
С этим согласуются и полученные нами данные, указывающие на более чем в 3 раза повышенную частоту гипотиреоза у ближайших родственников беременных с гипотиреозом (табл. 1).
СТLА-4 является супрессором активации Т-клеток, конститутивно экспрессируется регуляторными Т-клетками и нарушение его функции часто ассоциируется с аутоиммунными заболеваниями [11]. Полиморфизм А49G в гене СТLА-4, сопровождающийся заменой в 17-й аминокислоте белка треонин на аланин, ассоциируется с различными аутоиммунными патологиями. На сегодняшний день опубликованы 2 мета-анализа, проведенные в различных странах, которые показали в итоге достоверную ассоциацию полиморфизма А49G с иммунным гипотиреозом Хошимото только в 11 из 26 публикаций, преимущественно в азиатской популяции [12, 13]. При этом отношение шансов для аллеля 49G по их данным не превышало значения 1,5. Беременность сама может быть провоцирующим фактором гипотиреоза, чем, по-видимому, объясняется выявленный в нашей работе более высокий (3–4-кратный) риск гипотиреоза у носителей аллеля G.
Ген PTPN-22 участвует в Т-клеточной активации, и его полиморфизм С1858Т также ассоциирован с аутоиммунными заболеваниями. Однако в отношении патологии щитовидной железы при исследовании как азиатских, так и европейских популяций убедительно показана связь полиморфизма R620 W с гипертиреозом (болезнь Грейвса), но не с гипотиреозом [14]. По нашим данным исследуемые группы беременных российской популяции также практически не различались по частоте полиморфизма С1858Т гена PTPN22 (табл. 4).



