Гиперплазия эндометрия (ГЭ) представляет собой спектр нерегулярных морфологических изменений, в результате которых происходит аномальная несимметричная пролиферация желез эндометрия с увеличением железистого компонента по отношению к строме [1]. В классификации ВОЗ 2014 г. гиперпластические процессы эндометрия дифференцированы на две категории: ГЭ без атипии и атипическая ГЭ, или эндометриоидная интраэпителиальная неоплазия (EIN) [2].
Патофизиология ГЭ связана с чрезмерной и непрерывной стимуляцией эндометрия эстрогенами [3]. К факторам риска относятся хроническая ановуляция, синдром поликистозных яичников (СПКЯ), ожирение, терапия тамоксифеном и монотерапия эстрогенами [3–5]. Заболеваемость ГЭ составляет 133–208 на 100 000 женщин-лет; при этом показатели заболеваемости для ГЭ без атипии – 121 на 100 000 женщин-лет и 16,8 на 100 000 женщин-лет – для атипичной ГЭ [6].
Клиническое значение диагноза ГЭ связано с возникновением аномальных маточных кровотечений, а также долгосрочным риском прогрессирования в эндометриоидный рак эндометрия (РЭ) [7]. Наличие и степень выраженности цитологической атипии и морфологии являются ключевыми факторами, определяющими риск малигнизации: при ГЭ без атипии малигнизация происходит у 5% пациенток в течение 20 лет [7], в то время как у 40% пациенток с EIN в течение года после установления диагноза развивается рак эндометрия [8].
Получены данные о молекулярно-генетических детерминантах ГЭ у женщин Центрального Черноземья России. Пономаренко И.В. и соавт. установлена ассоциация полиморфизма rs4986938 гена ESR2 c развитием ГЭ [9]. Известно, что значительный вклад в уровень циркулирующих эстрогенов у женщин вносит преобразование андрогенов в периферических тканях, в частности в жировой ткани. Основным ферментом, катализирующим превращение тестостерона в эстрадиол и андростендиона в эстрон, является CYP19A1-ароматаза [10,11]. Полиморфизм гена CYP19A1, возможно, связан с развитием ГЭ, особенно у женщин с повышенной массой тела.
Цель – провести анализ распространенности вариантов полиморфизма rs2414098 гена CYP19A1 и определить ассоциацию выявленных генотипов данного полиморфизма с риском возникновения ГЭ у женщин.
Материалы и методы
В исследование включены 180 жительниц Республики Татарстан. Основную группу составили 79 пациенток с ГЭ без атипии (N85.0). Контрольная группа была сформирована из 101 женщин без патологии эндометрия, поступивших на оперативное лечение в гинекологическое отделение ГАУЗ ГКБ №7 г. Казани с диагнозом опущение и выпадение половых органов (N81). Средний возраст пациенток с ГЭ без атипии составил 41,8 (7,9) года, контрольной группы – 70,5 (5,4) года.
Критериями включения женщин в исследование стали: проживание в Республике Татарстан, белая раса, выявление на момент исследования ГЭ или отсутствие патологии эндометрия. Критериями исключения пациенток из исследования были полипы эндометрия, ГЭ с атипией и РЭ. Набор женщин в группы проводили по результатам гистологического исследования биоптатов эндометрия и операционного материала удаленной матки. Участие женщин было добровольным и конфиденциальным. Протокол исследования был одобрен этическим комитетом Казанского ГМУ. Протокол № 6 от 25.06.2019. Исследование проводили в соответствии с принципами Хельсинкской декларации.
Определение полиморфизма rs2414098 гена СYP19А1 было проведено методом полимеразной цепной реакции (ПЦР) в реальном времени с помощью коммерческого набора реактивов фирмы «ТестГен» (Ульяновск, Россия). Предварительно была выделена ДНК из лейкоцитов цельной крови пациенток, используя наборы реагентов «Проба Рапид-Генетика» ООО «ДНК-Технология» (Москва, Россия). Амплификация и детекция участка исследуемого гена были выполнены на амплификаторе СFX96 (BioRad, США).
Статистическую обработку полученных результатов проводили с использованием программного обеспечения Microsoft Excel 2013 версии для Windows, а также с использованием пакета прикладных программ GraphPad Prism 8.2.0. Для проверки гипотезы о законе распределения использовался критерий Колмогорова–Смирнова. Для количественных данных с нормальным распределением были использованы среднее арифметическое (М) и стандартное отклонение (SD). Распределения, отличные от нормального, описывали как медиану (Me) и квартили Q1 и Q3 в формате Me (Q1; Q3).
Для определения статистической значимости различий средних величин при нормальном распределении применялся t-критерий Стьюдента. Для признаков, имеющих распределение, отличное от нормального, применялся непараметрический метод с использованием критерия Манна–Уитни. За уровень значимости в исследовании принято р<0,05. Проведена оценка подчинения распределения генотипов выборок равновесию Харди–Вайнберга и χ2-тест, а также показателя отношения шансов (ОШ).
Результаты
Средний возраст менархе не имел статистически значимых отличий между группами (таблица). В состоянии менопаузы находились 100% женщин группы контроля. Женщины с ГЭ без атипии имели менструальную функцию. Обращает на себя внимание разница по количеству беременностей и родов у женщин разных поколений (р<0,001). При анализе исходов беременностей, по частоте выкидышей разницы между группами не выявлено, однако женщины старшего поколения статистически значимо отличались по частоте артифициальных абортов и срочных родов (р<0,001).
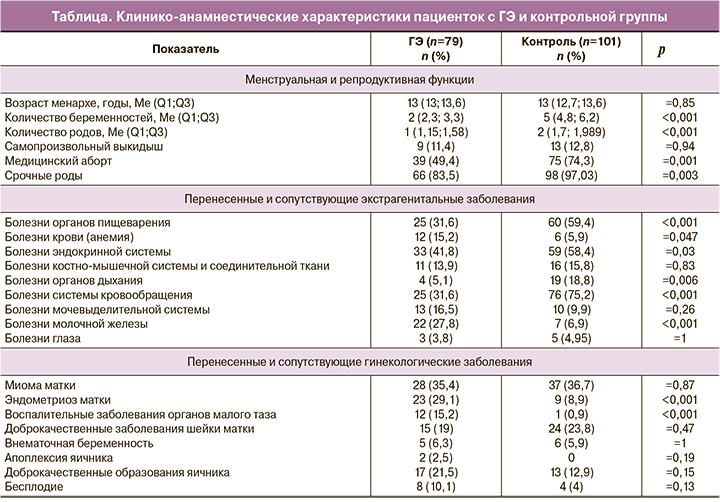
 Женщины контрольной группы имели статистически значимые отличия по частоте экстрагенитальных заболеваний. По частоте гинекологических заболеваний у женщин с ГЭ без атипии чаще встречались эндометриоз матки и воспалительные заболевания органов малого таза (р<0,001).
Женщины контрольной группы имели статистически значимые отличия по частоте экстрагенитальных заболеваний. По частоте гинекологических заболеваний у женщин с ГЭ без атипии чаще встречались эндометриоз матки и воспалительные заболевания органов малого таза (р<0,001).
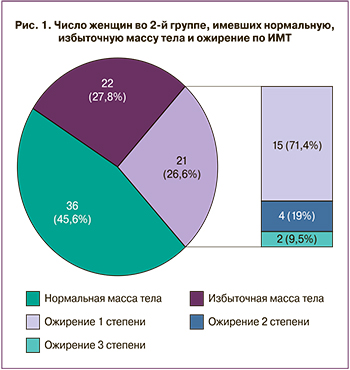
Пациентки исследуемых групп отличались по индексу массы тела (ИМТ): ИМТ в основной группе составил 26,6 (5,7) кг/м2, в контрольной – 28,9 (4,6) кг/м2 (р<0,05). Среди пациенток с ГЭ без атипии 36 (45,6%) пациенток имели нормальную массу тела, 22 (27,8%) – избыточную, 21 (26,6%) – ожирение. Среди женщин с ожирением у 15 (71,4%) определялось ожирение 1-й степени, у 4 (19%) – ожирение 2-й степени, у 2 (9,5%) – ожирение 3-й степени. Повышенную массу тела (ИМТ>25 кг/м2) имели 43 женщины, что составило 54,4%, то есть более половины женщин с ГЭ имели избыточную массу тела (рис. 1).
В контрольной группе нормальную массу тела имели 18 (17,82%) женщин, избыточную – 46 (45,54%), ожирение – 37 (36,63%), из них ожирение 1-й степени – 24 (64%), ожирение 2-й степени – 13 (35,1%). Повышенную массу тела имели 83 (82,18%) женщины. Шанс развития ГЭ без атипии значимо возрастал при повышенной массе тела, когда ИМТ составлял 25 кг/м2 и более (ОШ=3,86, 95% ДИ 1,97–7,58, р<0,001).
Распределение частот генотипов в локусе rs2414098 гена СYP19А1 в основной и контрольной группе соответствовало закону Харди–Вайнберга (χ2=0,29, p=0,59; χ2=0,04, р=0,85 соответственно). Исследование rs2414098 гена CYP19A1 позволило выявить, что в группе пациенток с ГЭ без атипии соотношение гомозигот по С аллелю (СС), гетерозигот (CA) и гомозигот по A аллелю (AA) было 40 (50,63%), 31 (39,24%), 8 (10,13%), а в контрольной группе – 34 (33,7%), 50 (49,5%), 17 (16,8%) соответственно. Распространенность аллелей и генотипов гена СYP19А1 rs2414098 у женщин контрольной группы оказалась сопоставима с европейской популяцией (генотипы: СС – 35,8%, СА – 47,7%, АА – 16,5%; аллели: C – 59,6%, А – 40,4%) [11]. Частота аллеля С (70,3% против 58,4%; χ2=5,37; р=0,02; ОШ=1,68; 95% ДИ 1,08–2,61) и генотипа СС (50,6% против 33,7%; χ2=5,22; р=0,02; ОШ=2,02; 95% ДИ 1,10–3,70) была значимо выше у женщин с ГЭ без атипии по сравнению с контрольной группой (рис. 2 а, б).

Таким образом, С аллель СYP19А1 rs2414098 и С/С генотип статистически значимо увеличивали шанс развития у женщин ГЭ без атипии. Наличие аллели С и генотипа С/С полиморфизма rs2414098 гена СYP19А1 является фактором, повышающи риск развития ГЭ без атипии у женщин, проживающих на территории Республики Татарстан.
Проведено исследование частоты полиморфизма rs2414098 гена CYP19A1 у женщин с ГЭ в зависимости от массы тела. Статистически значимой разницы результатов по частоте распределения С аллели и С/С генотипов у женщин с нормальной массой тела, с ожирением в сопоставлении с контрольной группой не было выявлено (p>0,05). Таким образом, повышенная масса тела при ИМТ>25 кг/м2 является независимым от генетического предиктора гена CYP19A1 фактором риска развития ГЭ.
Обсуждение
Существуют выраженные возрастные различия синтеза эстрогенов у женщин. У женщин с сохраненной менструальной функцией эстрогены в основном продуцируются в яичниках, а у женщин в постменопаузе производство эстрогена яичниками резко снижается, и основным источником циркулирующих эстрогенов является преобразование андрогенов в эстрогены в периферических тканях (например, жировая ткань). Заключительный этап этого преобразования катализируется ароматазой [12]. Можно предположить, что роль ароматазы как ключевого фермента преобразования андрогенов в эстрогены возрастает с увеличением возраста женщины.
В развитых странах ежегодно регистрируется около 200 000 новых случаев ГЭ [13]. Максимум заболеваемости (386 на 100 000 женщин) наблюдается в возрасте 50–54 года, минимум (6 на 100 000 женщин) – в возрасте до 30 лет [7]. В связи с тем, что средний возраст развития ГЭ составляет 50–54 года, а РЭ – 59–62 года [14], в группу контроля производился набор женщин пожилого и старческого возраста: 100% женщин контрольной группы были старше 65 лет, т.е. в период, когда вероятность патологии эндометрия уменьшалась.
Исходя из предпосылки, что генетическая предрасположенность к ГЭ может оказывать влияние на эффективность лечения заболевания и прогрессирование его в рак и с учетом возраста женщин, нами был проведен анализ ассоциации полиморфизма гена CYP19A1 с риском развития ГЭ.
В геноме человека имеется одна копия гена ароматазы (CYP19А1), располагающаяся на длинном плече 15 хромосомы. Ген CYP19А1 включает 10 экзонов, 9 из которых – кодирующие [15]. Ген ароматазы CYP19А1 – высокополиморфный. При этом существуют выраженные межпопуляционные различия в частоте встречаемости полиморфных вариантов данного гена. Установлено, что некоторые полиморфизмы оказывают влияние на уровень гормонов [16]. Однонуклеотидные полиморфизмы в интроне гена CYP19A1 могут изменить механизм сплайсинга мРНК, в результате чего изменяется активность гена CYP19A1, что потенциально может служить фактором риска в патогенезе заболевания [17].
В результате проведенного исследования было установлено, что наличие С аллеля и С/С генотипа полиморфизма rs2414098 гена СYP19А1 являются факторами, повышающими риск развития ГЭ без атипии у женщин, проживающих на территории Республики Татарстан. Повышенная масса тела оказалась независимым фактором риска развития ГЭ без атипии. Изучение вопроса влияния наследственной предрасположенности на эффективность проводимой терапии требует дальнейшего продолжения исследований.
Заключение
У 180 жительниц Республики Татарстан, включенных в исследование, выявлены ассоциации полиморфизма rs2414098 гена СYP19А1 с риском развития ГЭ без атипии. Распространенность аллелей и генотипов полиморфизма rs2414098 гена СYP19А1 оказалась сопоставима с европейской.



