Анемия является наиболее распространенной проблемой, выявляемой при обследовании женщин репродуктивного возраста. Дефицит необходимых для нормального эритропоэза витаминов и минералов, таких как железо, медь, кобальт, витамины А, В12, В6, С, Е, фолиевая кислота, рибофлавин, никотиновая кислота, может приводить к анемии. Независимо от возраста чаще других причиной снижения гемоглобина становится дефицит железа и фолиевой кислоты. Системные эффекты анемии любой этиологии способны привести к значительному ухудшению качества жизни пациентов. Для женщин репродуктивного возраста профилактика и своевременное выявление анемии и дефицитных состояний особенно важно в свете возможного влияния на исходы беременности и здоровье новорожденных. Наиболее частой причиной анемии в мире, несмотря на всестороннее многолетнее освещение, остается дефицит железа. Современные профилактические и терапевтические стратегии позволяют в кратчайшие сроки безопасно устранить данную проблему, не позволяя развиться осложнениям. В свою очередь, метаболизм витамина В12 и фолиевой кислоты стал предметом особого внимания за счет спектра патологических изменений, связанных с их недостатком: от признания много лет назад, что дефицит фолиевой кислоты связан с анемией и дефектами нервной трубки у плода, до многочисленных результатов современных исследований их влияния как на исходы беременности, так и на здоровье женщины в целом.
Дефицит железа
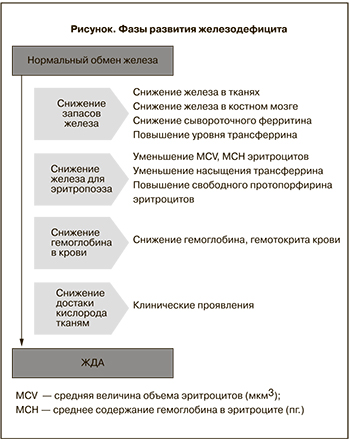
Недостаток железа является самой распространенной проблемой здравоохранения в мире, связанной с пищевым дефицитом [1], затрагивая фактически 200 млн населения [2]. У 50% из этих пациентов на фоне железодефицита возникает анемия [3]. Женщины репродуктивного возраста наиболее подвержены развитию железодефицита в связи с добавлением к существующим у других категорий пациентов факторов риска наличия регулярного менструального цикла (регулярная кровопотеря) и периодов беременности и лактации (значительное повышение потребности в железе) [4]. Во время беременности анемия выявляется у 51% женщин (56% в развивающихся странах, 18% – в развитых) [5]. Среди них 43% женщин в развивающихся странах и 12% женщин из развитых стран страдали анемией до наступления беременности [6]. Из всех анемий, диагностированных во время беременности, 75% обусловлены дефицитом железа [7]. Основы патофизиологии ЖДА идентичны для всех пациентов и обусловлены нарушением гомеостаза железа в организме [8]. Гомеостаз железа поддерживается, когда всасывание железа соответствует физиологическим потребностям для формирования эритроцитов и их функционирования. Любой недостаток потребления, увеличение утилизации железа или патологические потери крови приводят к дисбалансу, который без коррекции в конечном итоге приведет к ЖДА. Развитие дефицита железа – последовательный процесс, начинающийся с истощения запасов железа, необходимого для эритропоэза, приводящий к снижению уровня гемоглобина в крови, что приводит к уменьшению доставки кислорода к тканям, и у пациента развиваются клинические симптомы ЖДА. Фазы развития железодефицита представлены на рисунке [9].
Изменения гомеостаза железа во время беременности
Изменения гомеостаза железа во время беременности отражают физиологические изменения со стороны матери и растущие потребности плода. Дефицит железа в течение первых двух триместров беременности удваивает риск преждевременных родов, утраивает риск сниженного веса при рождении [10] и является причиной железодефицита у новорожденных [6]. В случае наличия железодефицита у детей может наблюдаться задержка развития и нарушение поведения, сохраняющиеся до восполнения запасов железа. Кроме того, ЖДА у матери коррелирует с повышенным фетоплацентарным ангиогенезом в течение первого триместра беременности, ведущим к увеличению у рожденных детей риска развития сердечно-сосудистой патологии во взрослом возрасте [11].
Диагностика железодефицита
Лабораторный анализ для выявления ЖДА включает исследование уровня гемоглобина, параметров эритроцитов, сывороточного железа, насыщения трансферрина и ферритина сыворотки. При беременности нижняя граница нормы гемоглобина отличается от таковой для небеременных женщин: в первом и втором триместрах уровни гемоглобина и гематокрита физиологически снижаются в связи с расширением объема циркулирующей плазмы. Для 12–16 недель норма составляет 110–106 г/л, в 20–24 недели – 105 г/л. У женщин с достаточным потреблением железа в течение третьего триместра отмечается рост гемоглобина и гематокрита до исходных уровней вне беременности [12].
 Наиболее специфичный тест для определения железодефицита – уровень сывороточного ферритина. Дефицит железа диагностируется, когда ферритин сыворотки составляет менее 12 мкг/л. Для скрининга дефицита железа у беременных женщин из развивающихся стран рекомендованный нижний предел составляет 30 мкг/л [13]. Однако в связи с тем, что ферритин не только отражает запасы железа, но и является неспецифическим маркером воспаления, при воспалительных заболеваниях его уровень может быть повышен и не позволит подтвердить дефицит железа [14]. Дополнительная оценка С-реактивного белка является методом, помогающим интерпретировать обоснованность оценки ферритина в качестве маркера дефицита железа – его повышение предполагает, что повышенный уровень ферритина не может быть использован. В этом случае очень полезнен анализ на растворимый рецептор трансферрина, так как он не зависит от наличия воспаления [15]. Уровень трансферрина увеличивается на ранней стадии развития дефицита железа. Этот транспортный белок нарастает в попытке доставки большего количества железа в ткани [4]. Сывороточные рецепторы трансферрина являются трансмембранными белками, которые присутствуют во всех клетках. Они связывают железо и транспортируют его внутрь клетки. Рецепторы увеличиваются с уменьшением количества доставляемого железа. Небольшое количество рецепторов трансферрина циркулирует в плазме. Это растворимые рецепторы трансферрина, которые могут быть измерены с помощью иммунологического анализа. Akesson и соавт. [16] установили, что определение сывороточного (растворимого) рецептора трансферрина на 100% специфично для выявления ЖДА во время беременности. Нормальный MCV не исключает дефицит железа, и у женщин во время беременности может быть нормохромная нормоцитарная ЖДА.
Наиболее специфичный тест для определения железодефицита – уровень сывороточного ферритина. Дефицит железа диагностируется, когда ферритин сыворотки составляет менее 12 мкг/л. Для скрининга дефицита железа у беременных женщин из развивающихся стран рекомендованный нижний предел составляет 30 мкг/л [13]. Однако в связи с тем, что ферритин не только отражает запасы железа, но и является неспецифическим маркером воспаления, при воспалительных заболеваниях его уровень может быть повышен и не позволит подтвердить дефицит железа [14]. Дополнительная оценка С-реактивного белка является методом, помогающим интерпретировать обоснованность оценки ферритина в качестве маркера дефицита железа – его повышение предполагает, что повышенный уровень ферритина не может быть использован. В этом случае очень полезнен анализ на растворимый рецептор трансферрина, так как он не зависит от наличия воспаления [15]. Уровень трансферрина увеличивается на ранней стадии развития дефицита железа. Этот транспортный белок нарастает в попытке доставки большего количества железа в ткани [4]. Сывороточные рецепторы трансферрина являются трансмембранными белками, которые присутствуют во всех клетках. Они связывают железо и транспортируют его внутрь клетки. Рецепторы увеличиваются с уменьшением количества доставляемого железа. Небольшое количество рецепторов трансферрина циркулирует в плазме. Это растворимые рецепторы трансферрина, которые могут быть измерены с помощью иммунологического анализа. Akesson и соавт. [16] установили, что определение сывороточного (растворимого) рецептора трансферрина на 100% специфично для выявления ЖДА во время беременности. Нормальный MCV не исключает дефицит железа, и у женщин во время беременности может быть нормохромная нормоцитарная ЖДА.
Скрининг на анемию необходим всем женщинам репродуктивного возраста. Ежегодный скрининг показан для женщин с факторами риска дефицита железа, такими как история тяжелой менструальной кровопотери, менструация продолжительностью более 5 дней, использование внутриматочных средств для контрацепции, желудочно-кишечные заболевания, низкое потребление железа с пищей, регулярные донации крови или ранее установленный диагноз ЖДА [17]. Несмотря на рекомендации, чтобы все беременные женщины получали дополнительную дозу железа, скрининг на анемию остается неотъемлемой частью первого пренатального визита [18]. Клинические проявления при нетяжелых формах ЖДА могут отсутствовать, нередко дефицит железа является лабораторной находкой.
Лечение железодефицита
Лечение изолированного железодефицита проводится при помощи препаратов железа. Лечение анемии легкой степени (90 г/л и более) проводится с применением препаратов железа внутрь. С данной целью используются соли двух- или трехвалентного железа (сульфат, глюконат, фумарат, гидроксид полимальтозат). Все беременные женщины должны получать железо дополнительно к обычному пищевому рациону [19] – не менее 27 мг элементарного железа в день для обеспечения потребностей плода, восполнения потерь во время родов и профилактики истощения запасов железа [20]. Доза для лечения составляет от 60 до 120 мг/сут элементарного железа. В случае сочетанного дефицита железа и фолатов или необходимости профилактики дефицита фолиевой кислоты, витамина В12 (при беременности или в случае особенностей диеты) назначаются комбинированные препараты, такие как ферро-фольгамма, преимуществом которого является комплексное антианемическое действие, направленное на поддержание основных витаминов и микроэлементов, участвующих в эритропоэзе, а также наличие в составе аскорбиновой кислоты, достоверно улучшающей усвоение железа. В составе данного препарата 37 мг элементарного железа Fe2+ (112,6 мг сульфата железа), 5 мг фолиевой кислоты и 10 мг цианокоболамина, что позволяет обеспечить не только профилактический, но и терапевтический эффект. Доказано, что добавление фолиевой кислоты к препаратам железа отчетливо повышает эффективность терапии: рост уровня гемоглобина у пациентов, получавших железо в сочетании с фолиевой кислотой, был более выраженным по сравнению с пациентами, которым вводили только железо. Эти результаты не зависят от наличия подтвержденного дефицита фолиевой кислоты [21]. Важно отметить, что препараты железа для приема внутрь разрешены для применения в течение всей беременности, послеродового периода и лактации. Пациенты, рефрактерные к терапии препаратами железа внутрь или имеющие серьезные побочные эффекты, могут быть кандидатами для парентеральной терапии железом. Также показано парентеральное введение препарата железа в случае анемии тяжелой степени (гемоглобин менее 80–90 г/л или выраженные клинические проявления анемического синдрома). Внутривенное введение карбоксимальтозата железа является наиболее безопасным и эффективным подходом для лечения резистентной ЖДА и скорейшего восполнения железодефицита [22]. За одну внутривенную инъекцию при необходимости возможно введение до 1000 мг железа. При беременности данный терапевтический подход возможен со второго триместра [23]. В наиболее тяжелых случаях после восполнения дефицита железа эффективно добавление к терапии эритропоэтина [24].
Несмотря на все терапевтические мероприятия, часть больных с анемией остаются рефрактерными к терапии. Современные данные о роли Helicobacter pylori, аутоиммунного гастрита, целиакии, а также наследственного заболевания (рефрактерная ЖДА, определяемая специфической мутацией гена) должны быть приняты во внимание в процессе диагностики и ведения пациентов с ЖДА [25].
Дефицит железа остается серьезной проблемой для женщин репродуктивного возраста. Всемирная задача – раннее выявление и эффективное и безопасное лечение дефицита железа. Врачи, занимающиеся оказанием первичной и акушерско-гинекологической помощи женщинам всех возрастов, должны быть осведомлены о характере проблемы и правильном подходе к скринингу, диагностике и лечению. Потенциальная польза для новорожденных, равно как и для их матерей, крайне важна для здоровья населения в целом, а своевременная коррекция анемии играет значимую роль в улучшении качества жизни пациентов в любом возрасте.
Дефицит фолатов и витамина В12. Взаимосвязь между В12, фолатами и гомоцистеином
При отсутствии дефицита железа наиболее частой причиной анемии является недостаток фолиевой кислоты, а в ряде случаев и витамина В12. Главное отличие такой анемии от ЖДА – ее макроцитарный характер (MCV>100 мкм3), чего не встречается при железодефиците. При наличии в мазке крови как микроцитов, так и макроцитов вероятен комплексный генез анемии. Дефицит В12 чаще всего связан с патологией ЖКТ, к нехватке фолатов приводят мальабсорбция, гемолиз (особенно при наследственных гемолитических анемиях), миелопролиферативные заболевания. Клеткам необходима фолиевая кислота для многих биохимических процессов [26], взаимосвязь витамина В12, фолиевой кислоты и гомоцистеина лучше всего иллюстрируется в метаболизме метионина. Гомоцистеин является центральной молекулой в этом процессе. У взрослых его уровень в норме колеблется в районе 10–11 мкмоль/л. Для метаболизма гомоцистеина необходимы витамины B6, B12 и фолиевая кислота. У пациентов, испытывающих их недостаток, уровень гомоцистеина может быть повышен (гипергомоцистеинемия), что увеличивает риск сердечно-сосудистых заболеваний и тромботических осложнений. Причины гипергомоцистеинемии могут быть наследственными и приобретенными. Гомоцистеинурия, тяжелое редкое наследственное аутосомно-рецессивное состояние, сопровождается заметно повышенным уровнем гомоцистеина крови и мочи, как правило, диагностируется в детском возрасте и связана с существенным риском тромбоэмболических осложнений [27]. Более мягкие формы гипергомоцистеинемии могут быть наследственно предрасположенными (полиморфизмы гена метилентетрагидрофолатредуктазы – МТГФР) или приобретенными (дефицит фолатов и/или В12). Они распространены у взрослых и также связаны с сосудистыми заболеваниями. Последствия излечимы: повышенное потребление фолиевой кислоты снижает уровень гомоцистеина.
Диагностика дефицита В12 и фолиевой кислоты
Установление диагноза осложняется тем, что наиболее распространенные умеренные формы недостаточности протекают без явных клинических симптомов и могут быть пропущены при использовании скрининговых тестов без прямых измерений этих витаминов. Общим для дефицита фолиевой кислоты и В12 является наличие макроцитарной анемии с гиперсегментацией гранулоцитов. Высокий показатель ширины распределения эритроцитов (RDW) является признаком того, что может существовать дефицит не одного, а нескольких необходимых для эритропоэза компонентов. Подтверждено это может быть путем исследования мазка периферической крови и выявления как макроцитов, так и микроцитов. При беременности интерпретация MCV может быть затруднена в связи с физиологическим увеличением объема эритроцитов.
Лабораторные измерения фолиевой кислоты и B12 включают прямые и косвенные. Прямое измерение сывороточного уровня фолиевой кислоты и B12, как правило, не является высоко чувствительным и специфичным [28], особенно во время беременности.
Косвенные измерения запасов фолиевой кислоты и B12 основываются на обнаружении повышенного уровня молекул-предшественников, которые накапливаются, когда фолиево- и/или В12-зависимые реакции заблокированы. Гомоцистеин ожидаемо увеличится, если B12 или фолиевой кислоты недостаточно, так как оба являются необходимыми кофакторами. Метилмалоновая кислота ММК) повысится при дефиците В12, но не зависит от содержания фолиевой кислоты. Основываясь на клинических исследованиях, гомоцистеин и MMК теперь признаны более чувствительными и специфичными показателями содержания фолата и В12, чем их прямые измерения [29].
Одним из основных клинических признаков, отличающих дефицит B12 от дефицита фолиевой кислоты, является наличие нервно-психических симптомов. Периферическая невропатия, которая проявляется парестезиями, дискоординацией и слабостью конечностей, является наиболее частой клинической особенностью. Некоторые из этих изменений обратимы с восполнением В12, улучшение может произойти в течение нескольких недель. Дефицит фолата не вызывает неврологических осложнений, поэтому макроцитоз с нервно-психическими симптомами наиболее вероятно обусловлен дефицитом B12.
Акушерские осложнения, связанные с дефицитом витамина B12 или фолиевой кислоты, или повышенным уровнем гомоцистеина
Одной из самых известных проблем, связанных с дефицитом фолиевой кислоты во время беременности, является группа заболеваний, известных как дефекты нервной трубки у плода (ДНТ). Spina bifida и анэнцефалия- наиболее распространенные из ДНТ. Механизмы образования данных пороков включают непосредственное влияние низких уровней фолата на нарушение синтеза ДНК [30] и косвенное токсичное влияние гомоцистеина на плод. Достоверная связь между дефицитом В12 и риском возникновения ДНТ не подтверждена [31].
Гипергомоцистеинемия является предрасполагающим фактором для невынашивания беременности в связи с повышением риска развития хронической фетоплацентарной недостаточности и хронической внутриутробной гипоксии плода. Исследования женщин с повышенными значениями гомоцистеина в целом показали положительную связь высокого гомоцистеина с невынашиванием беременности. Лечение препаратами фолиевой кислоты и В12 может позволить этим женщинам выносить беременность [9].
Гомоцистеин был ассоциирован с развитием преэклампсии в ряде исследований [32]. Несмотря на недостаток достоверных данных о повышении риска преэклампсии при гипергомоцистеинемии, дополнительное назначение фолата показано в профилактических целях [9].
Лечение и профилактика дефицита фолатов и В12
При подтверждении дефицита лечение может быть начато с соответствующим витамином. Однако при ожидаемом возможном дефиците фолата у беременных целесообразно профилактическое назначение фолиевой кислоты 1–5 мг в день или комбинированных препаратов в случае ожидаемой повышенной потребности в железе и В12 или подтвержденного сочетанного дефицита (ферро-фольгамма).
Поскольку большинство механизмов дефицита В12 связаны с проблемами всасывания, лечение обычно назначается ежедневно внутримышечно в виде инъекции витамина В12 в течение одной недели, после чего в течение месяца применяются еженедельные инъекции. После того, как запасы были восполнены, нередко назначается B12 внутрь (1 мг ежедневно чаще в составе комбинированных препаратов – ферро-фольгамма), что приемлемо для пациентов с постоянной мальабсорбцией.
Гипергомоцистеинемия
Какова бы не была причина гипергомоцистеинемии, лечение основано на увеличении потребления фолиевой кислоты и витамина В12. С этой целью наиболее часто применяются комбинированные препараты (поливитамины в сочетании с витамином В6 или ферро-фольгамма, в случае наличия латентного или явного железодефицита)
Фолиевая кислота, витамин В12, и гомоцистеин в настоящее время рассматривается как важные посредники в сложном взаимодействии диеты, генетики, здоровья и болезни. Для акушеров-гинекологов открытия в этой области важны с точки зрения оптимизации ведения беременности.
Результаты клинических испытаний различных превентивных и терапевтических подходов у женщин репродуктивного возраста как основного контингента, подверженного дефицитным состояниям и анемии [22], призваны помочь врачам в эффективном назначении препаратов железа, фолиевой кислоты, В12 и их комбинации в зависимости от установленной нозологии, тем самым улучшить качество жизни женщин и здоровье новорожденных.



