Артериальная гипертензия в настоящее время является одной из наиболее распространенных
форм патологии у беременных [1. 2. 3]. Поданным большинства зарубежных авторов, артериальная
гипертензия осложняет течение 10$ всех беременностей |4; 5, 6], в России официальные данные о
ее частоте еще выше — у 5—30$; беременных. На протяжении последних десятилетий отмечается
тенденция к увеличению этого показателя, что можно объяснить увеличением возраста, избыточной массой тела и ухудшением соматического здоровья беременных.
Поданным ВОЗ, в структуре материнской смертности доля гипертензивного синдрома составляет
20—30%, что согласуется с данными зарубежных авторов [1 , 4, 5. 6]. Также остаются неудовлетворительными показатели перинатальной смертности (30— 100), частота преждевременных родов составляет 10—12%. что значительно превышает соответствующие показатели при физиологически протекающей беременности.
Как известно, артериальная гипертензия увеличивает риск отслойки плаценты, может быть
причиной нарушения мозгового кровообращения, отслойки сетчатки, эклампсии, возникновения массивных коагулопатических кровотечений. Осложнениями артериальной гипертензии также
являются прогрессирующая плацентарная недостаточность и синдром задержки роста плода, а в
тяжелых случаях — асфиксия и гибель плода.
Оставляет желать лучшего и отдаленный прогноз женщин, у которых беременность протекала
с гипертензионным синдромом: такие пациентки чаше страдают ожирением, сахарным диабетом,
сердечно-сосудистыми заболеваниями. Дети этих женщин также подвержены развитию различных
метаболических и гормональных нарушений, сердечно-сосудистой патологии в последующие годы
жизни [7; 8, 9].
В настоящее время принято выделять четыре основные формы артериальной гипертензии у
беременных: хроническую, гестаиионную, преэклампсию/эклампсию и преэклампсию/эклампсию,
развившуюся на фоне хронической артериальной гипертензии.
Для всех форм гипертензивных нарушений у беременных характерно наличие эндотелиальной дисфункции, окислительного стресса и «преувеличенного» про воспалительно го ответа [4].
Однако для выбора оптимальной тактики ведения и терапии необходимо учитывать различную морфологическую основу хронической артериальной гипертензии и преэклампсии.
Как показывают исследования морфологов, аутопсийная диагностика хронической артериальной гипертензии у погибших беременных проводится по констатации достоверной гипертрофии
левого желудочка (как правило, концентрического типа), гипертрофии мышечной оболочки артериол и мелких артерий, признаков артериолосклероза. При преэклампсии морфологи находят системное поражение материнского и плодного эндотелия сосудов (эндотелиоз), клиническим эквивалентом которого являются признаки дисфункции эндотелия II].
При хронической артериальной гипертензии в матках умерших женщин имеет место выраженный
эндосклероз и сужение просвета маточно-плацентарный артерий, что является частью системного
поражения артериол и мелких артерий большого круга кровообращения. Как пишут патологоанатомы, создается впечатление, что "склероз стенок спиральных артерий явно сдерживает инвазию
иитотрофобласта, снижает объем гестаи ион но и перестройки маточ но-плацентарных артерий и приводит к редукции маточ но-плацентарного кровотока (в случае присоединения ПЭ)" |1].
При ПЭ также имеет место патология плаценты. Она чаше всего маленькая (250—300 г), с преобладанием хаотичных склерозированных и незрелых ворсин. Первопричиной считается дефицит инвазивной активности цитотрофобласта, начиная с 16–18 нед беременности, и недостаточная гестационная перестройка спиральных артерий матки с редукцией маточно-плацентарного кровотока в дальнейшем.
Как показали наши собственные исследования, повреждение эндотелия сосудов микроциркуляции при преэклампсии носит иммунокомплексный характер. В качестве антигенного компонента в составе иммунных комплексов были обнаружены нейроспецифические антигены NSE (нейроспецифическая енолаза – наиболее специфичный маркер повреждения зрелых дифференцированных нейронов) и GFAP (глиофибриллярно-кислый протеин, маркер повреждения астроцитов).
Следствием отложения иммунных комплексов на мембранах эндотелия сосудов является постепенное разрушение всех элементов нормальной структуры эндотелиоцитов. Иммунные комплексы с избытком антигена способны проникать через межэндотелиальные щели капилляров к базальной мембране, сорбировать на себе С3-фракцию комплемента и вызывать специфический хемотаксис нейтрофилов, макрофагов, лимфоидных клеток, которые выделяют в окружающие ткани различные биологически активные вещества и цитокины. В конечном итоге при преэклампсии развиваются патологические реакции, определя- емые как иммунологическое воспаление и некроз [10,11, 12].
Различная мофрологическая основа гипертензивных расстройств во время беременности послужила основной для проведения настоящего исследования, целью которого явилась сравнительная оценка уровней нейроспецифических белков NSE и GFAP в сыворотке крови здоровых беременных, беременных с преэклампсией и хронической артериальной гипертензией без преэклампсии, а также иммуноморфологическое исследование ткани плацент у женщин с преэклампсией и хронической артериальной гипертензией без преэклампсии.
Задачи исследования:
1. Определить уровни NSE и GFAP у здоровых женщин с физиологически протекающей беременностью.
2. Изучить концентрацию NSE и GFAP в сыворотке крови беременных с преэклампсией и хронической артериальной гипертензией без преэклампсии.
3. Доказать специфичность иммунного повреждения сосудов при преэклампсии на основании сравнительного иммуноморфологического исследования ткани плаценты у женщин с преэклампсией и хронической артериальной гипертензией.
Материал и методы исследования
В соответствии с целями и задачами проведено проспективное обследование 21 беременной с хронической артериальной гипертензией (средний возраст 27,9±5,8 года) и 84 беременных с преэклампсией разных степеней тяжести:
1-ю подгруппу составили 25 пациенток с легкой преэклампсией (средний возраст 27,8±5,3 года);
2-ю – 31 пациентка с преэклампсией средней степени тяжести (средний возраст 28,3±6,3 года);
3-ю – 28 пациенток с тяжелой преэклампсией (средний возраст 27,2±6,7 года). В контрольную группу вошли 25 здоровых женщин с физиологически протекающей беременностью (средний возраст 28,5±6,1 года).
Критерии включения беременных в контрольную группу: срок беременности 12 нед и более, физиологическое течение беременности, отсутствие нейроинфекций, черепно-мозговых травм, нейродегенеративных заболеваний, опухолей головного мозга.
Критерии включения пациенток в группу беременных с хронической артериальной гипертензией: повышение АД до беременности или до 20 нед (диагноз установлен терапевтом и подтвержден инструментально), а также отсутствие нейроинфекций, черепно-мозговых травм, нейродегенеративных заболеваний, опухолей головного мозга. Срок беременности пациенток с хронической артериальной гипертензией при проведении исследования варьировался от 34 до 38 нед (в среднем 35,6±0,7 нед); в группе с преэклампсией в 1-ой подгруппе – от 35 до 38 нед (в среднем 36,5±0,9 нед); во 2-ой подгруппе – от 32 до 36 нед (в среднем 34±1,3 нед); в 3-й подгруппе – от 26 до 40 нед (в среднем 31,2±3,8 нед). Иммунохимическое исследование проводилось в лаборатории нейрохимии отдела фундаментальной и прикладной нейробиологии, ФГБУ Государственный научный центр социальной и судебной психиатрии им. В.П. СербскогоМинздрава России (руководитель лаборатории - д.м.н. О.И. Гурина). Исследование включало определение концентрации NSE и GFAP в сыворотке крови пациенток методом твердофазного иммуноферментного анализа – ELISA («сэндвич»-вариант).
Забор периферической венозной крови в группе с преэклампсией и хронической артериальной гипертензией осуществляли при поступлении в стационар натощак до начала терапии, в контрольной группе – с 12 нед беременности 1 раз в месяц до родоразрешения (12–16–20–24–28–32– 36–40 нед). Венозную кровь в объеме 5 мл забирали в сухую пробирку без активатора и стабилизаторов. Образцы крови отстаивали до образования плотного сгустка и центрифугировали при 1000 g в течение 10 мин.
Иммуноморфологическое исследование ткани плацент выполнено у 30 пациенток: 10 из них с артериальной гипертензией без гестоза, 20 – с гестозом. Применяли иммунопероксидазный и иммунофлуоресцентный методы. В качестве первичных антител использовали моноклональные антитела к IgA, IgM, IgG и NSE (Novocastra, Великобритания). Полученные препараты при проведении иммунопероксидазного метода изучали в световом микроскопе, при иммунофлуоресцентном методе – в люминисцентном микроскопе. Исследование проведено на базе Московского городского центра патологоанатомических исследований при ГКБ № 33 (руководитель – главный патологоанатом ДЗ г. Москвы, д.м.н., проф., О.В. Зайратьянц).
Статистическую обработку полученных данных производили по общепринятому методу вариационной статистики, с вычислением средней арифметической величины (М), ошибки средней арифметической (m), стандартного отклонения (SD). Для определения достоверности разности средних величин использовался критерий Стьюдента (t) для выборок разного объема (n).
Результаты исследования
В контрольной группе концентрация NSE и GFAP в течение беременности достоверно не изменялась, что свидетельствует об отсутствии значительного влияния физиологических изменений при беременности на проницаемость ГЭБ, состояние нейронов и астроцитов головного мозга. Суммируя все полученные данные о концентрации исследуемых белков у беременных контрольной группы в разные сроки беременности, была полу- чена средняя величина, принятая нами за норму у здоровых беременных женщин с физиологически протекающей беременностью (табл. 1).
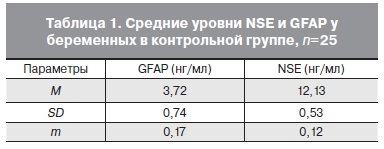
При исследовании сыворотки крови беременных с преэклампсией выявлено статистически достоверное повышение концентраций GFAP и NSE по сравнению с таковыми у здоровых беременных и беременных с хронической артериальной гипертензией (р<0,05). При этом обнаружена прямая зависимость между тяжестью преэклампсии и уровнем исследуемых белков. В то же время у беременных с хронической артериальной гипертензией уровни исследуемых белков достоверно не отличались от контрольной группы. Однако эта закономерность была обнаружена лишь у техпациенток, у которых в дальнейшем отсутствовали симптомы преэклампсии. Сравнительная оценка уровней NSE и GFAP в контрольной группе, в группе с преэклампсией и хронической артериальной гипертензией представлена в табл. 2.
Таблица 2. Концентрации GFAP и NSE в контрольной группе, у беременных с хронической артериальной гипертензией (ХАГ) и преэклампсией (ПЭ), М±m (нг/мл).
Обнаруженные морфологические изменения в ткани плаценты у пациенток с преэклампсией и хронической артериальной гипертензией во многом сходны: массивное отложение фибриноида в межворсинчатом пространстве, патологическая незрелость ворсин, расстройство микроциркуляции, склероз, облитерация, сужение просвета, атероматоз артерий. Однако сравнительное иммуноморфологическое исследование ткани плаценты показало отложение NSE только при преэклампсии: в ворсинах плаценты, в массах фибриноида, а также по ходу маточно-плацентарных артерий (как миометрального, так и эндометриального сегментов) (рис. 1, 2, см. на вклейке).
В тех наблюдениях, где беременность протекала на фоне хронической артериальной гипертензии без клинических симптомов преэклампсии, NSE не выявлялась в ткани плаценты.
Обсуждение
За всю историю изучения преэклампсии терапия этого осложнения беременности также претерпела значительные изменения – от флеботомии и палат Строганова до применения сульфата магния, современных инфузионных сред и антигипертензивных препаратов.
При современном уровне развития акушерства и фармакологии проводимая нами терапия гипертензивных нарушений у беременных носит симптоматический характер, ее цель – только пре- дупреждение тяжелых осложнений, обусловленных высоким уровнем артериального давления, попытка сохранить физиологическое развитие беременности, а также снизить возможный риск сердечно-сосудистых заболеваний в отдаленном периоде.
На фоне современных методов терапии, по данным патоморфологов, в 3 раза реже встречаются ранее патогномоничные для эклампсии внутримозговые кровоизлияния, в 2 раза реже – петехиальные кортикальные кровоизлияния и в 3 раза чаще – субарахноидальные кровоизлияния и мелкие ишемические инфаркты головного мозга. Современная морфологическая картина изменений почек характеризуется наличием более тяжелых форм поражения по сравнению с данными 70-х гг. прошлого века. В 3 раза чаще стали встречаться кортикальные некрозы, в 5 раз чаще – выраженная дистрофия и очаговый некроз эпи- телиоцитов прямых и извитых канальцев. Столь явный патоморфоз почек при эклампсии объясняется не только удлинением срока жизни родильниц, но и возросшим объемом инфузионной терапии, неадекватной по составу и степени агрессии, без должного контроля осмотического градиента. Частота и тяжесть поражений почек может быть связана и с более частым развитием ДВС-синдрома. Типичная «экламптическая печень» в настоящее время встречается в 3 раза реже, чем в 70-е г. Изменение профиля патоморфологических находок в печени обусловлены, вероятно, более успешной терапией сочетанных форм преэклампсии, для которых характерно присоединение ДВС-синдрома.
В современных условиях в 4–6 раз чаще обнаруживаются кровоизлияния в корковом слое надпочечников, в 5 раз чаще диагностируются инфаркты, в 2 раза чаще – выраженные дистрофические изменения клеток пучковой зоны. Это можно объяснить более длительным периодом реанимации женщин, тяжелым ДВС-синдромом, а также отсутствием должного внимания к этому органу [1].
Представленные данные свидетельствуют о выраженном патоморфозе преэклампсии и эклампсии в условиях современной комплексной терапии и реанимации. Мы хорошо справляемся с коррекцией отека головного мозга (явное снижение частоты внутримозговых кровотечений и набухания мозга на аутопсиях). Вместе с тем огромный и подчас мало контролируемый объем, ошибки инфузионной терапии приводят к неадекватному перераспределению интерстициальной жидкости, увеличению нагрузки на клубочковый и канальцевый аппарат почек. Агрессивный бесконтрольный характер инфузионной терапии резко меняет систему гемостаза, что отражается на состоянии органов-мишеней. Идет явная недооценка возросшего уровня надпочечниковой недостаточности [1].
Согласно результатам проведенного нами исследования при хронической артериальной гипертензии у беременных в сыворотке крови и ткани плаценты не были обнаружены нейроспецифические белки, обладающие высокой иммуногенной активностью и способные привести к развитию иммунопатологического процесса [13]. Это свидетельствует о том, что эндотелиальная дисфункция при ХАГ не связана с тяжелым иммунным повреждением эндотелия сосудов макро- и микроциркуляции. Пролонгирование беременности на фоне адекватной антигипертензивной терапии и эффективно контролируемого артериального давления при отсутствии признаков страдания плода возможно.
Иная ситуация наблюдается при развитии преэклампсии. До тех пор, пока прогрессирует беременность и жив плод, происходит постоянное поступление нейроантигенов в кровь матери, следовательно, иммунное повреждение эндотелия носит только прогрессирующий характер. Остановить данный процесс может только родоразрешение, которое показано при эклампсии, тяжелой форме преэклампсии и неэффективности терапии умеренной ее формы.
Еще одной отличительной особенностью патогенеза преэклампсии является тяжелая коагулопатия, которая отличается крайней нестабильностью и зависит от тяжести иммунного повреждения эндотелия сосудов микроциркуляции. Недостаточная коррекция гемостазиологических нарушений приводит к описанным выше поражениям почек, надпочечников, печени, головного мозга, легких, плаценты.
Отсутствие эффекта от проводимой терапии преэклампсии также можно объяснить глубокими морфологическими изменениями эндотелия кровеносных сосудов: набуханием эндотелиоцитов, активацией пролиферации, разрыхлением и слущиванием большого количества клеток. При этом в кровотоке обнаруживаются циркулирующие эндотелиальные клетки, потерявшие связь с базальной мембраной. Остальные эндотелиоциты, по сути, находятся в состоянии предапоптоза [14]. Такой эндотелий, естественно, не может адекватно реагировать на вводимые препараты, и реакция пациентки иногда оказывается непредсказуема.
Таким образом, проведенное исследование позволяет сделать ряд выводов:
• эндотелиальная дисфункция при преэклампсии и ХАГ имеет совершенно различную морфологическую и патогенетическую основу;
• для преэклампсии характерны более тяжелые повреждения эндотелия сосудов в виде набухания, пролиферации, разрыхления, а также отрыв эндотелиоцитов от базальной мембраны. Возможная причина описанных изменений – попадание в кровоток беременной нейроспецифических антигенов (NSE, GFAP), образование иммунных комплексов, активация компонентов комплемента и иммунное повреждение сосудистого эндотелия всех органов-мишеней;
• медикаментозная коррекция эндотелиальной дисфункции при ХАГ возможна, при преэклампсии – малоэффективна.