Миома матки (ММ) продолжает привлекать внимание многих исследователей, поскольку, занимая второе место в структуре гинекологических заболеваний (20–40%), она остается одной из многочисленных причин нарушений репродуктивного здоровья у 35–70% женщин [1–5]. Как известно, основными клиническими проявлениями ММ являются нарушения менструального цикла по типу гиперполименореи, мено- и метроррагии, невынашивание беременности, бесплодие [1, 6, 7]. По мнению большинства исследователей, возникновение маточных кровотечений при ММ связано с нарушениями регуляции в системе «гипоталамус-гипофиз-яичники» [3, 8, 9]. В то же время дискуссионным остается вопрос: является ли ММ истинно гормонально зависимым заболеванием или имеет воспалительный генез [10, 11]. Исследования последних лет доказали немаловажное значение дисбиотических нарушений, сексуально-трансмиссивных инфекций и дисфункции иммунной системы в патогенезе ММ [10–14].
Среди многочисленных вариантов лечения ММ у женщин фертильного возраста предпочтение отдается органосохраняющим методам, включающим консервативную миомэктомию с помощью гистероскопии, лапароскопии и лапаротомии, эмболизацию маточных артерий, дистанционное разрушение опухоли фокусированным ультразвуком под контролем МРТ [15–21]. Но даже использование малоинвазивных органосберегающих хирургических методик не гарантирует 100% эффективности лечения. Литературные источники утверждают, что вероятность рецидива заболевания после консервативной миомэктомии в течение 5 лет составляет 45–55% [19, 20]. А удельный вес выполняемых гистерэктомий при ММ в структуре оперативных вмешательств достигает 60,9–95,3% [22]. В связи с этим приоритет при лечении ММ остается за гормональной терапией, используемой как в качестве нео- и адьювантной, так и самостоятельного варианта лечения [1–5, 8, 22, 23]. Однако, несмотря на огромный выбор гормональных препаратов, нередко на фоне их применения у пациенток с ММ отмечаются побочные эффекты и осложнения (метроррагии, увеличение размеров миоматозных узлов), что диктует необходимость дальнейшего изучения патогенетических особенностей течения заболевания для оптимизации существующих методов консервативной терапии.
Цель исследования: изучить особенности маточной гемодинамики и системы гемостаза при миоме матки, осложненной геморрагическим синдромом.
Материал и методы исследования
Под нашим наблюдением находилось 76 женщин с ММ, размеры которой не превышали 12-недельную беременность, преимущественно с интрамуральной и субсерозной локализацией узлов и имеющие показания для консервативного лечения. С целью гормонотерапии ММ пациентки обеих групп получали бусерелин-депо (3,75 мг каждые 4 недели). Основную группу составили 43 пациентки с ММ и клиникой геморрагического синдрома на фоне гормонотерапии. В группе сравнения (n=33) осложнений при консервативном лечении ММ гормональными препаратами не наблюдалось. Контрольная группа была представлена практически здоровыми женщинами (n=27).
Всем пациенткам проводилось стандартное клинико-лабораторное обследование и комплексное ультразвуковое сканирование с допплерометрией абдоминальным и вагинальным датчиком, на аппарате HITACHI-5500 с применением широкополосных, сверхвысокоплотных конвексных датчиков 3,5–5,0 МГц и полостных датчиков 5,0–7,5 МГц.
Исследование системы гемостаза проводили пробирочным методом, а также с помощью планшетных наборов для экспресс-диагностики. Анализ тромбоцитарного звена системы гемостаза основывался на оценке количества и агрегационной способности тромбоцитов. Данные показатели определялись при помощи 2-канального лазерного анализатора агрегации тромбоцитов «Biola»-LA 230 (Россия), соединенного через интерфейс с IBM-совместимым компьютером. Для индукции агрегации использовали АДФ фирмы «Технология-Стандарт» в концентрации 2,5 ммоль/л. Для исследования коагуляционного гемостаза использовали следующие методы: протромбиновый индекс (ПТИ), активированное парциальное тромбопластиновое время (АПТВ) в модификации З.С. Баркагана (1980). АПТВ определяли с помощью наборов, поставляемых МНПЦ «Технология» (г. Барнаул) на турбидиметрическом гемокоагулометре C GL 2110 (Беларусь); содержание в плазме фибриногена определяли кинетическим методом (Clauss A., 1957). Количественным экспресс-методом определяли уровень маркеров тромбообразования – D-димера с использованием портативного прибора Cardiac Reader. Состояние системы фибринолиза оценивали путем изучения показателей фибринолитической активности клеток крови по времени лизиса сгустков эуглобулиновой фракции (Еремин Г.Ф., Архипов А.Г., 1979).
Дополнительно проведено обследование на выявление антител IgG и IgM к возбудителям урогенитальных инфекций (хламидиоз, уреаплазмоз, трихомониаз, цитомегаловиусная и герпетическая инфекции) с помощью иммуноферментного анализа на тест-системах производства ЗАО «Вектор Бест» (г. Новосибирск).
Статистическая обработка результатов исследования проведена с использованием пакета прикладных программ Statgraphics (Statistical Graphics System), разработанного фирмой STSC Inc., c выведением М±m, процентов, логарифмических средних (x) с 95% доверительным интервалом и достоверностью различий (Р) по критерию Стьюдента–Фишера.
Результаты исследования и их обсуждение
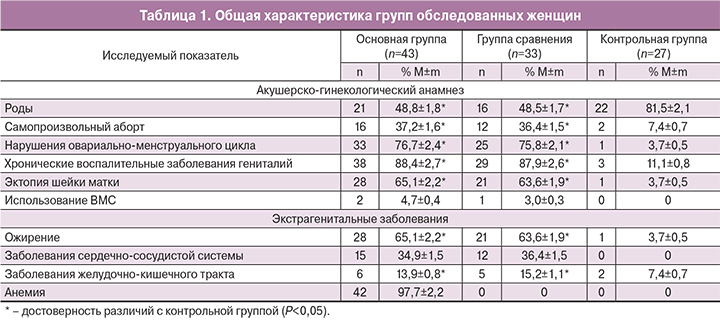
Возраст обследованных женщин варьировал от 21 до 42 лет и в среднем составил в основной группе – 30,5±4,3 года, в группе сравнения – 31,2±5,4 года, в контрольной группе – 30,2±5,5 года, что не имело значимых межгрупповых различий. Пациентки основной группы и группы сравнения были сопоставимы по наличию генитальных и соматических заболеваний (табл. 1).

Обращает на себя внимание высокая частота хронических воспалительных процессов половых органов у больных с ММ, что, по мнению многих исследователей, является одним из факторов риска возникновения опухоли [11, 24, 25].
Результаты проведенного ультразвукового исследования (УЗИ) показали, что размеры матки в группах обследуемых женщин колебались от 6–7 до 12 недель беременности. По данным УЗИ средний объем матки в основной группе составил 394,2±178,6 см³, в группе сравнения – 396,7±172,3 см³ (Р>0,05). Локализация миоматозных узлов в обеих группах преимущественно интерстициальная, реже – субсерозная. Количество узлов варьировало от 3 до 6, размеры – от 2,5 до 5 см.
При изучении маточной гемодинамики уделялось внимание определению только уголнезависимых параметров: максимальной скорости кровотока (V max) и минимальной скорости кровотока (V min), а также индекса резистентности (ИР) в каждой маточной артерии. Параметры маточной гемодинамики представляли средней величиной между правой и левой маточными артериями (табл. 2).
 Анализ качественных показателей маточной гемодинамики показал, что у пациенток с ММ без осложнений гормонотерапии скорость систолического кровотока в маточных артериях (Vmax) достоверно увеличивалась по отношению к контрольным данным, на фоне снижения диастолического кровотока (Vmin) и повышения ИР сосудистой стенки. Более выраженные изменения параметров допплерометрии мы констатировали в основной группе (табл. 2). При сочетании ММ с геморрагическим синдромом выявлено повышение V max в 1,8 раза, ИР – в 1,6 раза, а V min снижалась в 2,5 раза в сравнении с параметрами у здоровых женщин (Р<0,05), при этом были получены значимые различия с группой сравнения. Кроме того, дополнительное использование в работе допплерографии дало возможность определить характер васкуляризации миоматозных узлов. У больных с ММ, осложненной геморрагическим синдромом на фоне гормонотерапии, превалировал гиперваскулярный тип опухоли (90,7%; n=39), в то время, как в группе сравнения характерные признаки были отмечены лишь в 30,3% наблюдений (n=10). Аналогичные данные были представлены в публикации И.Е. Рогожиной и соавт. (2013), где установлены выраженные изменения маточной гемодинамики и преобладание гиперваскулярного типа опухолей у больных с ММ, которым предстояло хирургическое лечение, в связи с маточным кровотечением [15]. В то же время И.А Озерская и соавт. (2014) выявили у женщин старше 35 лет, страдающих ММ, повышение максимальной и конечно-диастолической скоростей и снижение ИР маточных артерий [26]. Однако результаты морфологических исследований миометрия и миоматозных узлов, опубликованные Д.В. Джакуповым и соавт. (2014), подтвердили роль гипертензии в крупных артериях матки в патогенезе кровотечений при миоме [6], что, по нашему мнению, является следствием повышенного ИР сосудистой стенки.
Анализ качественных показателей маточной гемодинамики показал, что у пациенток с ММ без осложнений гормонотерапии скорость систолического кровотока в маточных артериях (Vmax) достоверно увеличивалась по отношению к контрольным данным, на фоне снижения диастолического кровотока (Vmin) и повышения ИР сосудистой стенки. Более выраженные изменения параметров допплерометрии мы констатировали в основной группе (табл. 2). При сочетании ММ с геморрагическим синдромом выявлено повышение V max в 1,8 раза, ИР – в 1,6 раза, а V min снижалась в 2,5 раза в сравнении с параметрами у здоровых женщин (Р<0,05), при этом были получены значимые различия с группой сравнения. Кроме того, дополнительное использование в работе допплерографии дало возможность определить характер васкуляризации миоматозных узлов. У больных с ММ, осложненной геморрагическим синдромом на фоне гормонотерапии, превалировал гиперваскулярный тип опухоли (90,7%; n=39), в то время, как в группе сравнения характерные признаки были отмечены лишь в 30,3% наблюдений (n=10). Аналогичные данные были представлены в публикации И.Е. Рогожиной и соавт. (2013), где установлены выраженные изменения маточной гемодинамики и преобладание гиперваскулярного типа опухолей у больных с ММ, которым предстояло хирургическое лечение, в связи с маточным кровотечением [15]. В то же время И.А Озерская и соавт. (2014) выявили у женщин старше 35 лет, страдающих ММ, повышение максимальной и конечно-диастолической скоростей и снижение ИР маточных артерий [26]. Однако результаты морфологических исследований миометрия и миоматозных узлов, опубликованные Д.В. Джакуповым и соавт. (2014), подтвердили роль гипертензии в крупных артериях матки в патогенезе кровотечений при миоме [6], что, по нашему мнению, является следствием повышенного ИР сосудистой стенки.
Определение основных параметров гемостазиограммы показало наличие выраженных нарушений в системе гемостаза при ММ, осложненной геморрагическим синдромом на фоне гормонотерапии (табл. 3).
При исследовании показателей прокоагулянтного звена обнаружено незначительное возрастание концентрации фибриногена у больных ММ, что не имело значимых различий с контрольной группой. В то же время по коагуляционным тестам, характеризующим суммарную активность факторов внутреннего прокоагулянтного звена системы гемостаза, таких как АПТВ, мы выявили достоверное его укорочение при ММ в сочетании с геморрагическим синдромом, в то время как у пациенток без осложнений гормонотерапии достоверной разницы значений с нормативными данными не отмечено. Сравнение показателей ПТИ в группах обследуемых женщин не показало существенных изменений, при этом у больных ММ прослежено некоторое возрастание индекса. При изучении тромбоцитарного звена системы гемостаза (табл. 3) констатировано достоверное снижение количества тромбоцитов, с уменьшением их агрегационной способности (в 2 раза) только в основной группе. В группе сравнения значимых нарушений тромбоцитарного звена гемостаза не выявлено. Во всех случаях у больных ММ установлено достоверное угнетение фибринолиза в сравнении с показателем контрольной группы. При этом более выраженное удлинение времени фибринолиза (в 2 раза) наблюдалось у пациенток основной группы, что имело значимые различия с данными группы сравнения. Кроме того, у всех больных с ММ зафиксировано увеличение концентрации в сыворотке крови РКМФ: в основной группе – в 3,5 раза, в группе сравнения – в 1,5 раза, превышающие нормативные значения. При изучении одного из специфических маркеров хронического синдрома диссеминированного внутрисосудистого свертывания – D-димера, нами не было обнаружено достоверных различий его усредненных значений в группах обследуемых женщин (Р>0,05). Низкие концентрации D-димера, не превышающие нормативные показатели, по нашему мнению, связаны со снижением фибринолитической активности у пациенток с ММ, что согласуется с ранее проведенными исследованиями [16, 17]. Литературные источники также утверждают, что нарушения в системе гемостаза у больных ММ, особенно выраженные при менометроррагиях, нередко являются причиной тромбофлебитов и тромбоэмболий в послеоперационном периоде [27–29].
Учитывая значительную разницу результатов проведенных исследований в группах обследуемых женщин, а также высокую частоту хронических воспалительных заболеваний гениталий у пациенток с ММ, мы включили дополнительно в план обследования исследование антител IgG и IgM к возбудителям урогенитальных инфекций. По мнению А.Д. Макацария (2010), возникновение любого патологического процесса способствует нарушениям гемостатического потенциала крови, осложняя течение основного заболевания, а развитие системного воспаления является отправной точкой патогенеза тромбофилий, прогрессирование которых вызывает поражение эндотелия сосудов с нарушением его тромборезистентных свойств, играющих ключевую роль в регуляции гемостаза [30].
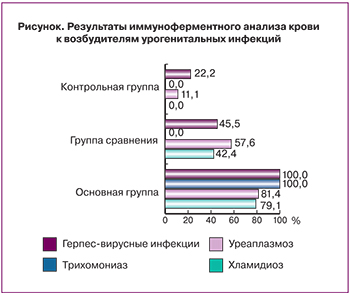
В группе сравнения хламидиоз был диагностирован у 14 женщин (42,4%), уреаплазмоз – у 19 (57,6%), герпес-вирусные инфекции – у 15 (45,5%). При этом у женщин с хорошей переносимостью гормонотерапии выявлялись только IgG к возбудителям урогенитальных инфекций. В основной группе антитела IgG и IgM к хламидийной инфекции обнаружены у 34 обследованных (79,1%); уреаплазменной – у 35 (81,4%), а хронический трихомониаз, герпетическая и цитомегаловирусная инфекции диагностированы во всех случаях (рисунок).
Необходимо также отметить, что выявление IgM к возбудителям урогенитальных инфекций у больных основной группы свидетельствовало об активизации хронического воспалительного процесса гениталий, проявлением которого, по нашему мнению, и являлся геморрагический синдром в виде маточного кровотечения различной степени выраженности. Кроме того, можно предположить, что назначение гормональных препаратов для консервативного лечения ММ на фоне хронического эндометрита специфической этиологии оказывает иммунодепрессивное воздействие на организм женщины, способствуя появлению системной воспалительной реакции организма, увеличивая тем самым частоту побочных эффектов и осложнений.
Заключение
При ММ, осложненной геморрагическим синдромом на фоне гормонотерапии, установлено превалирование гиперваскулярного типа опухоли (90,7%). Анализ параметров маточной гемодинамики показал достоверное увеличение максимальной скорости кровотока (в 1,8 раза), индекса периферического сопротивления (в 1,6 раза) и снижение диастолического кровотока (в 2,5 раза) при данной патологии в сравнении с контрольными показателями. Возникновение геморрагического синдрома на фоне гормонотерапии ММ сопровождается нарушениями гемостатического потенциала крови, с явлениями гиперкоагуляции, снижением тромбоцитов и их агрегационной способности, угнетением фибринолиза, а также повышением продуктов паракоагуляции. Результаты нашего исследования позволяют предположить, что выявленные нарушения гемостаза, сопровождающиеся изменениями маточной гемодинамики, обусловлены обострением хронических воспалительных процессов гениталий на фоне назначения гормональных препаратов, которые проявляются, в первую очередь, нарушениями менструального цикла и маточными кровотечениями. Полученные данные диктуют необходимость более детального обследования (в плане носительства урогенитальных инфекций) женщин с ММ перед назначением гормональных препаратов, для предотвращения побочных эффектов и осложнений консервативной терапии.



