Климактерий – физиологический период жизни женщины, на протяжении которого происходят изменения в репродуктивной системе, ведущие к утрате фертильности на фоне снижения секреции яичниковых гормонов и сопровождающиеся множественными ответными реакциями со стороны организма, что усугубляется общим старением и часто приводит к развитию патологических симптомов [1, 2]. Классическим проявлением патологического климактерия считаются приливы жара и ночная потливость, возникащие примерно у 80% женщин [3], которые дополняются психосоматическими симптомами, в совокупности с вазомоторными жалобами значительно ухудшающими качество жизни [2]. Причина появления менопаузальных симптомов состоит не только в снижении выработки овариальных стероидов, но и в старении центральной нервной системы (ЦНС) [4].
Изменение чувствительности ЦНС к периферическим импульсам, расстройства метаболизма нейрогормонов создают фон для развития климактерического синдрома и вместе с тем обусловливают психические и когнитивные нарушения [5]. Кроме того, взаимное влияние гормональных и обменных расстройств в стареющем организме становится основой формирования менопаузального метаболического синдрома [6], который способствует развитию атеросклероза, острых тромботических событий, сахарного диабета [7]. Все эти компоненты старения, неразрывно связанные с репродуктивным старением и ведущие к ухудшению качества жизни и повышению смертности, требуют своевременной коррекции.
Золотым стандартом лечения климактерических расстройств считается менопаузальная гормональная терапия (МГТ) [8, 9], но к ее назначению существует ряд ограничений и противопоказаний [8, 10]; нельзя также пренебрегать нежеланием пациенток применять гормональные препараты. Эти обстоятельства побуждают к поиску альтернативных способов коррекции менопаузальных расстройств.
Психотропные лекарства, фитоэстрогены, мультивитаминные комплексы – разнообразные негормональные средства используются для улучшения качества жизни женщин в период менопаузы [11–13].
Среди них представляет интерес биологически активная добавка к пище (БАД) амберен, главным эффектом которого признается регуляция функции митохондрий – ключевого звена клеточного метаболизма [14]. Потенциальная польза БАД амберен при климактерическом синдроме состоит в восстановлении взаимоотношений между центральным и периферическими звеньями эндокринной системы в результате субстратного и регуляторного воздействия аниона сукцината, который определяет, с одной стороны, энергообеспечение, а с другой – «катехоламиновое» влияние на гипоталамус, восстанавливающее его чувствительность к сигналам обратной связи [14]. Помимо этого, амберен содержит токоферола ацетат, соли цинка, кальция и магния, L-глицин, моно-L-глутаминат натрия, которые обладают многообразными регулирующими эффектами.
Положительное действие БАД амберен доказано в экспериментах на животных, но в условиях клиники до настоящего времени было выполнено лишь одно исследование, подтвердившее эффективность средства в коррекции менопаузальных симптомов [15]. Данное рандомизированное двойное-слепое плацебо-контролируемое исследование ставило целью оценить эффективность и безопасность применения БАД амберен в купировании вазомоторных и психосоматических нарушений у женщин в периодах менопаузального перехода и постменопаузы.
Материал и методы исследования
Исследование проводилось в соответствии с принципами, изложенными в Хельсинкской Декларации Всемирной медицинской ассоциации «Рекомендации для врачей, занимающихся биомедицинскими исследованиями с участием людей», и Национальным стандартом РФ «Надлежащая клиническая практика».
В исследование включались женщины в возрасте 42–60 лет с вазомоторными и психосоматическими жалобами в поздней фазе менопаузального перехода и в постменопаузе согласно классификации STRAW+10 [16]. В исследование не включались пациентки, имеющие на момент скрининга: онкологические заболевания, в том числе в анамнезе; заболевания, требующие госпитализации в ближайшие 6 месяцев; заболевания эндокринных органов с нарушением секреции гормонов; хирургические вмешательства на протяжении года или менее до момента скрининга; МГТ менее чем за 6 месяцев до скрининга; психические заболевания; сахарный диабет; прием других БАД или лекарственных средств, способных повлиять на течение климактерического синдрома.
В соответствии с перечисленными критериями в исследование были включены 104 пациентки. Рандомизация проводилась с помощью выборки из случайной последовательности чисел, равномерно распределенных в интервале 0÷999, начальное число для рандомизации было сгенерировано генератором тактовых импульсов компьютера.
У всех пациенток собирались демографические данные, данные о состоянии здоровья, история общих и гинекологических заболеваний. При обследовании определялись антропометрические показатели (рост, масса тела, окружность талии, индекс массы тела (ИМТ) по формуле Кетле), измерялись основные показатели жизнедеятельности, проводилось общеклиническое и гинекологическое обследование. Стандартное лабораторное обследование включало клинический анализ крови, биохимический анализ крови, общий анализ мочи. Применялись инструментальные методы исследования: маммография, ультразвуковое исследование (УЗИ) органов малого таза (в пременопаузе УЗИ проводилось на 5-й день менструального кровотечения).
Для оценки исходного статуса и влияния БАД амберен на вазомоторные и психосоматические симптомы проводилось тестирование с использованием климактерической шкалы Грина и теста Спилбергера–Ханина, в рамках которого оценивали ситуативную тревожность (СТ), личностную тревожность (ЛТ) и интегральный показатель актуальной тревожности (АТ). Исходно и в процессе исследования в плазме крови определялись уровни фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), эстрадиола (набор RIA производства IMMUNOTECH A.S., Чехия), лептина (набор RIA 1624 производства DRG instruments GmbH, Германия).
После проведения предварительного обследования и рандомизации пациентки получали курс лечения: 2 капсулы (одна белая капсула массой 200 мг и одна оранжевая капсула массой 200 мг) один раз в день (утром) с едой, в течение 90 дней. Капсулы плацебо содержали кукурузный крахмал высокой очистки и внешне были идентичны капсулам амберена. Пациентки получали амберен/плацебо на 30-дневный курс на каждом визите. Оценка изменений перечисленных показателей от исходного уровня проводилась ежемесячно.
Результаты исследования обрабатывались с использованием пакета прикладных программ для персональных компьютеров MSOffice 2010 и статистической программы Statistica 12. Сравнение средних значений каждого параметра в группах проводилось с применением U-критерия Манна–Уитни (непараметрическая статистика) или t-критерия Стьюдента (при нормальном распределении). В динамической оценке также применялся критерий Фридмана. Расчет данных теста Грина между группами исследования и контроля осуществлялся методом χ2. Статистически значимыми считались отличия при р<0,05 (95% уровень значимости).
Результаты исследования
Из 104 рандомизированных участниц закончили исследование 102 (52 в группе амберен и 50 в группе плацебо). Две пациентки группы плацебо выбыли из исследования по медицинским причинам, не связанным с вмешательством. Средний возраст пациенток в группах амберен (51,54±4,21 года) и плацебо (51,16±4,21 года) достоверно не различался. Из 102 пациенток 44 (43,1%) находились в перименопаузе, 58 (56,9%) – в постменопаузе.
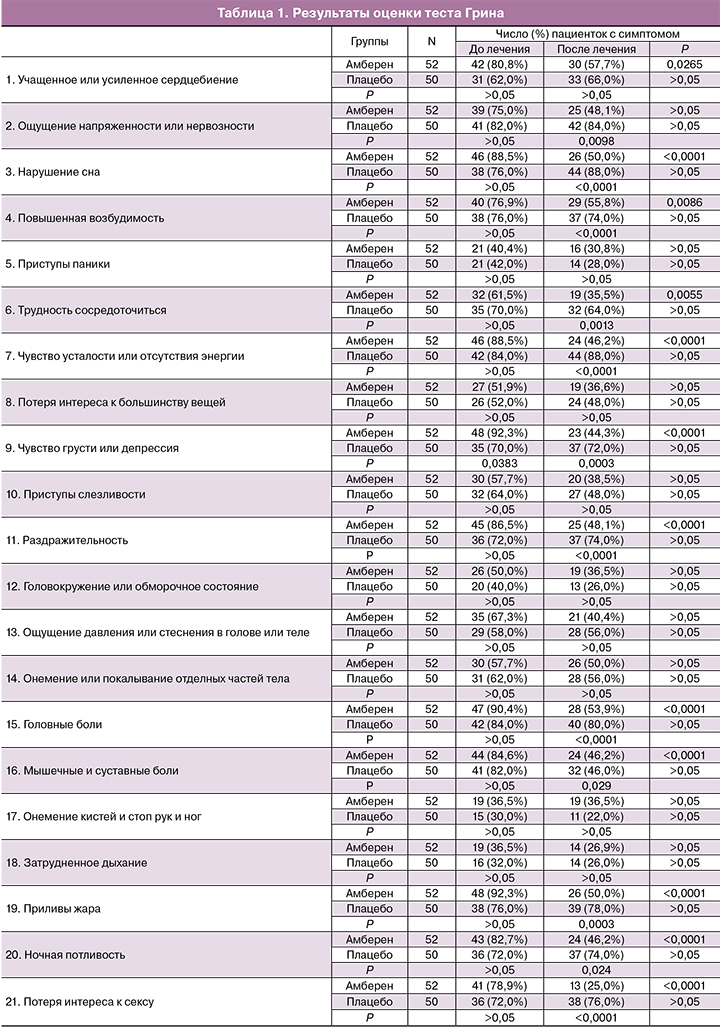
Анализ медицинской документации и клиническое обследование выявили гинекологические или экстрагенитальные заболевания у 38 (73,1%) пациенток группы амберен и 40 (80%) группы плацебо, все заболевания находились в стадии ремиссии. Антропометрические параметры, показатели клинических анализов крови и мочи, биохимического анализа крови, уровни аполипопротеинов А1 и В, лептина, эстрадиола и гонадотропинов в группах существенно не различались. Результаты исходных тестов Грина (табл. 1) и Спилберга–Ханина (табл. 2) в группах амберен и плацебо были сопоставимы. Исключением был симптом «чувство грусти, депрессия», который достоверно чаще встречался в группе исследования (р=0,0383).
Анализ результатов тестирования по климактерической шкале Грина показал сокращение числа жалоб при уменьшении их выраженности в группе амберен по следующим категориям (табл. 1): «учащенное или усиленное сердцебиение», «нарушения сна», «повышенная возбудимость», «трудность сосредоточиться», «чувство усталости или отсутствия энергии», «раздражительность», «головные боли», «мышечные и суставные боли», «приливы жара», «ночная потливость», «потеря интереса к сексу». В группе плацебо значимой динамики не наблюдалось. При сравнительном анализе достоверные различия между группой амберен и группой плацебо были получены по симптомам «ощущение напряженности и нервозности», «нарушения сна», «повышенная возбудимость», «трудность сосредоточиться», «чувство усталости или отсутствия энергии», «раздражительность». Депресся, которая исходно чаще наблюдалась в группе амберен уже через 2 месяца терапии достоверно чаще встречалась в группе плацебо. Значимые отличия между группами в конце исследования были обнаружены по симптомам «головные боли», «боли в мышцах и суставах», «приливы жара», «ночная потливость» и «потеря интереса к сексу».
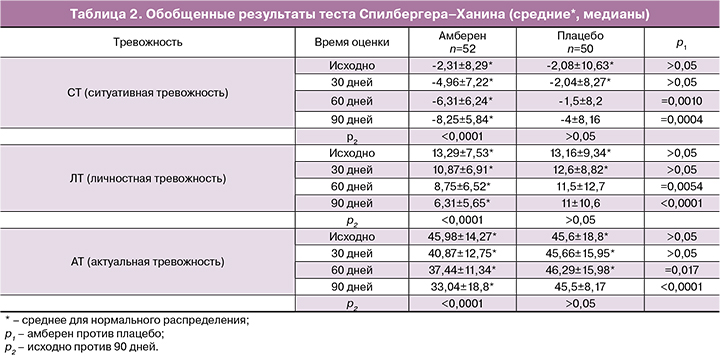
Результаты теста Спилбергера–Ханина (табл. 2) демонстрируют, что показатели СТ, ЛТ и АТ в группе амберен достоверно снизились через 2 месяца терапии. В группе плацебо показатели СТ и ЛТ несущественно снизились к концу исследования, АТ остался неизменным. Межгрупповые отличия по СТ, ЛТ и АТ стали значимыми через 2 месяца терапии.
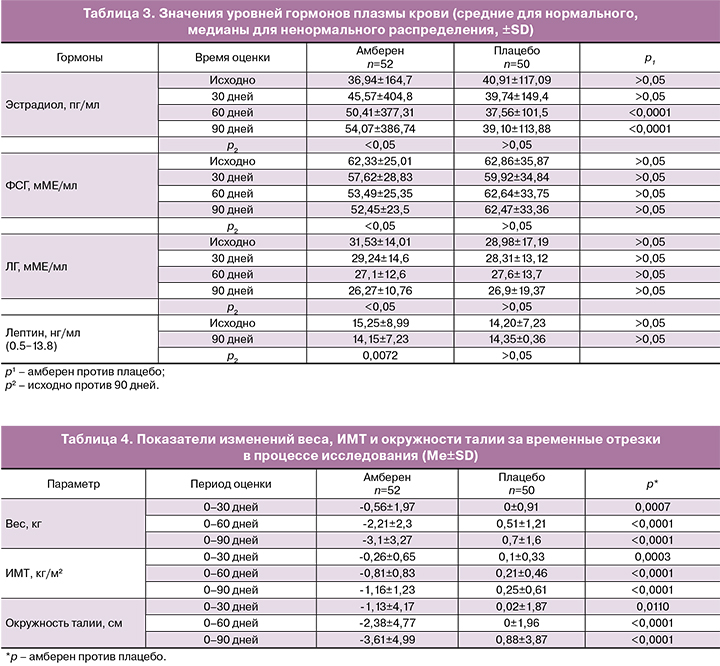
Анализ уровней гормонов в плазме крови выявил рост концентрации эстрадиола у пациенток группы амберен, достоверный по сравнению с исходным значением и значением в группе плацебо (табл. 3). Уровни ФСГ и ЛГ в группе амберен снижались к концу исследования, но достоверной разницы их значений по сравнению с группой плацебо установлено не было. Содержание лептина в группе амберен характеризовалось достоверной редукцией и приближением к нормативным значениям, в то время как в группе контроля наблюдалась тенденция к росту уровня гормона.
В группе амберен наблюдалось небольшое, но достоверное (р<0,05) снижение величин массы тела с 78,0±12,1 до 74,9±10,9 кг, ИМТ с 28,7±4,7 до 27,6±4,1 кг/м2, окружности талии с 90,8±11,98 до 87,2±9,8 см. В группе плацебо наблюдался небольшой рост данных параметров (р<0,05): массы тела с 78±14,2 до 78,5±13,9 кг, ИМТ с 28,7±4,7 до 28,6±5,8 кг/м2, окружности талии с 88,85±13,7 до 89,7±13,6 см. Достоверных межгрупповых отличий по абсолютным величинам не было выявлено, но при оценке средних изменений веса, ИМТ и окружности талии за 1, 2, и 3-месячные периоды времени различия между группами стали очевидными (табл. 4).
Оценка клинических и лабораторных параметров безопасности применения БАД амберен позволяет говорить об отсутствии их достоверных изменений по сравнению с плацебо. Нежелательных явлений в группе амберен зафиксировано не было. В группе плацебо зарегистрировано 2 нежелательных явления (гипертонический криз, киста яичника), связь которых с применяемым лечением маловероятна.
Обсуждение результатов исследования
Как показали результаты исследования, прием БАД амберен оказывает положительное действие на менопаузальные симптомы. На основании анализа теста Грина можно говорить об улучшении состояния пациенток по показателям «нарушение сна», «трудность сосредоточения», «чувство усталости или отсутствия энергии», «чувство грусти или депрессии», «раздражительность», «головные боли», «боли в мышцах и суставах», «приливы», «ночная потливость» и «отсутствие интереса к сексу».
Механизм действия БАД амберен при климактерическом синдроме до конца не ясен. Обсуждая его, следует вспомнить, что одной из главных причин вазомоторных жалоб является снижение содержания эстрогенов [17], очевидно, приводящее к дисфункции нейрональных систем головного мозга, которые испытывают своеобразную депривацию в результате изменения привычного гормонального гомеостаза [18].
Применение БАД амберен изменяет гормональный состав крови, достоверно увеличивая уровень эстрадиола, чем отчасти можно объяснить положительное влияние средства на менопаузальные симптомы. Эффект эстрадиола на разные ткани прямо зависит от его содержания в крови. Для инициации роста эндометрия необходимы более высокие концентрации эстрадиола по сравнению с теми, которые требуются для профилактики вазомоторных симптомов [19, 20]. Уровень эстрадиола менее 80 пг/мл позволяет осуществить терапевтические эффекты, оставаясь безопасным с позиций избыточной пролиферации, и среднее содержание гормона 54 пг/мл, достигнутое на протяжении нашего 3-месячного исследования, можно считать физиологически комфортным и безопасным.В формировании менопаузальных симптомов существенную роль играет старение ЦНС и снижение чувствительности гипоталамуса к действию периферических гормонов [21]. Но одновременно половые стероиды влияют на психические функции нервной системы: поведение, настроение, обучение, память и вербальные способности человека [22].
Прием БАД амберен позволил стабилизировать психический статус пациенток по результаты тестов Грина и Спилбергера–Ханина. Частота депрессивных нарушений достоверно снизилась у женщин, получавших амберен, по сравнению с исходным значением и показателем в группе плацебо. Значимая редукция тревожности по компонентам СТ, ЛТ и АТ свидетельствует о повышении устойчивости женщин к стрессу, и улучшении адаптивности и общей нормализации психического статуса.
Эти положительные изменения могут иметь объяснение за пределами гипотезы «эстрогенового воздействия». Утрата адаптивных способностей в любых тканях тесно связана с митохондриальной дисфункцией, которая является основой как функциональных нарушений ЦНС, так и формирования нейродегенеративных заболеваний, в том числе у женщин в постменопаузе [23, 24]. Более того, клетки, содержащие поврежденные митохондрии, иначе реагируют на сигналы эстрогенов [25], формируя вместо ожидаемых положительных негативные клинические эффекты. Рост уровня эстрадиола в сочетании с улучшением митохондриальной функции на фоне применения БАД амберен позволяет надеяться на высокую степень безопасности и предсказуемость терапии.
Особое место в программе ведения женщин в климактерическом периоде занимает стабилизация массы тела и профилактика ожирения. Проблема увеличения веса у женщин в период пери- и постменопаузы хорошо известна [26], но клеточный компонент кардиометаболического риска недооценен. Связанные с ожирением дислипидемии, гипергликемия, воспаление инициируют вторичную дисфункцию митохондрий [27, 28], которая незамедлительно отзывается на функционировании тканей. Прием БАД амберен привел к достоверному уменьшению у пациенток веса, ИМТ, окружности талии. Редукция жировой ткани косвенно подтверждалась значимым снижением уровня лептина [29, 30], что позволяет предположить позитивный эффект лечения в отношении метаболического риска.
Таким образом, БАД амберен обладает разнонаправленным положительным действием и может использоваться в лечении менопаузальных симптомов у женщин в периоде менопаузального перехода и постменопаузе.



